基于网络药理学及动物实验探讨补肾助孕方降低卵巢凋亡水平治疗黄体功能不全的作用与机制
唐星冉,周惠芳,刘心媛,杨晓田
(南京中医药大学附属医院,江苏 南京 210046)
女性未避孕,性生活正常,与配偶同居1年而未孕者,称为不孕症[1]。随着社会的发展,女性不孕症的发病率逐年上升,被列为医学界三大难治性疾病之一,黄体功能不全(luteal phase deficiency,LPD)是导致不孕症的重要原因之一[2-4]。中医并无“黄体功能不全”的病名,根据其临床表现可归为“月经先期”“不孕症”“胎漏”“胎动不安”等[1]。
补肾助孕方由淮山药15 g,醋柴胡6 g,丹参10 g,菟丝子15 g,炒白芍10 g,山茱萸10 g等8味中药组成,为周惠芳教授在国医大师夏桂成的学术思想指导下,由经验方进一步凝练而成,治疗肾虚肝郁所致的黄体功能不全性不孕症、流产疗效显著,临床总有效率达94.51%[5-6]。肾虚肝郁所致黄体功能不全临床表现多具有“月经先期”“痛经”“腰膝酸软”“心烦易怒”等症。
课题组前期研究表明,补肾助孕方能够通过调节垂体GnRH 受体信号转导系统调节垂体促性腺激素的分泌水平;提高LPD 模型大鼠卵巢抗氧化能力,缓解卵巢氧化应激压力;促进黄体毛细血管生成;显著提高卵巢黄体细胞分泌E2、P 水平;改善子宫内膜容受性等从而达到改善LPD 的目的[7-13]。基于此,本研究采用网络药理学方法,对补肾助孕方治疗LPD 的作用机制进行预测,并采用动物实验验证部分靶点及信号通路,进一步探究其作用机制。
BN(Brown Norway)大鼠是国际上公认研究妊娠失败和低生育力病因的独特动物模型,其生殖功能障碍与黄体功能不全和循环孕酮水平低有关[14-16],因此本研究采用BN大鼠进行动物实验验证。
1 材料
1.1 实验动物
SPF 级雌性BN 大鼠50 只,12 周龄,体质量180~200 g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(苏2019-0005)。动物入室后饲养于SPF级屏障环境,使用许可证号为SYXK(苏)2018-0049,动物自由饮水摄食,12 h/12 h昼夜循环,室温(23±3)℃,相对湿度40%~70%。本实验设计已通过南京中医药大学动物伦理审核,批准号为202005A040。
1.2 药物
地屈孕酮(荷兰苏威制药有限公司,规格10 mg/片,批号:362941)制成剂量为0.002 g/kg 的混悬液;补肾助孕方所用药材经南京中医药大学中药鉴定教研室刘圣金副教授鉴定为正品,均符合2015年版《中华人民共和国药典》的相关项要求,煎煮后使用旋转蒸发仪将水提液分别浓缩至含生药量为4.5、9.0、18.0 g/kg的补肾助孕方溶液,等效剂量为9.0 g/kg。
1.3 试剂
大鼠含半胱氨酸的天冬氨酸水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)内参引物、大鼠含半胱氨酸的天冬氨酸水解酶-7(cysteinyl aspartate specific proteinase-7,Caspase-7)内参引物、大鼠含半胱氨酸的天冬氨酸水解酶-9(cysteinyl aspartate specific proteinase-9,Caspase-9)内参引物(批号:250109459);兔Bax 抗体、兔Bcl-2 抗体(英国Abcam 公司,批号分别为ab32503、ab196495);Total RNA Isolation Kit 组织总RNA 提取试剂盒、Master Mix(南京诺唯赞生物科技有限公司,批号分别为L/N 7E530C1、Q712-02/03);DEPC 水(上海翊圣生物科技有限公司);RIPA 裂解液(上海碧云天生物科技有限公司)。
1.4 仪器
Infinite M200 PRO 型微孔板检测仪(瑞士Tecan 公司);MM400 型混合球磨仪(德国Retsch 公司);Quant Studio 7Flex 型实时荧光定量聚合酶链式反应(Realtime PCR)仪(美国Thermo 公司);高速冷冻离心机(德国Eppendorf 公司);96 孔PCR 反应板(美国Bio-Rad公司);超纯水系统(美国Millipore公司)。
2 方法
2.1 网络药理学
2.1.1 补肾助孕方靶点、LPD 靶点、药物与疾病潜在靶点预测
利用TCMSP 数据库及文献检索,收集补肾助孕方各个药物活性成分。根据ADME 原则,筛选条件为口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18。数据库未收录药物,文献检索后获取其有效成分。运用UniProt 数据库将靶点标准化,限定物种为人源,作为补肾助孕方活性成分靶点。以“dysmenorrhea”“advanced menstruation”“sore and pain in loin and legs”“restlessness and irritability”为关键词,分别在GeneCards、OMIM、DrugBank 3 个数据库进行检索,重复靶点保留1个,建立LPD 靶点库。借助Venny网站将补肾助孕方活性成分靶点与LPD 靶点取交集,得到共同靶点,导入Cytoscape 软件,构建“补肾助孕方-活性成分-潜在靶点”网络图。
2.1.2 PPI网络构建、关键靶点筛选
将交集靶点导入STRING 数据库,设定物种为人源,设置最小交互值为“high confidence >0.9”,其余保持默认,得到关键靶点的蛋白质互作(protein-protein interaction,PPI)信息。保存TSV 文件,使用Cytoscape软件中cytoHubba插件筛选治疗的核心靶点。
2.1.3 GO、KEGG通路富集分析
将共同靶点导入DAVID 数据库,物种选择为人源,其余保持默认,进行富集分析。结合课题组前期研究结果,选取Apoptosis信号通路进行验证。
2.1.4 分子对接
通过TCMSP数据库及PubChem数据库得到补肾助孕方成分的3D结构信息,同时通过PDB数据库下载靶蛋白的3D结构,使用Autodock 软件对小分子和靶蛋白进行加氢、去电荷,借助PyMOL软件插件找到对接活性位点,即可在Autodock Vina 软件将处理后的成分与靶蛋白进行分子对接,最后通过PyMOL 软件将对接结果进行可视化。
2.2 动物实验
2.2.1 分组
将BN 大鼠适应性喂养5 d 后,于每日上午9 时进行大鼠阴道涂片,连续观察2~3 个动情周期,了解大鼠动情周期变化情况,使用随机数表法将大鼠分为模型组、地屈孕酮组和补肾助孕方低、中、高剂量组等5组,每组10只。
2.2.2 给药
每日上午9 时对各组大鼠进行阴道涂片,确认大鼠进入动情后期后,分别灌服地屈孕酮、中药直至大鼠进入下一个动情前期,持续给药3 个动情周期。参考徐叔云主编《实验药理方法学》,60 kg 成人与200 g 大鼠按体表面积折算的等效剂量比值为6.25,补肾助孕方临床用量为86 g,补肾助孕方低、中、高剂量分别给予补肾助孕方溶液4.5、9.0、18.0 g/kg 灌胃,中剂量组为成人的等效剂量,低、高剂量组分别为成人等效剂量的0.5 倍和2 倍。地屈孕酮组给予地屈孕酮溶液0.002 g/kg灌胃,模型组给予等体积双蒸水灌胃。
2.2.3 取材
各组大鼠末次给药后禁食不禁水,予10%水合氯醛溶液3.5 mL/kg腹腔注射麻醉,腹主动脉采血后断颈处死,迅速取出卵巢,液氮速冻后置-80 ℃冰箱备测。
2.3 观察指标
2.3.1 实时荧光定量PCR法检测大鼠卵巢Caspase-3、Caspase-7、Caspase-9 mRNA表达水平
使用诺唯赞试剂盒提取BN 大鼠卵巢组织总RNA,测定RNA 样品浓度及纯度,逆转录为c-DNA,置于-20 ℃冰箱。PubMed 基因数据库中检索大鼠Caspase-3、Caspase-7、Caspase-9 mRNA 引 物序列,由上海生工公司设计、合成引物,序列见表1。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,相同基因设3 个复孔、4 次平行实验,得到各扩增反应的CT 值,使用QuantStudio 6&7 PCR System 及GraphPad Prism 8.0软件进行数据处理,采用2-ΔΔCt进行相对定量。

表1 PCR引物序列
2.3.2 免疫组化检测大鼠卵巢Bcl-2、Bax表达
大鼠卵巢组织切片,脱蜡、水化、抗原修复,滴加3% H2O2室温孵育10 min,山羊血清封闭,37 ℃孵育10 min,滴加一抗(1∶100),4 ℃孵育过夜,5 min PBS 冲洗3 次,二抗孵育30 min,滴加适量辣根酶标记的链霉卵白素工作液(S-A/HRP),37 ℃孵育20 min,显色剂显色,封片后在显微镜下观察。应用Image pro-Plus图像分析软件测定积分光密度。
2.4 统计学方法
实验数据采用GraphPad Prism 8.0 软件进行分析。定量资料以±s表示,多组间比较如符合正态分布且方差齐采用单因素方差(One-way ANOVA)分析,若不符合正态分布或方差不齐使用非参数检验(Nonparametric tests),P <0.05表示差异有统计学意义。
3 结果
3.1 补肾助孕方活性成分及靶点的筛选结果
根据TCMSP 数据库检索结果及文献检索,筛选后得到996个活性成分,去重后得到补肾助孕方146个成分,见表2。运用Uniprot 标准化得到232 个潜在靶点,从OMIM,DrugBank 及GeneCards3 个数据库中共得到3 195 个疾病靶点,将疾病与药物交集靶点数为158个,见图1。利用Cytoscape软件构建活性成分与靶点互作网络,见图2。
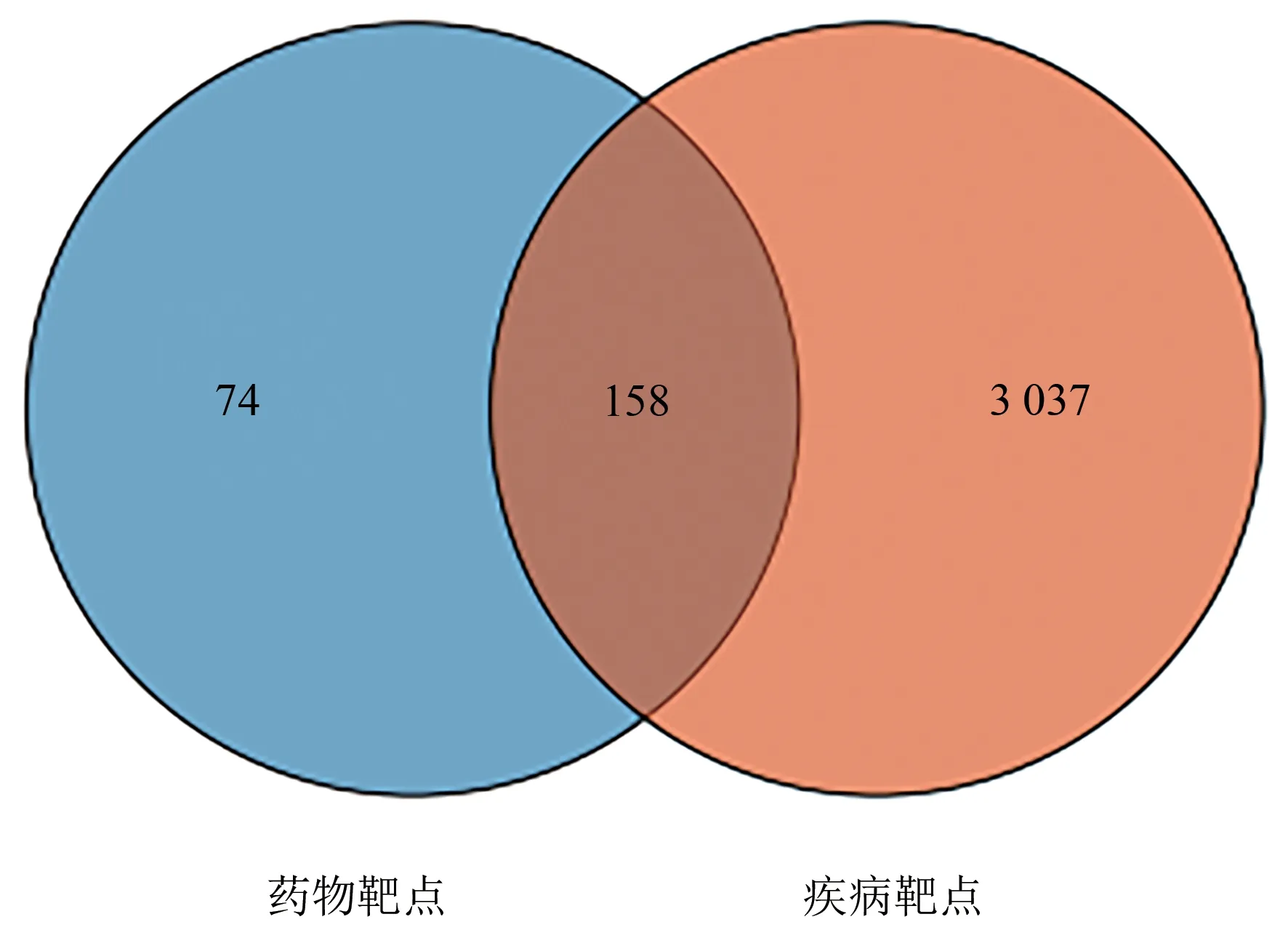
图1 补肾助孕方和黄体功能不全交集靶点韦恩图
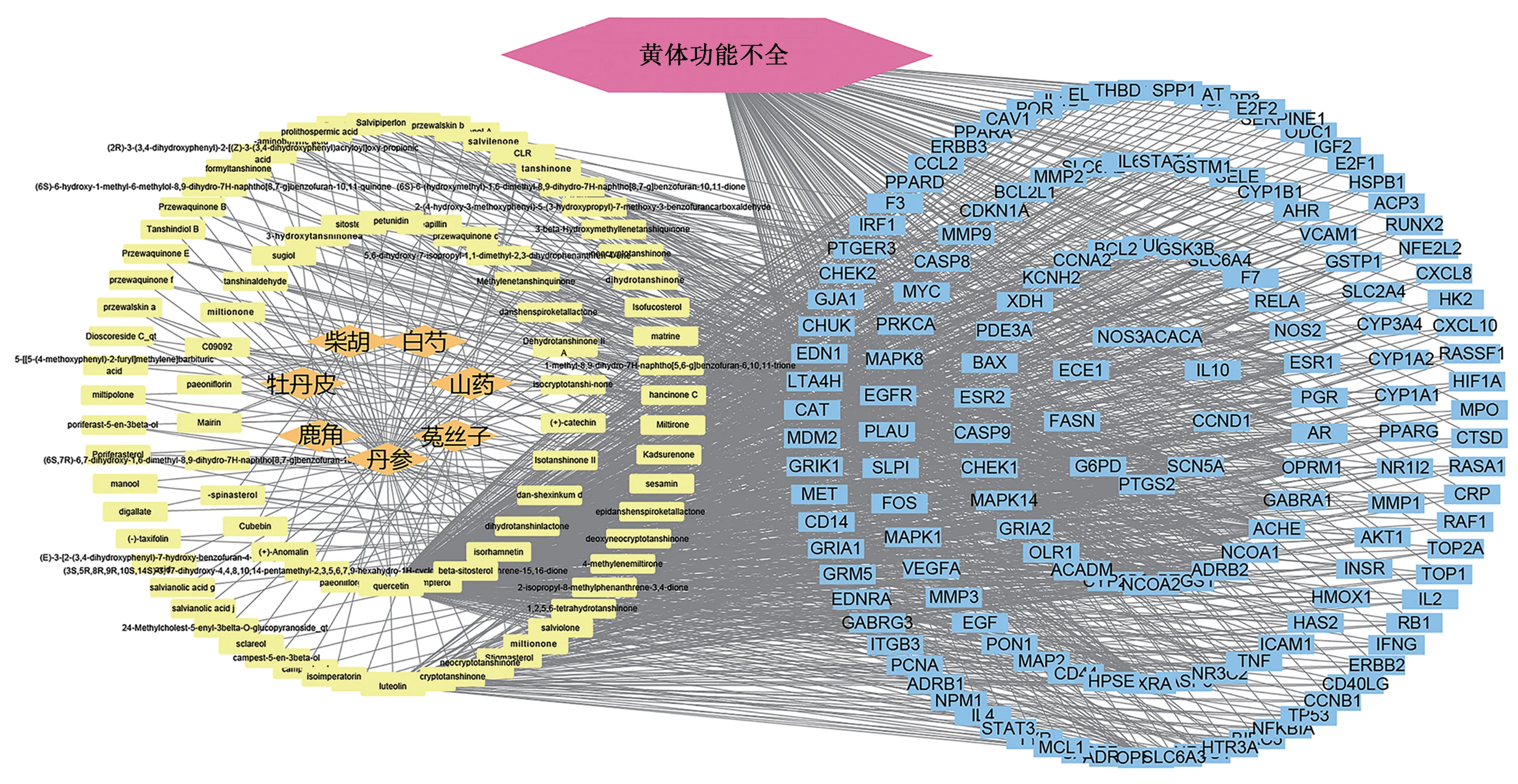
图2 “补肾助孕方-活性成分-潜在靶点”网络

表2 补肾助孕方活性成分信息
药物靶点居前5 位的活性成分为槲皮素、山柰酚、β-谷甾醇、木樨草素、丹参酮Ⅱa,推测可能是治疗LPD的核心活性成分。见表3。
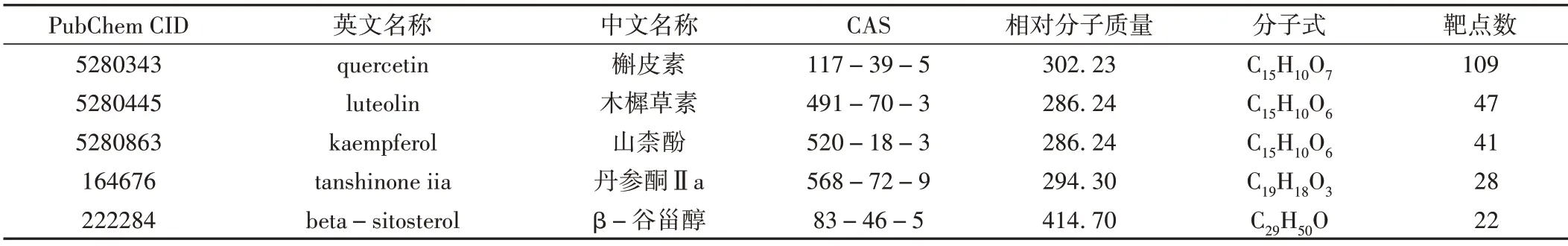
表3 补肾助孕方活性成分及靶点数
3.2 富集分析
以“P ≤0.01”和“bejamini ≤0.001”作为筛选条件,得到GO 条目136 条,选取生物过程(biological process,BP)、细胞组分(cell composition,CC)、分子功能(molecular fuction,MF)的前10 条通路进行展示,见图3。BP 主要包括RNA 聚合酶Ⅱ启动子转录的正向调控、凋亡过程的负调控、基因表达的正向调控、缺乏配体时的外部凋亡信号通路和对雌二醇反应等。CC 主要包括细胞外空隙、膜筏、核浆、胞液和质膜等。MF 主要包括酶结合位点、蛋白结合、转录因子结合、配体门控离子通道活性和RNA 聚合酶Ⅱ转录因子活性等。说明补肾助孕方可能通过促进细胞增殖、调控细胞凋亡、调控配体对雌二醇的反应等治疗LPD[13]。

图3 GO功能富集分析
在KEGG通路富集分析结果经筛选后共得到70条通路,对前20条信号通路进行可视化处理,见图4。其中纵坐标代表富集的通路名称,横坐标为每条通路上的基因数占共有靶点的比例。包括癌症相关信号通路(pathways in cancer、Endometrial cancer)、HIF-1信号通路(HIF-1 signaling pathway)、PI3K/Akt信号通路(PI3K/Akt signaling pathway)、FoxO 信号通路(FoxO signaling pathway)、MAPK 信号通路(MAPK signaling pathway)、凋亡相关信号通路(apoptosis)、p53 信号通路(p53 signaling pathway)、NF-κb 信号通路(NF-kappa B signaling pathway)及细胞周期(cell cycle)等。表明补肾助孕方化学成分主要分布于多条代谢通路,通过它们之间的相互协调作用,发挥抗氧化应激、抗凋亡、调控细胞周期等作用来治疗LPD。KEGG凋亡信号通路见图5。
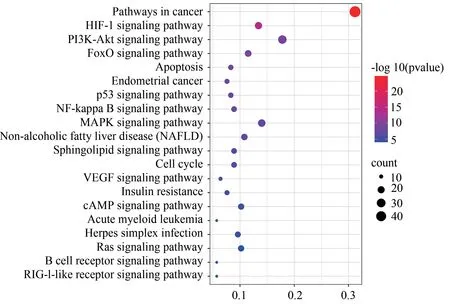
图4 KEGG通路富集分析
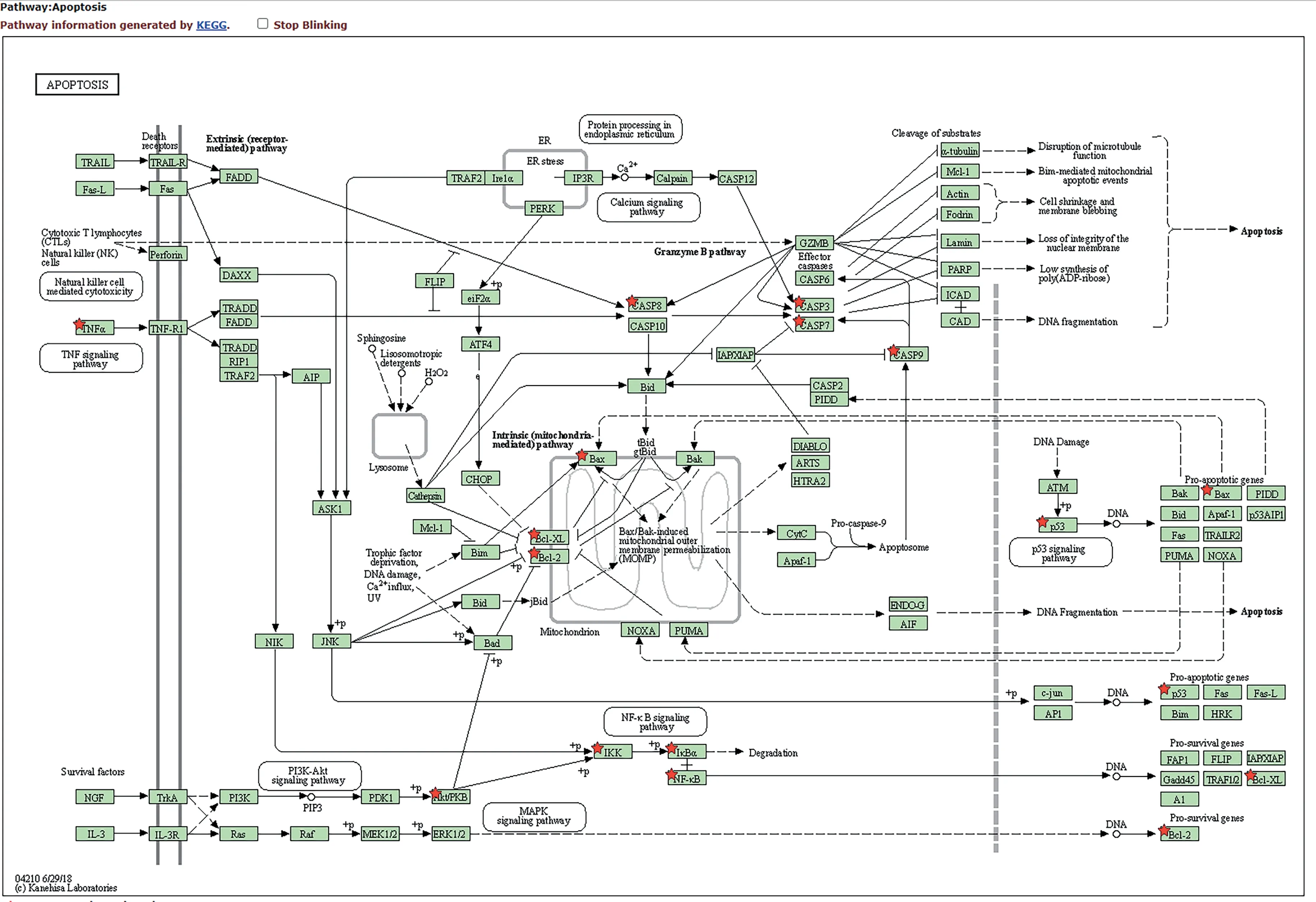
图5 KEGG凋亡通路
3.3 PPI网络构建及关键靶点筛选
利用STRING 数据库对补肾助孕方治疗黄体功能不全(LPD)相关的158 个靶点进行PPI 分析,见图6。将数据导入Cytoscape 中进行拓扑分析,计算出度值(degree),介数中心性(betweenness centrality,BC),接近中心性(closeness cebtrality,CC),其中degree 中位数为9,BC 的中位数为0.01,CC 的中位数为0.38,筛选degree >9、且BC >0.01、且CC >0.38的靶点有36个,可能是补肾助孕方治疗LPD 的关键蛋白,挑选前10位导入Cytoscape,绘制核心靶点图,见图7。其中多个蛋白,如JUN、STAT3、TP53、AKT1、MAPK1、TNF、FOS、MAPK14等与凋亡密切相关。
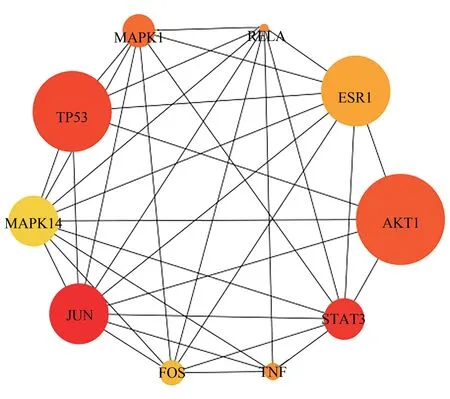
图7 补肾助孕方治疗黄体功能不全的核心靶点
3.4 分子对接
将5 个关键活性成分与凋亡相关靶蛋白进行分子对接。一般以结合能≤-5.0 kcal/mol 作为筛选标准[17-20],各化合物与蛋白均能较好地结合。利用PyMOL 软件选取关键活性成分和核心靶点蛋白结合最强的化合物进行3D图展示,见图8。

图8 分子对接模式图
3.5 对BN大鼠卵巢 Caspase-3、Caspase-7、Caspase-9 mRNA表达水平的影响
PCR 检测结果表明,与模型组相比,地屈孕酮组Caspase-3、Caspase-7、Caspase-9 mRNA 表达水平显著下调(P<0.01);补肾助孕方低剂量组Caspase-3 mRNA 表达水平下调(P<0.05);补肾助孕方中剂量组Caspase-3、Caspase-9 mRNA 表达水平显著下调(P<0.01);补肾助孕方高剂量组Caspase-3、Caspase-7、Caspase-9 mRNA表达水平下调(P<0.01,P<0.05)。见表5。
表5 补肾助孕方对各组大鼠卵巢Caspase-3、Caspase-7、Caspase-9 mRNA表达水平的影响(±s,n=3)
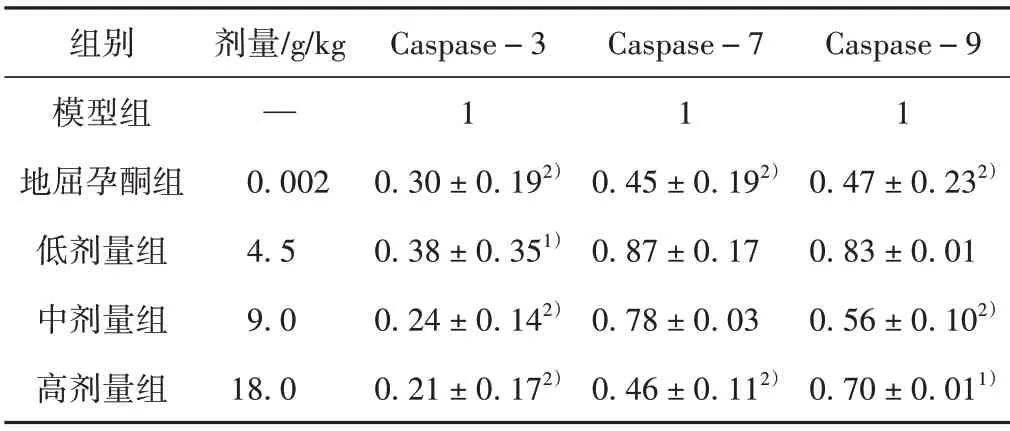
表5 补肾助孕方对各组大鼠卵巢Caspase-3、Caspase-7、Caspase-9 mRNA表达水平的影响(±s,n=3)
注:与模型组比较,1)P <0.05,2)P <0.01。
组别模型组地屈孕酮组低剂量组中剂量组高剂量组剂量/g/kg—0.002 4.5 9.0 18.0 Caspase-3 1 0.30±0.192)0.38±0.351)0.24±0.142)0.21±0.172)Caspase-7 1 0.45±0.192)0.87±0.17 0.78±0.03 0.46±0.112)Caspase-9 1 0.47±0.232)0.83±0.01 0.56±0.102)0.70±0.011)
3.6 对BN大鼠卵巢Bcl-2、Bax表达水平的影响
免疫组化结果表明,与模型组相比,地屈孕酮组和补肾助孕方低、中、高剂量组Bcl-2 表达水平显著上调(P<0.01);地屈孕酮组、补肾助孕方中剂量组Bax表达水平显著下调(P<0.01)。见表6和图9。
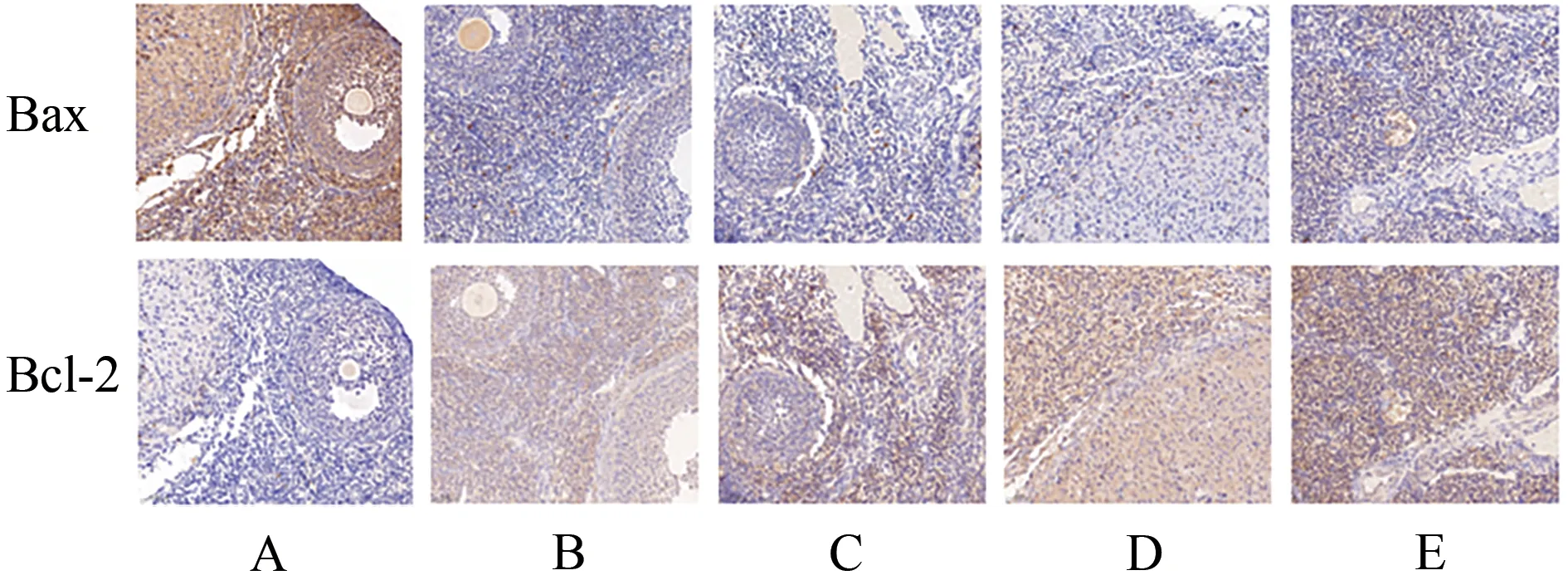
图9 各组大鼠卵巢Bax/Bcl-2免疫组化图(比例尺:50 μm)
表6 补肾助孕方对各组大鼠卵巢Bax、Bcl-2表达水平的影响(±s,n=3)
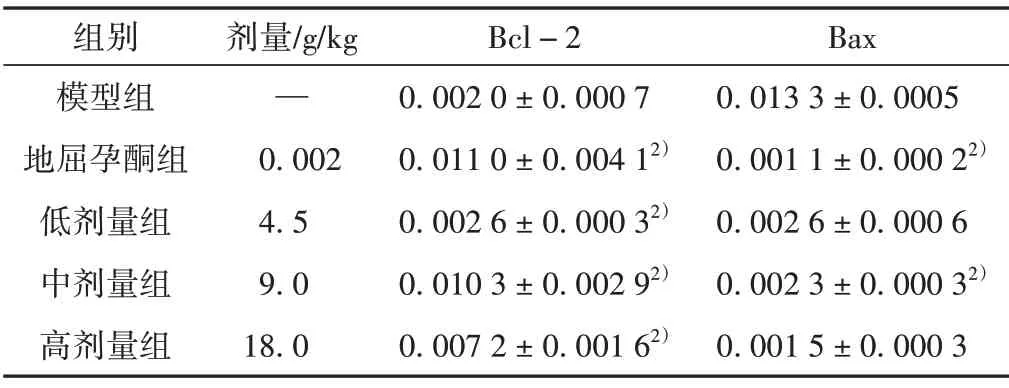
表6 补肾助孕方对各组大鼠卵巢Bax、Bcl-2表达水平的影响(±s,n=3)
注:与模型组比较,2)P <0.01。
组别模型组地屈孕酮组低剂量组中剂量组高剂量组剂量/g/kg—0.002 4.5 9.0 18.0 Bcl-2 0.002 0±0.000 7 0.011 0±0.004 12)0.002 6±0.000 32)0.010 3±0.002 92)0.007 2±0.001 62)Bax 0.013 3±0.0005 0.001 1±0.000 22)0.002 6±0.000 6 0.002 3±0.000 32)0.001 5±0.000 3
4 讨论
黄体(corpus luteum,CL)是雌性哺乳动物卵巢中的暂时性分泌组织,由卵泡排卵后的泡膜细胞和颗粒细胞分化而成,其主要功能是分泌孕酮以维持妊娠及调节发情周期。研究显示,黄体的结构以自噬和凋亡两种方式退化,凋亡是人类溶黄体的重要特征之一,形态学研究提示自噬促进了黄体的溶解[21-23]。内质网应激诱发的未折叠反应参与山羊黄体维持和退化过程,山羊晚期黄体中存在黄体细胞的凋亡[24]。部分学者认为Fas 配体和Fas 系统是黄体细胞凋亡的主要机制[25]。黄体细胞凋亡是黄体退化的一个重要环节,细胞凋亡的调控伴随着黄体的维持和退化进程[26]。因此,黄体功能不全的发生可能与黄体细胞过早凋亡相关。
网络药理学研究结果显示,槲皮素、山柰酚、β-谷甾醇、木樨草素、丹参酮Ⅱa 等可能是治疗LPD 的核心成分,分子对接结果也证明核心成分与凋亡相关靶点有良好的结合能力。槲皮素可抑制各种肿瘤细胞的增殖,与凋亡调节因子Bax 和Bcl-2 有关,能调节Caspase[27-28];山柰酚呈现雌激素样活性,其介导凋亡的主要途径为改变细胞周期,同时山柰酚是最有效的活性氧自由基清除剂[29-31];β-谷甾醇可促进颗粒细胞增殖,抑制凋亡,通过影响雌激素受体信号通路使GnRH分泌减少的状况得到缓解,发挥抗衰老作用[32-33];木樨草素能够显著增加超氧化物歧化酶(SOD)活性,具有明显的抗氧化作用,同时具有抗脂代谢紊乱及抗细胞凋亡作用[34];丹参酮具有抗氧化应激、抑制细胞凋亡作用[35-37]。
同时,KEGG 通路富集结果提示,补肾助孕方治疗LPD 的潜在治疗靶点主要集中在PI3K/Akt、MAPK、凋亡、p53 等信号通路。其中PI3K/Akt、MAPK、p53 等均与凋亡信号通路相关。核心靶点中,JUN、STAT3、TP53、AKT1、MAPK1、MAPK14等多个蛋白靶点与凋亡密切相关。故本研究选取凋亡信号通路作为研究对象。
免疫组化结果表明,补肾助孕方各剂量组Bcl-2表达水平上调;补肾助孕方中剂量组Bax 表达水平显著下调。PCR 结果表明,补肾助孕方各剂量组Caspase-3 mRNA表达水平不同程度下调;补肾助孕方高剂量组Caspase-7 mRNA表达水平显著下调;补肾助孕方中、高剂量组Caspase-9 mRNA表达水平不同程度下调。表明补肾助孕方可能可以降低卵巢凋亡水平。
综上所述,本研究通过网络药理学分析及动物实验验证,发现补肾助孕方可能通过调节细胞凋亡信号通路,调节细胞凋亡信号通路上靶蛋白表达,从而达到治疗LPD的作用。
但本研究仍存在不足之处,筛选得到的成分仅考虑其活性,并未考虑到煎煮过程中可能发生化学反应产生新物质及活性成分入血情况。同时,分子对接及动物实验仅验证部分关键靶点,在此基础上,可进一步通过体内外实验验证其他靶点作用情况,从而更全面、深入、科学阐释补肾助孕方作用机制。

