铁钛双金属MOF类芬顿材料的制备及其对卤代苯醌的吸附降解研究
刘 帅,胡思前,朱天容
(江汉大学 光电化学材料与器件教育部重点实验室,湖北 武汉 430056)
MOF材料是一类新型的金属有机框架材料,单一金属的MOFs材料的金属位点大小以及排列方式是有序的[1−2],但是大小不同的金属节点和无规则的排列更有利于其催化反应活性,因此会引入第二金属来调节材料活性[3]。铁在大自然中来源较广且易得,钛对人类有特殊的亲和性,被称为“生物金属”,因此本文选用铁、钛作为原材料合成铁钛双金属MOF材料。使用常见的自来水消毒法会生成卤代苯醌类物质[4],此类物质会引发膀胱癌[5],处理卤代苯醌类物质常用明矾吸附或用氧化物氧化的方法[6],但传统的方法效率很低,因此选用芬顿法进行处理。但芬顿法也有一些缺点,如H2O2的利用率很低、反应的Fe会造成一定污染等[7]。因此本文选用铁钛双金属MOF材料作为类芬顿材料对2,6−二氯−1,4−苯醌进行处理研究。
1 实验部分
1.1 试剂与药品
钛酸异丙酯(C12H28O4Ti)、乙酰丙酮铁(C15H21FeO6):上海麦克林生化科技有限公司,分析纯;2−氨基对苯二甲酸(C8H7NO4):国药集团化学试剂有限公司,分析纯;N,N−二甲基甲酰胺(DMF):上海阿拉丁试剂有限公司,分析纯,99.5%;无水乙醇:国药集团化学试剂有限公司,分析纯。
1.2 测试仪器
傅里叶变换红外光谱仪:TENSOR 27,德国Bruker公司;X射线衍射仪:X′Pert Powder,荷兰PANalytical公司;热重分析仪:TG 209 F3,德国Netzsch公司;扫描电子显微镜(SEM):HITA−HI Su8010,日立Hitachi公司;透射电子显微镜(TEM):HITACHI H−7650,日立Hitachi公司;紫外可见分光光度计:UV−2550,日本岛津公司。
1.3铁钛双金属MOF材料的合成
称取0.56 g NH2−BDC配体和一定量的乙酰丙酮铁粉末于100 mL烧杯中,加入36 mL DMF和4 mL甲醇,超声溶解30 min。完全溶解后,再加入0.6 mL钛酸异丙酯,再进行超声溶解,用玻璃棒将混合液转入100 mL反应釜,设置反应温度为150℃,反应时间为24 h。反应结束后,待反应釜冷却,将产物用玻璃棒转移至布氏漏斗上进行洗涤抽滤。用DMF与甲醇洗涤2~3次后,放入70℃的烘箱中烘干24 h。待其冷却后用石英研钵进行碾磨即可得到最终产物。原料配比如表1所示。

表1 铁钛双金属MOF材料合成原料配比Tab.1 The ratio of synthetic raw materials of iron-titanium bimetal MOF material
1.4双金属MOF材料的表征
1.4.1 扫描电子显微镜(SEM) 扫描电子显微镜用电子束扫描样品表面,再利用二次电子信号成像观测样品的表面形貌。具有分辨率高、放大倍数可调、放大范围大、景深及视场大以及制样简单等多种优点。
1.4.2 透射电子显微镜(TEM) 电子束作为TEM的光源比可见光和紫外光短很多,可以大大提高显微镜的分辨率,和SEM不同的是可以显示出样品内部的原子结构。
1.4.3 X−射线衍射(XRD) 将待测样品作为X−射线的光栅,通过它时会发生衍射,根据衍射线在空间的分布方位及其强度分析结晶度,可以通过这种方式确定晶体的结构。表征测试需要注意的是,要将待测样品细致研磨,并充分烘干。测试时的扫描范围为10°~90°。
1.4.4 傅里叶变换红外光谱分析(FTIR) 用傅里叶变换的方法来测量红外光谱,根据谱图的不同特征,用于鉴定待测物的官能团、化学结构以及物质的纯度等。在室温下的扫描范围为400~4 500 cm−1。
1.4.5 热重分析(TG) 热重分析用于测量物质的质量与温度或时间的关系。常应用于金属、地质、高分子材料以及药物的研究,在本次实验中,选择在空气气氛下加热至800℃,通过质量和温度的数据,来分析样品的热稳定性。
1.5 2,6-二氯-1,4-苯醌浓度的分析方法
1.5.1 2,6−二氯−1,4−苯醌浓度与吸光度的关系 DCBQ的初始浓度与吸光度的标准曲线见图1。通过紫外可见分光光度计全波长扫描,可知2,6−二氯−1,4−苯醌在282 nm处具有最大吸收波长,选取0.6~3.0 mg/L的梯度浓度的DCBQ溶液,测试其吸光度,拟合曲线。拟合曲线的相关度达0.997 93,说明该曲线标准可靠,溶液可用于接下来的性能测试。
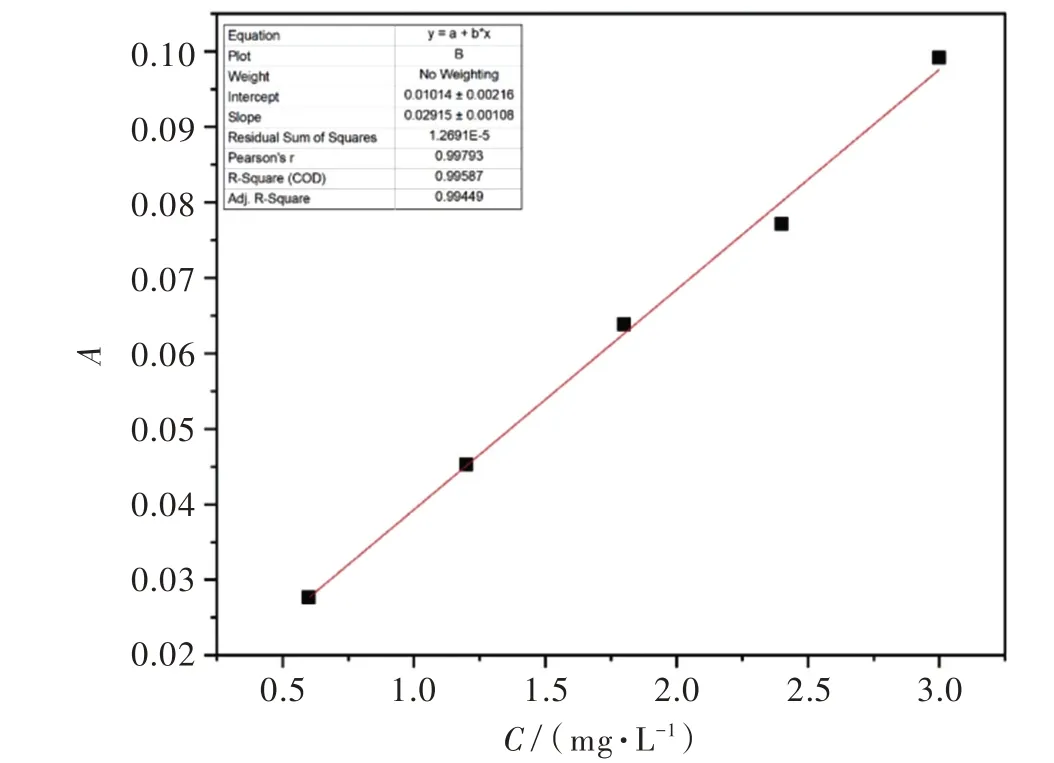
图1 DCBQ初始浓度与吸光度的标准曲线Fig.1 Standard curve of initial concentration and absorbance of DCBQ
1.5.2 2,6−二氯−1,4−苯醌初始浓度对吸附降解的影响 取5个洁净干燥的50 mL烧杯并编号,用移液管分别量取25 mL的0.6、1.2、1.8、2.4、3.0 mg/L的2,6−二氯−1,4−苯醌加入其中。用分析天平称取5份10 mg钛铁双金属MOF材料(Ti∶Fe=2.0∶0.6)加入不同浓度的标准溶液中,再加入磁石并做密封处理。将上述的5份样品搅拌24 h后过滤,取滤液,用紫外可见分光光度计测定滤液的吸光度,根据朗伯比尔定律和吸附降解率公式计算吸附降解率,绘制浓度−吸附降解率的曲线。
1.5.3 铁钛双金属MOF(Ti∶Fe=2.0∶0.6)的投加量对吸附降解的影响 取5个洁净干燥的50 mL烧杯并编号,用移液管移取25 mL 2,6−二氯−1,4−苯醌溶液。用分析天平分别称取10、20、30、40、50 mg铁钛双金属MOF材料加入标准溶液中,加入磁石密封烧杯,磁力搅拌24 h,过滤溶液,测量滤液的吸光度,根据朗伯比尔定律和吸附降解率公式计算吸附降解率,并绘制双金属MOF投加量−吸附降解率曲线。
1.5.4 有无双氧水对吸附降解的影响 取4个洁净干燥的50 mL烧杯并编号,1号烧杯加入25 mL 2,6−二氯−1,4−苯醌、10 mg铁钛双金属MOF材料和1 mL 3%双氧水;2号烧杯加入25 mL 2,6−二氯−1,4−苯醌和10 mg铁钛双金属MOF材料;3号烧杯加入25 mL 2,6−二氯−1,4−苯醌和1 mL 3%双氧水;4号烧杯只加入25 mL 2,6−二氯−1,4−苯醌。在4份样品中加入磁石,用保鲜膜密封烧杯口,磁力搅拌24 h后,过滤,用紫外可见分光光度计测量滤液的吸光度。根据朗伯比尔定律和吸附降解公式计算物质的吸附降解率。
朗伯比尔定律为:A=lg(1/T)=Kbc,其中A为吸光度;T为透光度;K为摩尔吸光系数;c为吸光物质的浓度,mol/L;b为吸收层厚度,cm。
吸附降解率(E)公式为
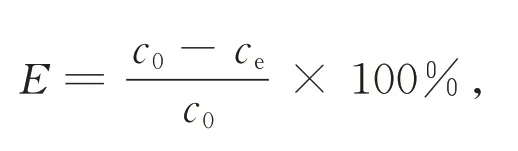
式中,c0为初始浓度;ce为吸附降解后的浓度。
2 结果与讨论
2.1 样品外观形貌分析
不同配比的产物外观形貌见图2。铁、钛与二氨基对苯二甲酸合成的产物都是红棕色细粉末物质,随着铁在反应中比例的提升,可以看到产物的颜色越来越偏向红色,这是铁的配位变多导致的。

图2 产物外观形貌Fig.2 Appearance and morphology of the product
2.2 扫描电子显微镜分析
Fe−Ti(0.6∶2.0)的SEM图像见图3。由图3可见,在放大至10μm条件下,样品的微观形貌为柱状晶体,但旁边有一些碎渣晶体,应该是样品处理时未完全处理掉的杂质。拥有比较完美的柱状晶型结构,根据文献[8]可以确定,成功合成了铁钛双金属MOF材料。
2.3 透射电子显微镜分析
Fe−Ti的TEM图像见图4。由图4可见,在放大至500 nm时,可以看到样品表面有圆形的孔状结构,且可以看见样品结构是堆叠的球形结构,查看相关文献[8]可以得出结论,铁钛双金属MOF材料合成成功。

图3 产物的SEM图像Fig.3 SEM image of the product
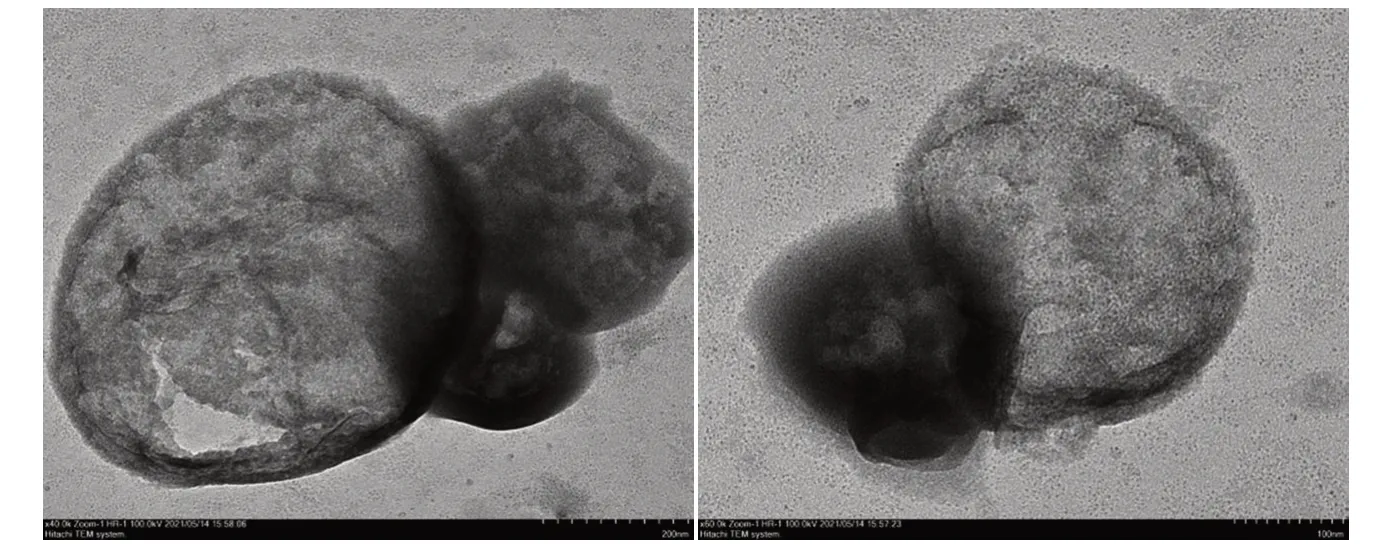
图4 产物的TEM图像Fig.4 TEM image of the product
2.4 样品的X-射线衍射分析
样品XRD图谱见图5。铁基MOF材料的特征峰为10°,钛基MOF材料的特征峰具有晶面间距与衍射角成反比的特征曲线的特征。由图5可见,在合成过程中,当铁的含量较低时,如Fe−Ti(0.2∶2.0)和Fe−Ti(0.3∶2.0)时,双金属MOF材料的晶形结构虽表现出了两种金属的性质,但更偏向于钛基MOF材料的晶形结构,随着铁的投加量增加,晶形结构逐渐向铁基MOF材料的结构偏向。另外,双金属MOF材料特征峰的位置均与单金属MOF材料的特征峰有所偏移,推测是第二种金属在配位的时候会改变单金属配位的结构和性质,造成了这种现象。对比4个样品的谱图,Fe−Ti(0.6∶2.0)的谱图最明显地表现出了双金属MOF材料的特征,由此判断该配比情况下铁钛双金属MOF材料的合成最佳。

图5 产物的XRD图像Fig.5 XRD image of the product
2.5 产物的红外谱图分析
根据铁钛双金属MOF材料的红外谱图(图6),在1 380和1 570 cm−1处为羧基上的C−O键对称和不对称伸缩振动峰,1 420和1 340 cm−1是COO−的特征峰,可推测铁钛双金属MOFs材料在结构上存在带有两个羧基的配体。880和800 cm−1处为苯环三元取代物特征峰,660 cm−1处为钛基MOFs材料中Ti−O的特征峰,与相关文献[9]对比,可见钛、铁成功与二氨基对苯二甲酸配位。
2.6 产物的热重分析
产物的热重曲线见图7,根据图7可以看出,温度上升至100℃之后样品开始有质量损失,直到400℃失重速率才降下来。100℃前失去的重量可能是MOF材料骨架吸附的水、溶剂、乙醇及一些杂质。100℃后失重速率变快可能是MOF材料的骨架开始被高温破坏,到400~430℃时,双金属MOF材料的骨架结构被完全破坏。通过文献[10]得知铁基单金属MOF材料在350℃左右几乎完全分解,钛基单金属材料在400℃几乎完全分解,而该材料在420℃才几乎完全分解,可以推断该材料的热稳定性强于铁基单金属MOF材料与钛基单金属MOF材料,热稳定性较好。

图6 产物的FTIR图像Fig.6 FTIR image of the product
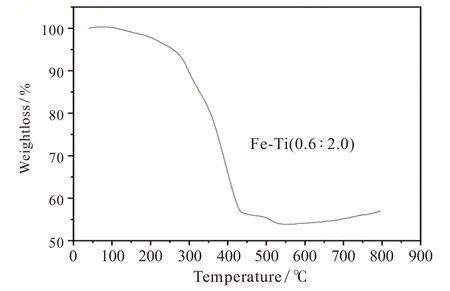
图7 产物的TG图像Fig.7 TG image of the product
2.7 2,6-二氯-1,4-苯醌初始浓度对吸附降解率的影响
初始浓度与吸附降解率的曲线见图8。使用10 mg Fe−Ti(0.6∶2.0)MOF,对DCBQ吸附降解24 h。完成吸附降解后绘制的曲线可以看出,在初始浓度为0.6 mg/L和1.2 mg/L时,吸附降解率呈现快速上升的趋势,在初始浓度为1.8 mg/L时达到最大值。再增加初始浓度时,吸附降解率则不再增加,甚至有下降趋势。
2.8 铁钛双金属MOF材料投加量对吸附降解率的影响
投加量与吸附降解率的关系见图9。由图9可见在投加量小于30 mg时,吸附降解率随着投加量增加而增加,且增长速率很快,直到投加量到30 mg时吸附降解率达到最大值,在投加量超过30 mg后,随着MOF材料的投加量增大,吸附降解率反而降低。因此可得知,MOF材料投加量的最佳值为30 mg。

图8 DCBQ初始浓度与吸附降解率的关系Fig.8 The relationship between the initial concentration of DCBQ and the removal rate
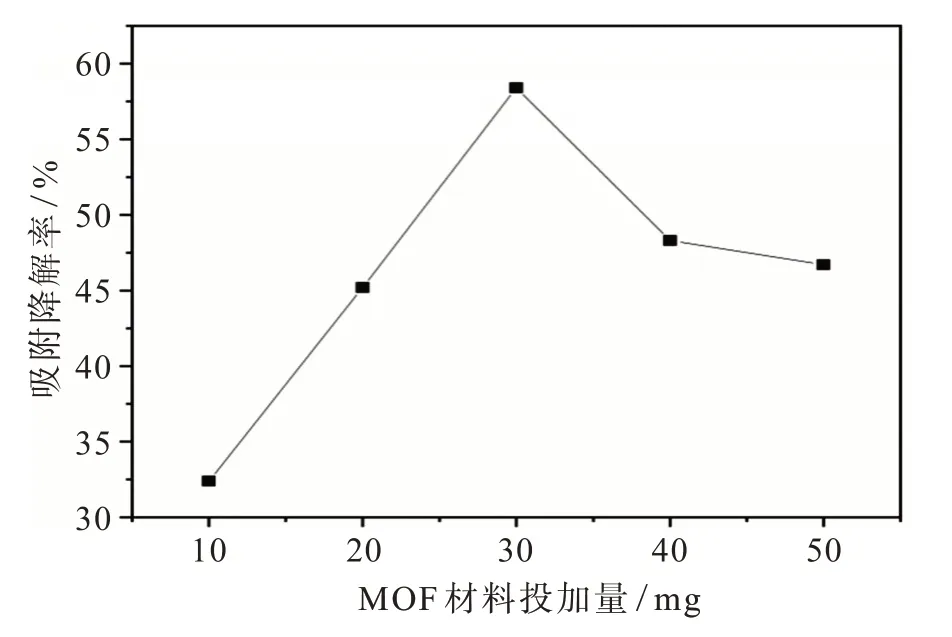
图9 投加量与吸附降解率的关系Fig.9 The relationship between the dosing amount and the removal rate
2.9 双氧水对吸附降解的影响
双氧水的加入对吸附降解率的影响见表2。2、4号样品改变的条件是是否投加铁钛双金属MOF材料,对比二者的吸附降解率可以看出,在未加入双氧水的体系中,投加铁钛双金属MOF材料对DCBQ的处理效果有显著的提升。通过2、3号样品吸附降解率的对比,可知在对DCBQ的处理中,双氧水的氧化处理比铁钛双金属MOF的吸附处理效果要好。最后对比1、3号样品的吸附降解率可以看出,在双氧水体系下投加铁钛双金属MOF后,二者形成了类芬顿体系,在这个体系下的吸附降解效果最佳。

表2 双氧水对吸附降解率的影响Tab.2 The influence of hydrogen peroxide on the removal rate
3 结论
本文使用乙酰丙酮铁、钛酸异丙酯与二氨基对苯二甲酸等原材料探究铁钛双金属MOF材料的合成。通过一系列的表征和反应数据得出下列结论:
1)反应温度150℃,反应时间24 h,钛与铁的物质的量比达到2.0∶0.6时,为铁钛双金属MOF材料的最佳合成条件。
2)通过改变DCBQ初始浓度、双金属MOF材料投加量以及双氧水,探究铁钛双金属MOF类芬顿材料对2,6−二氯−1,4−苯醌的吸附降解效果。通过一系列的分析得出结论,当DCBQ初始浓度为1.8 mg/L,投加30 mg铁钛双金属MOF材料和1 mL 3%的双氧水时,为最佳的吸附降解条件,吸附降解率达到98.58%。

