复合酶法制备杨梅汁工艺优化及品质分析
马剑,路高勇,陈智玲,高志红,李志强,王愈,马艳弘*
(1.山西农业大学食品科学与工程学院,山西 晋中 030801;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.丰县市场监督管理局综合检验检测中心,江苏 徐州 221700;4.南京农业大学园艺学院,江苏 南京 210095)
杨梅[Myrica rubra(Lour.)S.et Zucc.]是一种具有高经济价值和营养价值的杨梅科杨梅属亚热带常绿植物,在国内外均有种植[1]。杨梅富含酚酸和黄酮等物质,是一种对人体健康有益的水果[2]。杨梅汁液丰富、采收期短,不耐储存,每年至少30%以上的杨梅鲜果会腐烂变质,给果农造成了很大的经济损失。因此开展杨梅的深加工技术研究,降低资源浪费率并提高杨梅附加价值,具有深远的意义[3]。目前市场上常见的杨梅加工产品包括糖水杨梅罐头、果酱、果汁、果酒等[4],其中杨梅汁因具有较高的营养价值和较好的口感、风味,在市场上备受青睐。
生物酶解法是果蔬汁制备过程中较常应用的技术手段,酶解不仅可以有效破坏植物细胞壁、更好地释放细胞内容物,提高果蔬出汁率,还有利于果蔬汁的澄清稳定和色泽改善。杨电增等[5]、刘义庆等[6]、BIAN等[7]研究发现,在多糖、番茄红素等生物活性物质的提取以及果蔬汁的制备方面,纤维素酶和果胶酶具有协同增效的作用。杨梅汁独特的香气和酸甜味,是其成为消费者优选的重要因素[8-9]。气相色谱质谱仪用于分析挥发性化合物的分子式和分子结构[10-11],FANG等[12]研究发现,薄荷醇、石竹烯、4-松油醇、芳樟醇氧化物、芳樟醇和乙酸等化合物,构成杨梅果实独特的香气,但酶解后杨梅汁营养物质是否会发生变化,此类研究相对较少。
本研究采用纤维素酶和果胶酶酶解法制备杨梅汁,考察果胶酶与纤维素酶质量比、复合酶添加量、酶解温度和酶解时间对杨梅出汁率的影响,优化其制备工艺[13],并研究复合酶酶解法对杨梅汁营养成分、色泽、功能成分、抗氧化活性以及挥发性成分的影响,为高品质杨梅汁的制备提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
成熟期荸荠杨梅:南京福晶农业科技有限公司;果胶酶(≥40 U/mg)、纤维素酶(≥50 U/mg):上海蓝季生物公司;1,1-二苯基-2-三硝基苯肼(DPPH)、三吡啶基三嗪(tripyridine triazine,TPTZ)、苯酚、浓硫酸、福林酚、硝酸铝:南京化学股份有限公司;以上试剂均为分析纯。
1.2 仪器与设备
MJ-PB40E253C多功能榨汁机:美的集团股份有限公司;D-8紫外可见光分光光度计:上海奥析科学仪器有限公司;WSC-S色差仪:上海仪电物理光学仪器公司;WGZ-800浊度计;上海昕瑞仪器仪表有限公司;TGL-16B台式离心机:上海安亭科学仪器厂;WZS手持折光仪:邢台钜都科技有限公司;PHS-25型pH计:上海科晓科学仪器有限公司。
1.3 方法
1.3.1 杨梅汁的制备
将新鲜杨梅清洗、去核、打浆、称重,再加入一定量的果胶酶和纤维素酶,不同温度下酶解一定时间,在5000 r/min离心15min后取上清液,计算杨梅出汁率。

1.3.2 单因素试验
1.3.2.1 果胶酶与纤维素酶质量比对杨梅出汁率的影响
复合酶添加量0.40%、酶解温度50℃、酶解时间60 min条件下,考察果胶酶与纤维素酶质量比(4∶0、3 ∶1、2∶2、1 ∶3、0 ∶4)对杨梅出汁率的影响。
1.3.2.2 复合酶添加量对杨梅出汁率的影响
果胶酶与纤维素酶质量比3∶1、酶解温度50℃、酶解时间60 min条件下,考察复合酶添加量(0.25%、0.30%、0.35%、0.40%、0.45%、0.50%)对杨梅出汁率的影响。
1.3.2.3 酶解温度对杨梅出汁率的影响
果胶酶与纤维素酶质量比3∶1、复合酶添加量0.40%、酶解时间60 min条件下,考察不同酶解温度(25、35、45、55、65、75 ℃)对杨梅出汁率的影响。
1.3.2.4 酶解时间对杨梅出汁率的影响
以果胶酶和纤维素酶质量比为3∶1,复合酶添加量为 0.40%,酶解温度 45℃,考察酶解时间(0、30、60、90、120、150、180 min)对杨梅出汁率的影响。
1.3.3 响应面优化试验设计
在单因素试验的基础上,根据Box-Behnken试验设计原理,因复合酶质量比对杨梅出汁率影响较小,选取复合酶添加量、酶解温度和酶解时间为因素,通过响应面分析,优化杨梅出汁率最优工艺参数。具体因素及水平如表1所示。

表1 因素及水平编码Table 1 Coded levels for factors used in Box-Behnken design
1.4 杨梅汁理化指标测定
采用苯酚硫酸法[14]测定总糖含量;采用福林酚法[15]测定总多酚含量;采用分光光度计法[16]测定总黄酮含量;采用pH试差法[17]测定花色苷含量;采用考马斯亮蓝法[17]测定蛋白质含量;采用pH计测定pH值;采用电位滴定法[14]测定总酸含量;采用手持折光仪测定可溶性固形物含量;采用浊度仪法测定浊度;采用色差仪测定L值、a值、b值,以及在420、520、620 nm处测定杨梅汁的吸光度,根据参考文献[18]计算色度(CD=A420+A520+A620)、色调(T=A420/A520)。
1.5 抗氧化活性分析
1.5.1 DPPH自由基清除率测定
根据参考文献[13],取杨梅汁1mL于刻度试管,加入0.1 mmol/L DPPH溶液1 mL,摇匀后避光放置30 min,取上清液,测定517 nm波长处的吸光度。DPPH自由基清除率计算公式如下。

式中:A1为试验组吸光度;A2为对照组吸光度;A0为空白组吸光度。
1.5.2 羟基自由基清除率测定
根据参考文献[13],取杨梅汁1 mL于刻度试管,再加入2 mg/mL FeSO4溶液、1.5 mg/mL水杨酸溶液、1% H2O2溶液各1 mL,37℃水浴下避光反应15 min,在526nm波长处测定吸光度,·OH清除率计算公式如下。
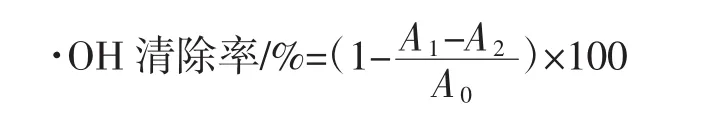
式中:A1为试验组吸光度;A2为对照组吸光度;A0为空白组吸光度。
1.5.3 总抗氧化能力测定
采用FANG等[15]的方法,配制0.1 mol/mL乙酸盐缓冲液(pH 3.6)、10 mmol/L TPTZ、20 mmol/L 氯化铁(10∶1∶1,体积比)的铁离子还原能力(ferric ion reducing antioxidant power,FRAP)试剂,取 1 mL 杨梅汁并添加9 mL FRAP试剂,混合均匀后,37℃水浴10 min,在593 nm处测定吸光度,带入标准曲线Y=0.000 7X+0.058 5(R2=0.998 7),计算 FRAP 值。
1.6 数据分析
所有试验均重复3次,试验结果取平均值,数据采用Origin 2019与Design Expert 8.0.6进行数据分析和图表绘制。采用SPSS 17.0进行ANOVA单因素方差分析,并检验数据的差异显著性(P<0.05,差异显著)。
2 结果与分析
2.1 复合酶制备杨梅汁单因素试验结果
2.1.1 果胶酶和纤维素酶质量比对杨梅出汁率的影响
果胶酶与纤维素酶质量比对杨梅出汁率的影响见图1。
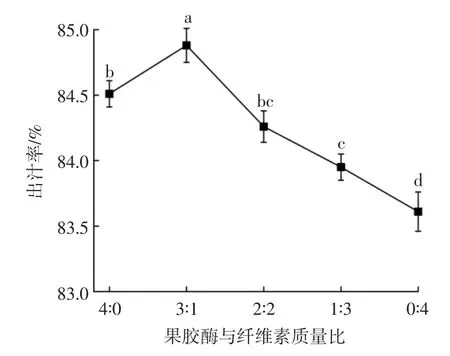
图1 复合酶质量比对杨梅出汁率的影响Fig.1 Effect of compound enzyme mass ratio on juice yield of bayberry
有研究表明,适宜环境条件下,复合酶作用效率高于单一酶[19-21]。如图1所示,果胶酶与纤维素酶质量比为3∶1时,杨梅出汁率最高,为84.88%,显著高于果胶酶与纤维素酶作用下杨梅出汁率(P<0.05),与ABOUELSEOUD等[22]、BIAN等[7]的研究结果相似。由此可知,果胶酶与纤维素酶质量比为3∶1时,为制备杨梅汁最适复合酶质量比。
2.1.2 复合酶添加量对杨梅出汁率的影响
复合酶添加量变化对杨梅出汁率的影响见图2。
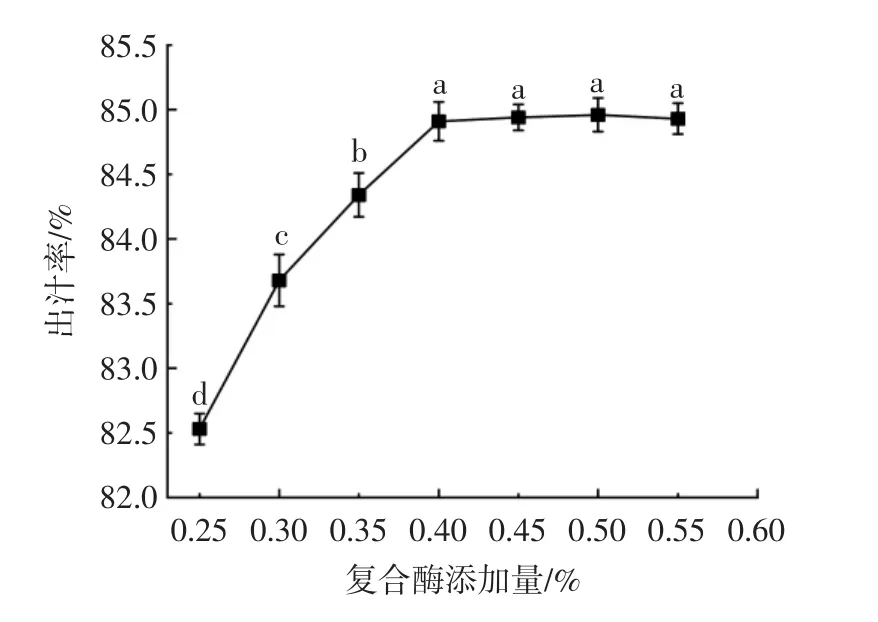
图2 复合酶添加量对杨梅出汁率的影响Fig.2 Effect of compound enzyme additionon juice rate ofbayberry
由图2可知,随着复合酶添加量的升高,杨梅出汁率呈先上升后趋于平稳的趋势。复合酶添加量为0.25%~0.40%时,酶解过程加速杨梅细胞破碎,杨梅出汁率显著升高(P<0.05),复合酶添加量为0.40%时,杨梅出汁率为84.91%,达到最大值,表明酶解作用完全;当复合酶添加量继续增加,底物缺失导致杨梅出汁率无显著变化(P>0.05)。故复合酶添加量0.40%为制备杨梅汁的最适添加量。
2.1.3 酶解温度对杨梅出汁率的影响
酶解温度对杨梅出汁率的影响见图3。

图3 酶解温度对杨梅出汁率的影响Fig.3 Effect of enzymatic hydrolysis temperature on juice rate of bayberry
温度对酶活力影响较大,低温环境下酶活力会降低;高温环境下,酶结构会被破坏,使其失活,无法发挥作用[23]。由图3可知,当酶解温度为25℃~45℃时,杨梅出汁率随着温度变化显著上升(P<0.05),并达到最大值为84.81%;继续升高酶解温度,杨梅出汁率开始下降。当酶解温度为75℃时,杨梅出汁率为81.62%,显著低于25℃条件下杨梅出汁率82.27%,表明在55℃~75℃温度环境下,复合酶易变性失活,无法提高杨梅出汁率。由此确定45℃为制备杨梅汁的最适酶解温度。
2.1.4 酶解时间对杨梅出汁率的影响
酶解时间对杨梅出汁率的影响见图4。
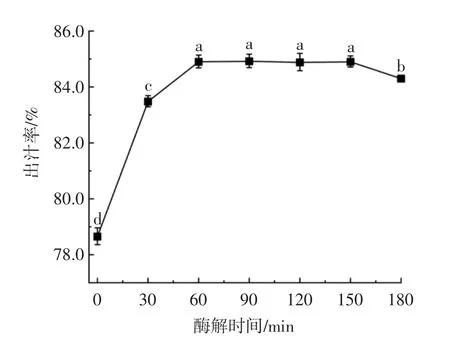
图4 酶解时间对杨梅出汁率的影响Fig.4 Effect of enzymatic hydrolysis time on juice rate of bayberry
酶解时间长短与实际工业化生产、经济效益和生产环境密切相关。由图4可知,在0~60 min,杨梅出汁率随着酶解时间的延长而升高,酶解时间为60 min时,杨梅果浆已酶解完全,杨梅出汁率达到最大值,为84.90%;在60 min~150 min时,杨梅出汁率无显著变化(P>0.05)。由此确定60 min为制备杨梅汁最适酶解时间。
2.2 响应面法优化复合酶酶解工艺
2.2.1 响应面试验方案及结果
在单因素试验的基础上,选取复合酶添加量X1、酶解温度X2、酶解时间X3为因素,出汁率Y为响应值,进行三因素三水平的响应面优化试验,测定结果见表2。
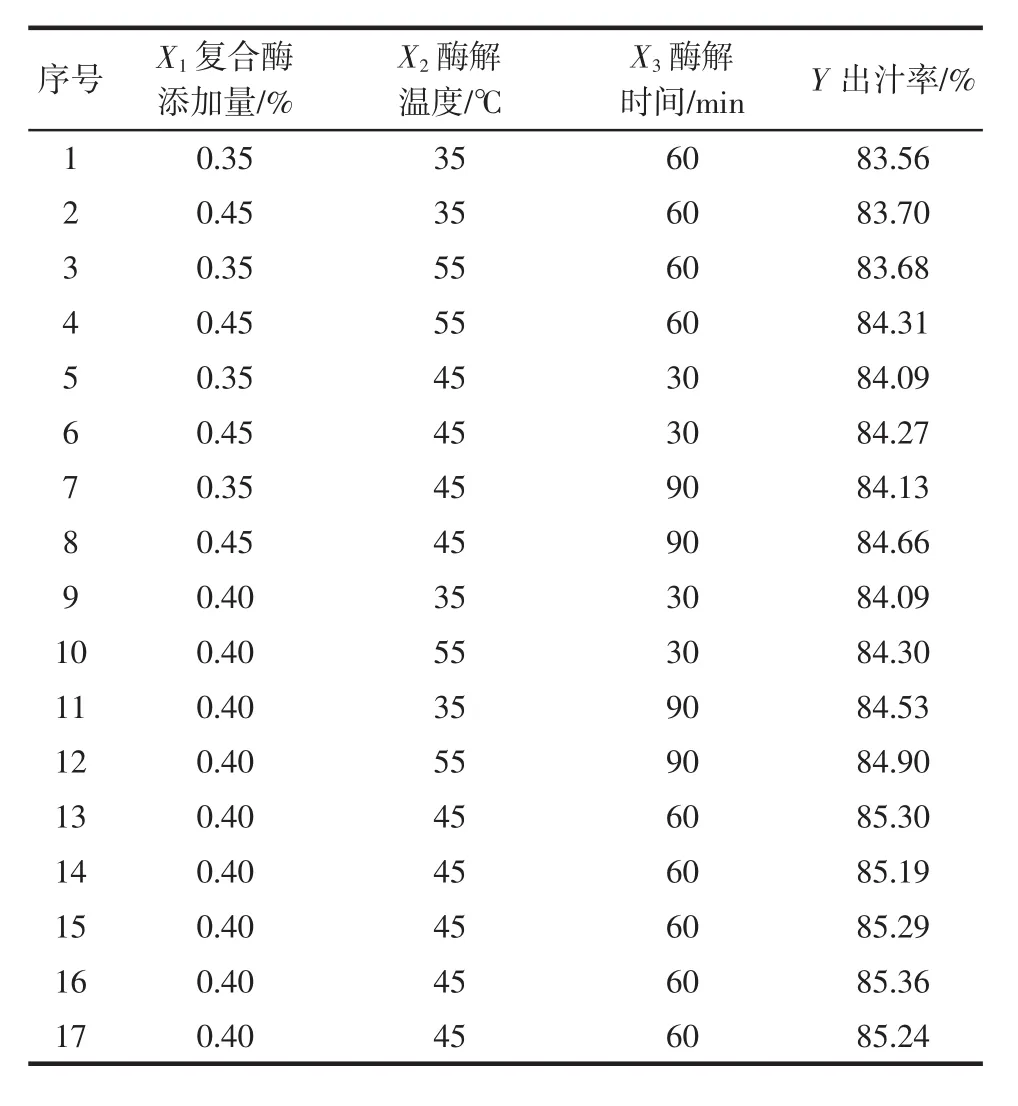
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
2.2.2 响应面数学模型建立与显著性检验
使用Design-Expert8.0.6统计分析软件对表2中的试验结果进行线性二次多项式回归拟合,建立二次多元回归方程:Y=85.28+0.18X1+0.16X2+0.18X3+0.12X1X2+0.088X1X3+0.040X2X3-0.82X12-0.65X22-0.17X32。模型和回归系数显著性检验见表3。
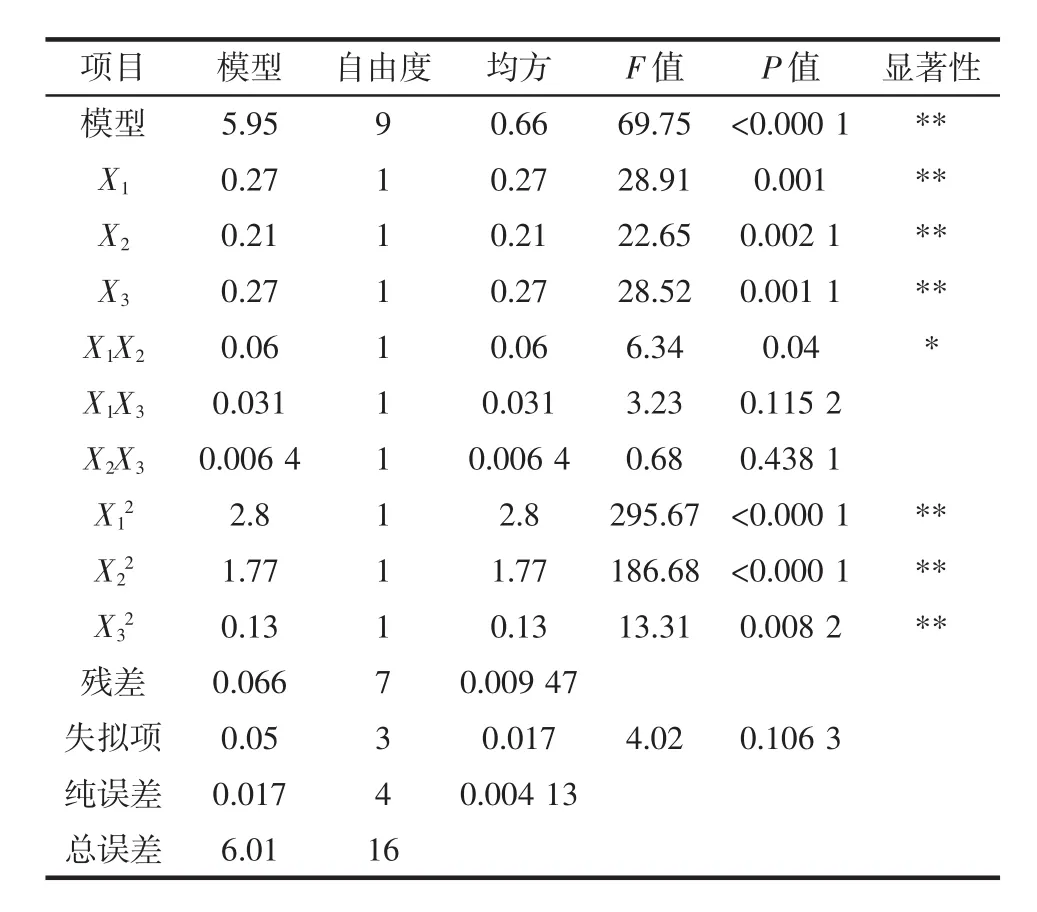
表3 模型和回归系数显著性检验Table 3 Significance test of the fitted model and its regression coefficients
由表3可知,该模型极显著(P<0.000 1),失拟项P=0.106 3>0.05,不显著;R2=0.989 0,R2Adj=0.974 8,说明该数学模型与试验结果拟合较好,试验值与预测值有着高度的相关性,各因素与响应值间线性关系显著,可用于杨梅出汁率理论预测。由F值检验可知,各因素对杨梅出汁率的影响大小顺序为复合酶添加量(X1)>酶解时间(X3)>酶解温度(X2)。
2.2.3 响应面分析
复合酶添加量、酶解温度和酶解时间的交互作用见图5。

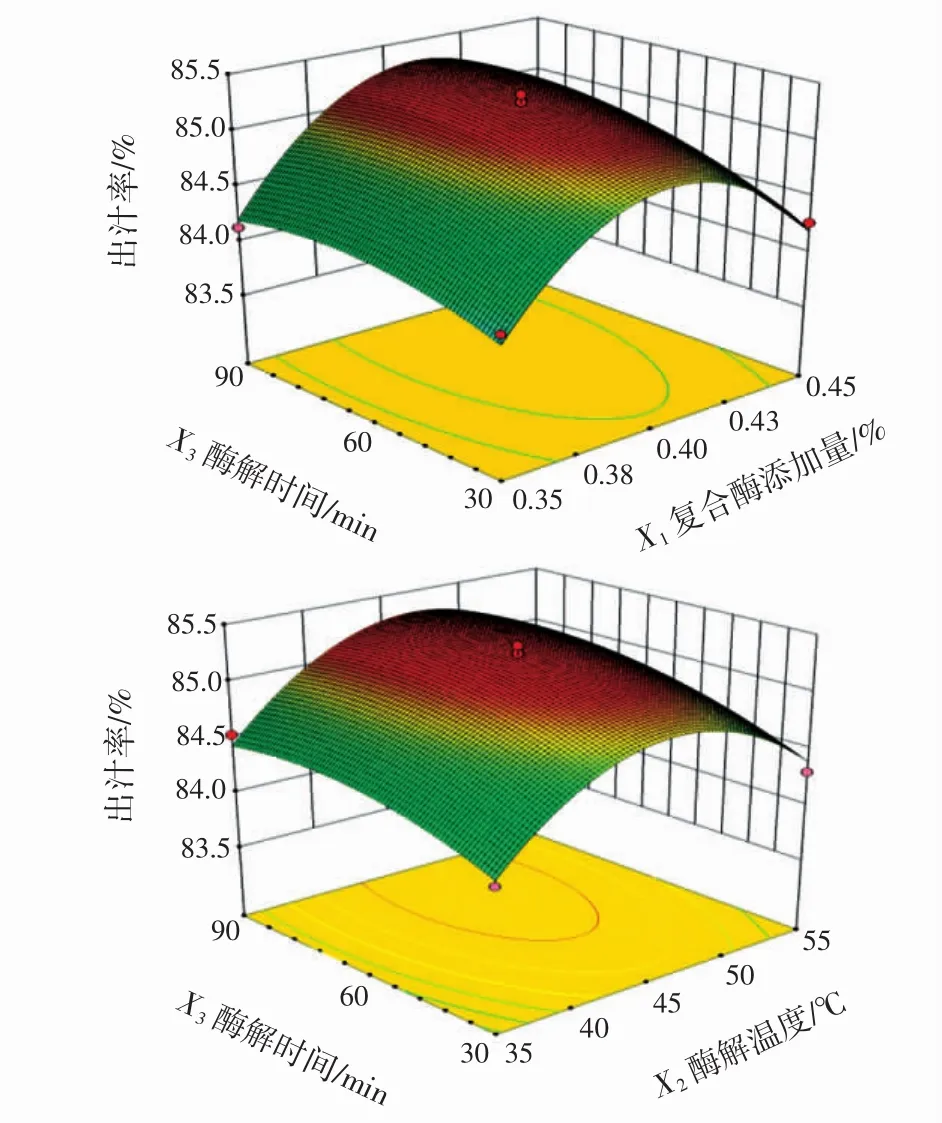
图5 因素交互作用图Fig.5 Interaction of factors and contour map
3D图可直观地反映各因素对杨梅出汁率影响程度,由表3和图5可知,X1、X2、X3、X12、X22、X32对杨梅汁得率的影响极显著(P<0.01),X1X2对杨梅汁得率的影响显著(P<0.05),表明复合酶添加量与酶解温度交互作用显著。
通过响应面分析法获得杨梅酶解最优工艺条件为复合酶添加量0.408%、酶解温度46.59℃、酶解时间77.69 min,此条件下杨梅出汁率理论值为85.36%。为操作方便,将上诉条件修正为复合酶添加量0.40%、酶解温度45℃、酶解时间60 min,此条件下进行3次平行试验,测得杨梅出汁率为(85.27±0.12)%,与理论值非常接近,说明该模型可用于生产中杨梅出汁率的分析预测。
2.3 酶解对杨梅汁理化指标及营养与功能成分的影响
果胶酶能够降解细胞间的果胶质,将杨梅细胞从植物组织中分离出来。纤维素酶可破坏植物细胞壁,从而提高杨梅汁得率,两种酶共同作用有利于提高杨梅汁出汁率、提升杨梅汁的营养品质[8,19]。
2.3.1 酶解对杨梅汁pH值、总酸、可溶性固形物、浊度的影响
酶解前后杨梅汁理化指标的变化见表4。
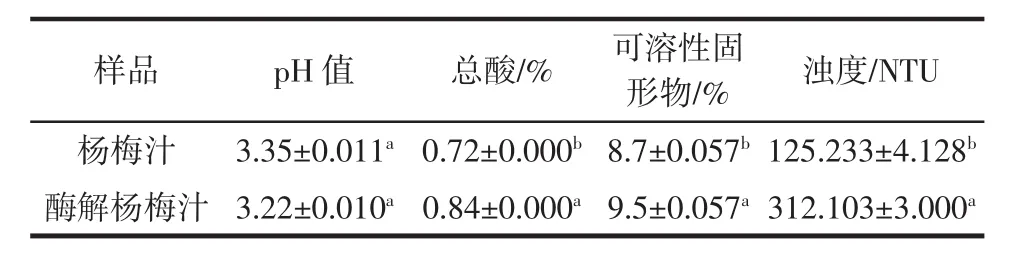
表4 酶解前后杨梅汁理化指标的变化Table 4 Changes of physical and chemical indexes of bayberry juice before and after enzymatic hydrolysis
由表4可知,复合酶酶解后的杨梅汁总酸、可溶性固形物、浊度指标均显著增加(P<0.05),可能是酶解后细胞破碎使有机酸、可溶性物质增加[22],从而使总酸、可溶性固形物分别增加16.67%、9.20%。此外,总酸的增加导致pH值降低3.88%。浊度上升149.22%,分析可能是多数酶为蛋白质,添加后会增加浊度指数。
2.3.2 酶解对杨梅汁营养指标的影响
酶解对杨梅汁营养指标的影响如表5所示。

表5 酶解对杨梅汁营养指标的影响Table 5 Effects of enzymatic hydrolysis on nutritional indexes of bayberry juice mg/mL
植物细胞溶出会导致有机酸、蛋白质和多糖等营养物质含量上升,由表5可知,总糖、总多酚、总黄酮、花色苷、蛋白质均显著增加(P<0.05),分别增加38.64%、58.21%、67.80%、221.29%、209.83%,分析可能是植物细胞破碎,蛋白酶的添加和部分多酚酸合成酶活性升高所致。由此可知,酶解制备所得杨梅汁可提高杨梅汁营养品质。
2.3.3 酶解对杨梅汁DPPH自由基清除率、羟基自由基清除率及FRAP的影响
酶解对杨梅汁抗氧化能力的影响见表6。
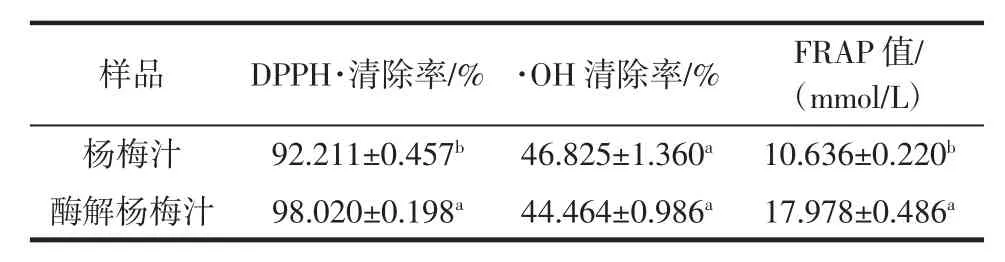
表6 酶解对杨梅汁抗氧化能力的影响Table 6 Effects of enzymatic hydrolysis on antioxidant capacity of bayberry juice
酚类、黄酮类化合物是体外抗氧化能力的主要作用成分,其含量变化对抗氧化活性影响很大[23]。由表6可知,酶解汁的DPPH·清除率、FRAP值显著增加(P<0.05),分别增加6.30%、69.03%,与多酚等物质含量上升有关。·OH清除率无显著变化(P>0.05)。因此,酶解汁抗氧化能力的升高可能与多酚、黄酮等功能活性物质含量的变化有关。
2.3.4 酶解对杨梅汁色泽的影响
酶解对杨梅汁色泽的影响见表7。
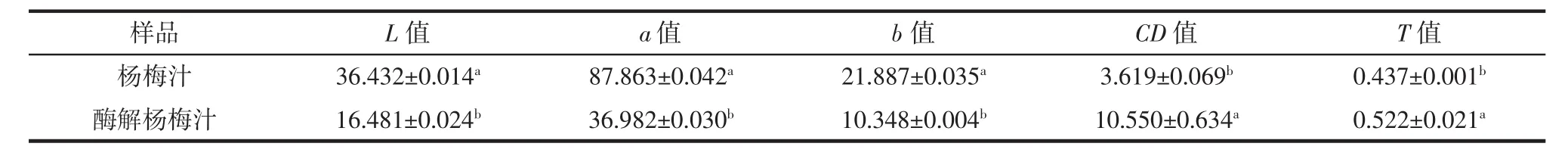
表7 杨梅汁与酶解杨梅汁的色泽指标Table 7 Color measurements of bayberry juice and enzymolysis juice
复合酶处理后,酶解杨梅汁颜色明显加深。由表7可知,L值、a值、b值显著下降(P<0.05),分别下降54.76%、57.91%、52.72%;CD 值、T值显著增加(P<0.05),分别增加191.52%、19.45%,花色苷是紫红色的自然色素,其含量的显著增加使酶解汁色泽指标发生显著变化,酶解杨梅汁亮度变低红色加深,外观与蓝莓汁、黑莓汁类似[18],更易被消费者接受;杨梅汁溶液的颜色是其对光的选择性吸收,CD值、T值显著上升也是颜色加深的重要表现。
3 结论
本研究以新鲜荸荠杨梅为原料,使用复合酶处理法提高杨梅出汁率,在单因素试验的基础上,通过响应面法优化酶解工艺,并分析杨梅汁在复合酶处理前后理化指标与挥发性成分的差异性,并对酶解汁总酚、总黄酮、花色苷与抗氧化能力进行相关性分析。结果表明:各变量对杨梅出汁率的影响大小顺序为复合酶添加量(X1)>酶解时间(X3)>酶解温度(X2);复合酶酶解最佳工艺为复合酶添加量0.40%、酶解温度45℃、酶解时间60 min,在此工艺条件下杨梅出汁率为85.27%;酶解杨梅汁的营养指标总糖、总酚、总黄酮、花色苷、蛋白质在复合酶处理后显著上升(P<0.05),分别增加了38.64%、58.21%、67.80%、221.29%、209.83%,DPPH·清除率、FRAP值分别显著增加6.30%、69.03%(P<0.05),·OH清除率无显著变化,色泽指标L值、a值、b值分别显著下降 54.76%、57.91%、52.72%(P<0.05),CD 值、T 值上升 191.52%、19.45%(P<0.05)。
复合酶处理制备杨梅汁,可综合提高杨梅汁的营养指标、抗氧化能力、色泽等,是杨梅深加工的重要手段,后续试验将对其沉淀、褐变以及感官评价方面加深研究。

