环境因素对大豆球蛋白-大豆皂苷复合乳液稳定性的影响
徐清莹, 于佳琨, 邢琳琳, 赵梦雅, 刘 军, 王胜男,刘 贺, 朱力杰,*
(1.渤海大学 食品科学与工程学院/生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心, 辽宁 锦州 121013;2.山东禹王生态食业有限公司, 山东 德州 251200)
由蛋白质等亲水胶体构成的乳液是食品工业中的重要体系之一,乳液的稳定性同乳化型食品的感官品质密切相关。在加工过程和货架期内,乳液对pH值、离子强度、温度等环境因素较为敏感,乳液液滴间的相互作用会导致液滴的团聚和絮凝,进而引起脂肪层上浮、蛋白质沉淀,这些失稳现象会严重影响乳液的口感及外观品质[1]。乳液稳定性同液滴、絮凝物的尺度以及油相黏度等因素有关[2],此外,环境因素及蛋白质的分子尺寸、分子柔性、表面疏水性等都会对乳液稳定性产生影响[3-4]。目前,探究不同环境因素对乳液稳定性的影响已成为食品工业中的一个重要研究方向。
在食品加工与贮藏过程出现的环境影响因素中,冷冻贮藏可以保持食品乳化剂的化学稳定性,延长其货架期,但冻融循环后,乳液可能会失去原来的理想状态。冻结过程中形成的冰晶能够减少脂滴之间的空间,促进界面层的破裂,并可能促进脂滴的结合[5];另一方面,对蛋白质等乳化剂进行酶改性可以显著提高冻融稳定性[6]。在加工过程中采取适当的热处理可以改变蛋白质的结构,影响蛋白质内部疏水基团的暴露,使其界面活性增强,理化和功能性质得到明显改善[7-8]。亦有研究表明,酸处理可以提升蛋白质的溶解性、乳化性和起泡性[9-10];此外,在蛋白体系中添加适量多糖后,可以调节pH值,使二者携带相反电荷,通过静电相互作用形成稳定性更好的复合乳液体系[11]。
作为一种低成本的蛋白质来源,大豆分离蛋白具有良好的营养和理化特性,在食品工业中被作为乳化剂广泛应用[12-14]。大豆球蛋白(glycinin,11S)是大豆分离蛋白中最为典型的组分之一,分析其结构与性质对深入研究大豆分离蛋白的加工适应性具有重要意义。大豆皂苷(soyasaponin,Ssa)具有两亲性的分子结构以及多种生物活性,良好的界面活性使其在研制复合乳化剂等领域具有应用前景[15-16]。已有研究表明,11S- Ssa体系可以形成较为稳定的乳液[14],但环境因素对该乳液体系的影响未见报道。本研究拟选取11S、Ssa为研究对象,利用11S- Ssa体系制备复合乳液,采用多重光散射技术对热及酸化处理乳液的整体稳定性进行测定,并对经过热、酸化及冻融处理后复合乳液的粒径分布、粒径大小以及絮凝率进行表征,研究环境因素对复合乳液稳定性的影响,以期为11S- Ssa复合体系应用于食品加工领域提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆皂苷购于西安通泽生物科技有限公司,低温脱脂豆粕购于山东禹王生态食业有限公司,长寿花玉米油购于当地超市,十二烷基硫酸钠(SDS)购自上海阿拉丁生化科技股份有限公司。实验所用化学药品均为分析纯,实验用水为去离子水。
1.2 仪器与设备
FJ200- SH型高速分散均质机,上海标本模型厂;HL- 2000型高压均质机,上海弗鲁克流体机械制造有限公司;BT- 9300ST型激光粒径分布仪,丹东市百特仪器有限公司;MS300型磁力搅拌器、PHS- 3CW型pH计,上海般特仪器制造有限公司;AR124CN型电子天平,奥豪斯仪器有限公司;Turbiscan多重光散射分析仪,法国Formulaction公司。
1.3 实验方法
1.3.111S球蛋白的制备
采用Xu等[17]的方法从低温脱脂豆粕中提取11S组分。用粉碎机将低温脱脂豆粕粉碎,然后与水按质量体积比(g∶mL)为1∶15的比例混合、搅匀后用2 mol/L的NaOH调节pH值至8.5。将溶液置于45 ℃水浴锅中低速搅拌1 h,用180目尼龙网过滤,收集滤液后常温下离心(6 900 r/min,30 min),弃去沉淀后在上清液中加入亚硫酸氢钠(0.98 g/L),混匀静置0.5 h后用2 mol/L HCl调节pH值至6.4。将上述溶液放入冰箱(4 ℃)过夜后4 ℃离心(5 900 r/min,20 min),在上清液中加入0.25 mol/L NaCl后用2 mol/L HCl调pH值至5.0,料液静置1 h后于4 ℃离心(6 900 r/min,30 min),得到的沉淀即为11S组分。用去离子水将11S组分洗涤两次后,再次加入10倍体积的去离子水并用2 mol/L NaOH 调pH值至7.5,充分搅拌至11S组分完全溶解,置于4 ℃冰箱内开始透析48 h以脱去盐分,冷冻干燥后于25 ℃环境下保存。
1.3.211S- Ssa复合体系的制备
将11S球蛋白和Ssa样品溶解于10 mmoL/L中性磷酸盐缓冲液中,搅拌2 h(室温)。为了保证11S的充分水化,将获得的蛋白分散液放置于冰箱(4 ℃)过夜。将11S和Ssa溶液调节pH值至7.0后进行不同质量分数梯度的11S- Ssa混合溶液的制备,其中Ssa的质量分数为0~0.5%,11S最终质量分数固定为0.5%。混合溶液继续搅拌30 min(室温)以确保11S和Ssa间的相互作用充分发生。
1.3.311S- Ssa复合乳液的制备
将玉米油与11S- Ssa复合溶液按照一定比例混合搅拌20 min(室温),其中连续相(水相)为10 mmoL/L磷酸盐缓冲液(pH值7.0),分散相(油相)的质量分数为10%,11S的质量分数固定为0.5%,Ssa的质量分数为0~0.5%。将混合好的溶液经高速剪切机(8 000 r/min,2 min)处理,初步乳化后得到初级乳液,再经过两次高压均质处理(50 MPa)得到最终乳液。
1.3.411S- Ssa复合乳液的热处理
取20 mL新鲜制备的11S- Ssa复合乳液置于乳液瓶中,密封好进行热处理。采用水浴方式于90 ℃热处理20 min,采用高温蒸汽灭菌方式于120 ℃热处理20 min。经过热处理后的样品迅速进行冰浴,待其冷却后立刻测定指标。
1.3.511S- Ssa复合乳液的酸化处理
取10 mL新鲜制备的11S- Ssa复合乳液,用2 mol/L HCl调节pH值至7.0、4.5、3.0、2.0后立刻测定指标。
1.3.611S- Ssa复合乳液的冻融处理
取10 mL新鲜制备的11S- Ssa复合乳液置于具塞试管中,在-20 ℃冷冻储存22 h后,30 ℃解冻2 h。取部分样品进行测定,其余样品重新冷冻,反复进行3次。
1.3.7处理后复合乳液的粒径测定
采用激光粒度分布仪对乳液油滴的粒径大小及分布进行测定。参数设定为:颗粒折射率、吸收率分别为1.467和0.002;波长为633 nm;分散剂为水,折射率为1.330;测试温度为25 ℃。乳液的絮凝率(FD)计算方法见式(1)[18]。
FD=(d43-d43SDS)/d43SDS×100% 。
(1)
式(1)中,d43为体积平均粒径,μm;d43SDS为加入SDS所测得的d43,μm。
1.3.8乳液稳定性的测定
采用多重光散射分析仪对纯11S乳液及11S- Ssa复合乳液在非破坏且无接触情况下的整体稳定性进行分析。基于多重光散射原理对乳液样品进行静置垂直扫描,进而提供样品稳定程度信息。准确吸取经过热处理、酸化处理的乳液样品20 mL,放入多重光散射专用玻璃测试瓶中开始进行扫描(每隔1 h进行一次,持续24 h),测定乳液的稳定性。利用Turbiscan软件对所得数据进行分析、计算出样品的稳定性动力学指数(turbiscan stability index,TSI)。
2 结果与分析
2.1 11S- Ssa复合乳液的热稳定性分析
2.1.1热处理对11S- Ssa复合乳液粒径分布的影响
为了评价热处理对11S- Ssa复合体系乳化性的影响,研究了热处理后11S- Ssa复合乳液稳定性的变化,实验结果见图1。图1中实物为乳液外观图像,可以看到,乳液经热处理后外观未发生明显变化。乳液的粒径分布与乳液稳定性密切相关,单峰且均一的粒径分布往往表示较为稳定的乳液状态。图1显示,90 ℃热处理复合乳液的粒径分布出现了明显的多峰现象,推测可能由于是乳液经热处理后,吸附于界面上的蛋白质和体相溶液中未吸附的蛋白质发生聚集,导致乳液液滴粒径增大;当处理温度增加到120 ℃时,添加质量分数为0.05%~0.50%的Ssa,复合乳液粒径分布变为均一稳定的状态,这可能是经过120 ℃热处理后的Ssa与吸附在界面上的蛋白发生相互作用,使蛋白分子展开在界面上发生构象重排,导致乳液粒径变小。
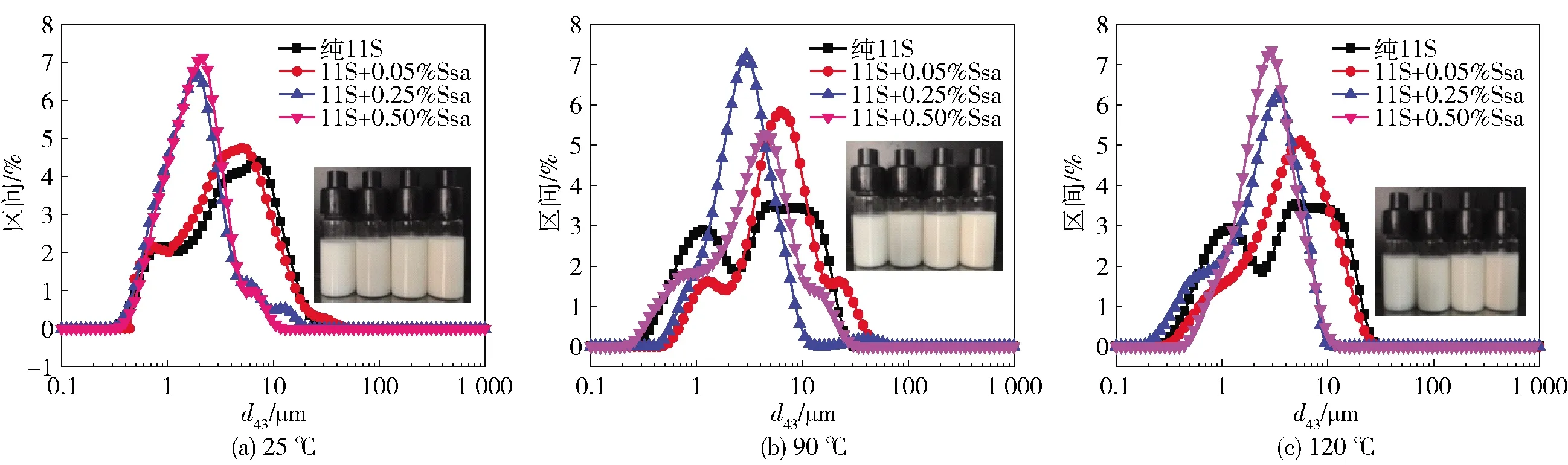
图中实物图为热处理后乳液的外观(从左至右Ssa质量分数依次增大)。图1 热处理对11S- Ssa复合乳液粒径分布的影响Fig.1 Effect of heat treatment on particle size distributions of emulsions stabilized 11S- Ssa mixture
2.1.2热处理对11S- Ssa复合乳液粒径大小及絮凝率的影响

不同大小写字母表示组间差异显著(P<0.05)。图2 热处理对11S- Ssa复合乳液粒径大小和絮凝率的影响Fig.2 Effect of heat treatment on particle size and flocculation rate of emulsions stabilized by 11S- Ssa mixture
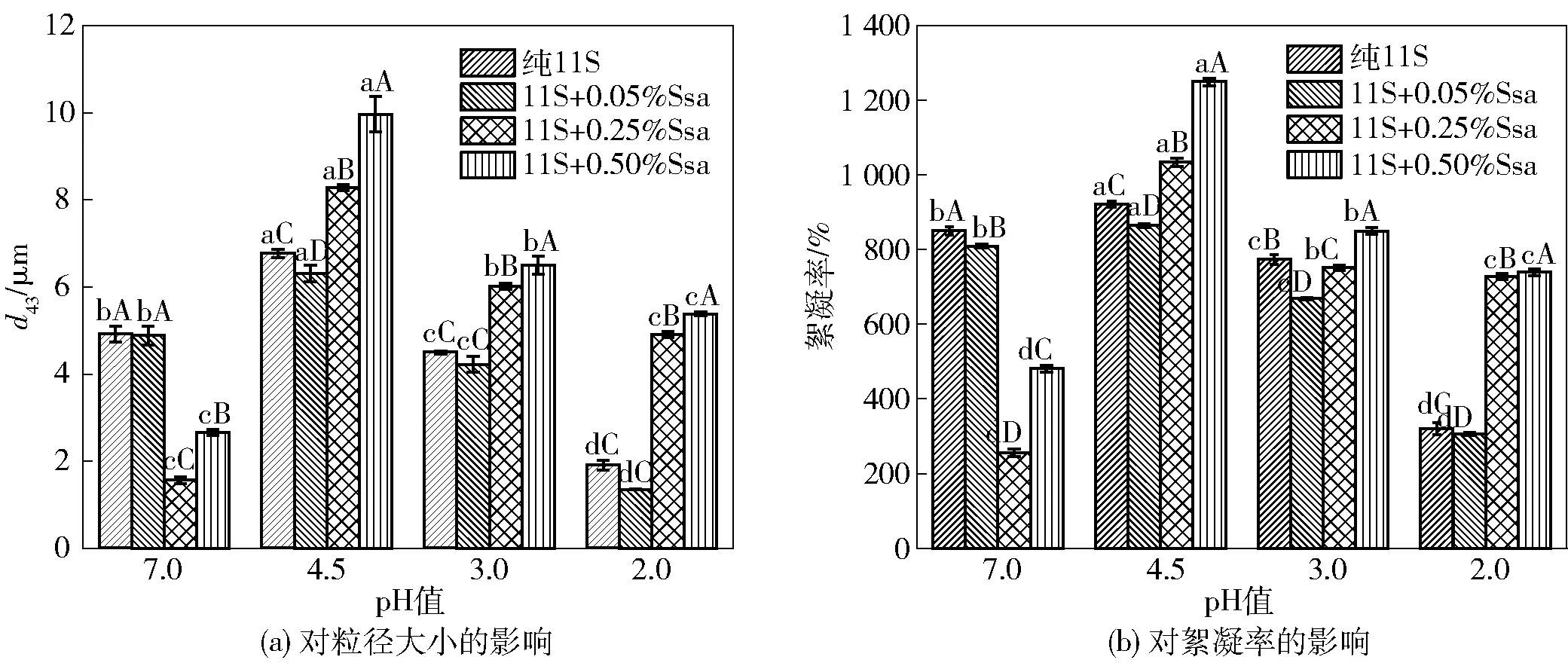
图2为热处理前后复合乳液的粒径大小及絮凝率随Ssa的质量分数变化情况。通常情况下,乳液的粒径大小及絮凝率同稳定性呈反比。图2(a)结果显示,25℃时复合乳液粒径随着Ssa质量分数的增加明显减小,与粒径分布结果一致;图2(b)显示,絮凝率变化趋势与粒径变化相似。复合乳液经过90 ℃热处理后,絮凝率显著上升;当温度升高至120 ℃时,添加一定质量分数(0.05%~0.50%)的Ssa后,乳液粒径和絮凝率又出现了显著降低(P<0.05)。
2.1.3热处理对11S- Ssa复合乳液TSI值的影响

图3 热处理对11S- Ssa复合乳液TSI值的影响Fig.3 Effect of heat treatment on TSI of emulsions stabilized by 11S- Ssa mixture
图3为11S- Ssa复合乳液TSI值的变化情况。TSI值越小,乳液越稳定。由图3可见,经热处理后,纯11S乳液的TSI值降低,表明热处理会影响该乳液的稳定性;添加质量分数为0.05%的Ssa时,热处理后的乳液TSI值变化情况与纯11S蛋白乳液相近;添加质量分数为0.25%~0.50%的Ssa时的复合乳液,热处理后TSI值较纯11S蛋白乳液有所下降,表明乳液具有良好的热稳定性。90 ℃热处理性后,3组添加了Ssa的乳液在24 h时TSI值较为接近,均小于纯11S蛋白乳液;120 ℃热处理后,添加0.50% Ssa的乳液TSI值最小。本研究表明,添加了Ssa的乳液普遍在24 h时具有更小的TSI值,稳定性更好。
2.2 11S- Ssa复合乳液的酸稳定性分析
2.2.1酸处理对11S- Ssa复合乳液粒径分布的影响
对11S- Ssa复合乳液进行酸化处理后的乳液粒径分布情况如图4。由图4中乳液直观照片可以看出,乳液对pH值的变化较为敏感。pH值为7.0时,复合乳液都表现了均一、稳定的形态;在pH值 4.5时靠近了11S等电点,复合乳液的粒径分布均出现多峰现象及明显的相分离,这可以归因于蛋白质在等电点附近溶解度降低、乳化性变差。进一步降低pH值至2.0后,添加质量分数为0.05% 的Ssa,复合乳液粒径分布呈现单峰稳定的状态。这可能是因为酸化处理后11S表面巯基含量及表面疏水性显著增加,导致更多疏水基团和亲水基团暴露出来,蛋白质的三级结构部分展开,乳化性增强。

图中实物图为酸化处理后乳液外观照片(从左至右Ssa质量分数依次增大)。图4 酸化对11S- Ssa复合乳液粒径分布的影响Fig.4 Effect of acidification on particle size distributions of emulsions stabilized 11S- Ssa mixture
2.2.2酸处理对11S- Ssa复合乳液粒径大小及絮凝率的影响
图5显示了酸化处理对11S- Ssa复合乳液粒径大小和絮凝率的影响情况。由图5(a)和图5(b)可以看到,乳液的粒径以及絮凝率均随着pH值的降低先增大后减小,在11S等电点(pH值为4.6)附近最大。由图可清晰看到,添加质量分数为0.05% 的Ssa导致了复合乳液粒径和絮凝率的减小,这与复合乳液粒径分布结果一致(图4)。
2.2.3酸处理对11S- Ssa复合乳液TSI值的影响
图6反映了酸处理对11S- Ssa复合乳液TSI值的影响。图6显示,在中性条件下,质量分数为0.50%的Ssa可以提高11S- Ssa复合乳液的稳定性。随着pH值的降低,添加质量分数为0.05%的Ssa时的复合乳液稳定性有所提高。进一步降低pH值至2.0后复合乳液稳定性好转,各组乳液24 h时的TSI值降至8.5以内。结合粒径及絮凝率结果发现,加入0.05%的Ssa可以增强复合乳液的酸耐受性。
不同大小写字母表示不同组间差异显著(P<0.05)。图5 酸化对11S- Ssa复合乳液粒径大小和絮凝率的影响Fig.5 Effect of acidification on particle size and flocculation rate of emulsions stabilized by 11S- Ssa mixture
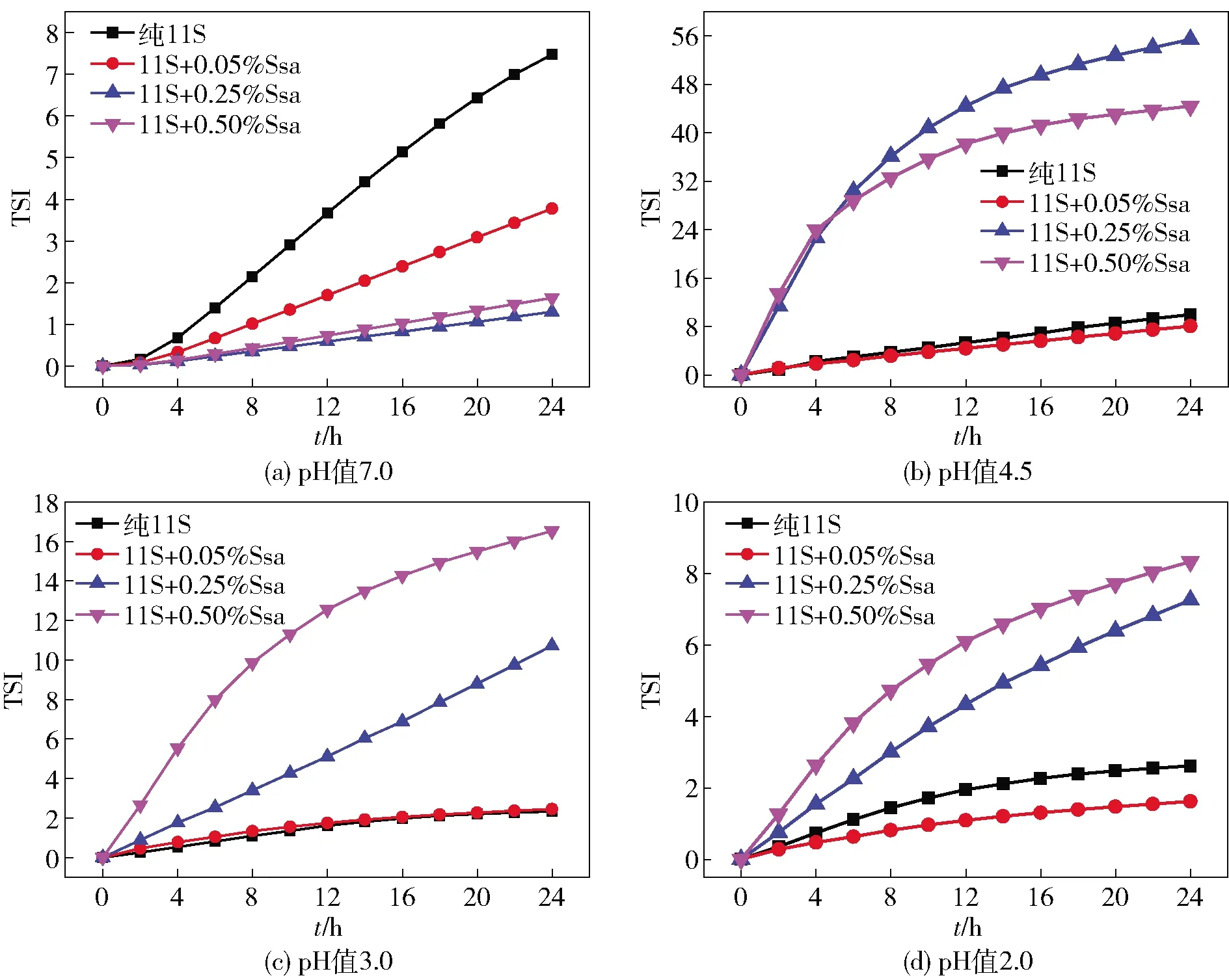
图6 酸处理对11S- Ssa复合乳液TSI值的影响Fig.6 Effect of acidification on TSI of emulsions stabilized by 11S- Ssa mixture
2.3 11S- Ssa复合乳液的冻融稳定性分析
2.3.1冻融处理对11S- Ssa复合乳液粒径分布的影响
11S- Ssa复合乳液经冻融处理后的粒径分布情况如图7。由图7中乳液直观照片可以看出,经过一次冻融循环后,乳液出现了明显的乳析现象,再次循环后,试管上方出现油滴,发生了破乳现象,说明各组乳液的抗冻融能力均较差。纯11S乳液的粒径分布较添加了不同质量分数Ssa的复合乳液更为均一。
2.3.2冻融处理对11S- Ssa复合乳液粒径大小及絮凝率的影响
冻融处理对11S- Ssa复合乳液粒径大小和絮凝率的影响情况如图8。图8显示,未冻融处理前,纯11S蛋白乳液和11S- Ssa复合乳液粒径都小于10 μm;经过冻融处理后,11S- Ssa复合乳液粒径增至200 μm以上。随着冻融次数的增加,纯11S乳液粒径不断增大。3次循环后,11S- Ssa复合乳液的粒径[图8(a)]和絮凝率[图8(b)]都随着Ssa质量分数的增加而减小,添加0.50%的Ssa能够降低冻融后复合乳液的絮凝率,但各组乳液在冻融处理后的稳定性均较差。

图中实物图为冻融处理后乳液外观照片(从左至右Ssa质量分数依次增大)。图7 冻融对11S- Ssa复合乳液粒径分布的影响Fig.7 Effect of freeze-thaw on particle size distributions of emulsions stabilized 11S- Ssa mixture

不同大小写字母表示组间差异显著(P<0.05)。图8 冻融对11S- Ssa复合乳液粒径大小和絮凝率的影响Fig.8 Effect of freeze-thaw on particle size and flocculation rate of emulsions stabilized by 11S- Ssa mixture
3 结 论
本研究表明,热处理对纯11S乳液的稳定性影响较大。11S- Ssa复合乳液经热处理后稳定性虽有所降低,但添加Ssa的复合乳液稳定性仍优于纯11S乳液。11S在等电点附近发生的絮凝现象对11S- Ssa复合乳液的酸耐受性有较大影响。pH值为4.5时的复合乳液稳定性较差,出现了较为严重的分层现象,但一旦跨过等电点,进一步降低pH值后,乳液的稳定性有所改善,Ssa在一定程度上可以提高复合乳液的酸耐受性。冻融处理严重影响了乳液的稳定性,纯11S乳液经3次冻融循环后,粒径和絮凝率均逐渐增大;添加Ssa能降低复合乳液的粒径和絮凝率,但如何提高11S- Ssa复合乳液的冻融稳定性仍需进一步研究。总体而言,添加0.05%~0.50%的Ssa能够提高复合乳液在热和酸化处理下的稳定性,但没有明显改善冻融处理后乳液的失稳现象。

