不同力竭运动对大鼠纹状体背外侧神经元电活动的影响及调节机制研究
崔书强 刘晓莉 乔德才
1 北京市体育科学研究所(北京100075)
2 北京师范大学体育与运动学院(北京100875)
运动疲劳是人们从事竞技运动训练或体育锻炼时经常出现的一种生理功能暂时下降的现象,与中枢的调节密切相关[1,2],但其调节机制尚不十分清楚。纹状体是基底神经节的重要核团,其背外侧主要接受来自初级运动皮层(M1)的输入,与躯体感觉运动的调节功能有关[3,4]。有研究发现,运动训练可引起纹状体背外侧谷氨酸能传递和中等多棘神经元(medium spiny neuron ,MSN)兴奋性突触的长时程增强[5]。纹状体绝大多数为MSN[6],纹状体MSN 的放电与运动速度密切相关[7],其放电受到GABA能快放电中间神经元的强有力的调节[8-10],这类中间神经元是表达钙结合蛋白的小清蛋白神经元(PV),其参与了行为任务学习中MSN电活动的调节[11,12]。本实验室前期研究发现,大鼠运动疲劳后初级运动皮层、纹状体的局部场电位的α及β振荡的同步性增强[13,14],纹状体神经元自发放电频率升高[15],但其升高的原因除与黑质多巴胺能神经元投射有关外[16],对来自初级运动皮层的调节并不清楚,推测这可能与PV神经元的功能活动有关。为此,本研究采用在体多通道阵列微电极结合同步记录技术,分析大鼠一次力竭运动和重复性力竭运动过程中神经元电活动的变化,结合免疫荧光的方法,进一步探讨纹状体背外侧在运动疲劳中枢调节中的作用及可能机制。
1 材料与方法
1.1 研究对象与分组
实验采用健康雄性Wista 大鼠,8 周龄,体重250~300 g,由北京维通利华实验动物有限公司提供,许可证号:SCXK(京)2012-0001。大鼠购进后分笼饲养,自由饮食,自然光照,室温24℃± 1℃,相对湿度50% ±5%。随机分为安静对照组(CG 组)、一次力竭运动组(EG组)和重复力竭运动组(REG组),每组24只。各组分别进行电生理实验6只和免疫荧光染色实验18只。
1.2 实验方案
实验前先让EG 组和REG 组大鼠进行3 天适应性跑台训练,跑台速度:第1 天为8 m/min,第2 天为12 m/min,第3 天为15 m/min,每天训练10 min。之后各组做电生理实验的大鼠进行电极植入手术,恢复1 周后各组大鼠正式开始实验,实验方案如图1 所示。CG组不进行运动,EG 组进行一次力竭跑台运动,REG 组进行连续7天的力竭跑台运动。跑台运动方案采用本实验室依据Bedford 渐增负荷改进的运动方案[17],共分三级负荷:Ⅰ级跑速为8.2 m/min、运动15 min;Ⅱ级为15 m/min、运动15 min;Ⅲ级为20 m/min,直至力竭,记录大鼠运动的时间和距离。力竭标准以大鼠不能跟上跑速,滞留跑道后1/3达3次以上,刺激驱赶无效,刺激后无反应,判断为力竭[17]。电生理实验记录安静状态、一次力竭运动后和7 天重复运动后(REG)的电信号。免疫荧光实验组中CG组不进行运动,在大鼠购进饲养7 天后取材,EG 组在一次力竭跑台运动后即刻,REG组进行连续7天的力竭运动后即刻进行取材。
1.3 在体多通道电信号记录
1.3.1 电极植入手术
各组做电生理实验的大鼠使用6%水合氯醛腹腔注射麻醉(350 mg/kg),剃除头顶毛发并用酒精碘伏消毒,然后将其固定于脑立体定位仪(RWD,深圳)上。根据大鼠脑立体定位图谱[18]选取纹状体背外侧部(前囟前0.5~1.4 mm,旁开2.5~3.5 mm)的矩形区域为开颅区,在显微镜下(WPI,USA)剥离硬脑膜,将16 通道阵列电极(Glo-Bio,USA,电极直径35 μm、间距200 μm)采用电动微推器(Kofe,USA)在显微镜观察下缓慢植入脑组织(图1 左),同时打开Central 软件观察神经元的放电情况,当看到有较大幅值的神经元放电且有3 个以上通道出现较稳定的放电时,停止推进电极(深度约为3.5 mm~4 mm)。用生物硅胶封住暴露的大脑皮层,待生物硅胶固定后(3~5 min),用牙科水泥固定电极,在脑部皮肤表面用碘伏消毒。为防止术后感染,每日腹腔注射一次青霉素,连续3 d,恢复一周后进行电生理实验。
图1 实验流程图
电生理实验结束后,用4%多聚甲醛灌流固定,取出脑后放入30%蔗糖溶液,4℃保存,待脑沉底后进行冰冻切片,用尼氏染色并对照图谱确认记录电极位置(图2右)。

图2 电极植入位置及尼氏染色定位图
1.3.2 电信号的采集与分析
在大鼠安静状态、一次力竭运动和7 天重复力竭运动后即刻,使用Cerebus-128多通道信号系统(Blackrock Microsystems,USA)采集30 min 的电信号。采样频率为1000 Hz,采用lowpass 250 Hz滤波获得局部场电位。利用Neuromotive 系统(Cyberkinetics,USA)同步追踪记录大鼠的行为活动。
通过Offline Sorter(Plexon)软件采用主成分分析(principal component analysis,PCA)方法提取Spike 的波形特征,根据神经元放电集群和神经元放电波形选定每类神经元集群中心对神经元放电进行分类,分类标准是:①所记录的电生理数据信噪比>3.0;②峰峰间隔<1 ms 的Spike 不得多于0.1%。分类后的电生理数据导入Neuronexploer5.0 对神经元放电频率以及神经元锋电位(Spike)个数进行分析,最后将数据导入到excel进行分析。采用Neuroexplorer 5分析软件去除50 Hz的工频干扰(见图3),然后分析局部场电(LFP)、功率谱密度(power spectral density)和γ频段(30~80 Hz)。

图3 对记录到的LFP去除50 Hz工频干扰
1.4 PV神经元及NMDAR2B阳性神经元表达的免疫荧光染色实验
各组大鼠分别在安静状态、一次力竭运动后和7天力竭运动后即刻进行10%水合氯醛腹腔注射麻醉,经心脏快速灌注生理盐水,然后灌注4%多聚甲醛(PFA)至四肢僵直,再剥离取出全脑,放入4%PFA 的30%的蔗糖溶液固定,4℃保存。待脑组织沉底后,参考大鼠脑立体定位图谱[19]选取纹状体部位,进行连续冠状冰冻切片,厚度40 μm,每6 片选取1 张进行组织免疫荧光双重染色。
免疫荧光双重染色:切片置于0.1 M 的PB 中洗1次,3%羊血清室温封闭30 min;加一抗PV(来源小鼠的单克隆抗体,Abcam,货号:ab64555)稀释浓度为1∶1000,一抗NMDAR2B(来源于兔的多克隆抗体,Abcam,货号:Ab65783 )稀释浓度为1∶500,两种一抗一块加入并4℃孵育24 h,0.1 M 的PB 洗3 次,每次5 min,二抗采用Alexa Fluor®594 标记的羊抗小鼠IgG(Invitrogen,货号A-11005)和Alexa Fluor®488 标记的羊抗兔IgG(Invitrogen 货号:A-11034),二抗稀释浓度为1∶500,二抗同时加入室温孵育2 h(避光),0.1 M 的PB 洗3 次,将切片在0.02 M 的PB 中贴于载玻片上,中性甘油封片,Olympus 荧光显微镜(DP-73,日本)对大鼠纹状体背外侧部位进行图像的拍摄,每组大鼠的相同层面中选取6 张脑片进行统计,记录20 倍镜下每张片子的阳性细胞的个数。
1.5 统计分析
所有数据以平均数±标准差表示,对各组大鼠的运动时间、运动距离、神经元放电频率与放电个数、功率谱密度值以及阳性神经元个数等指标,采用单因素方差分析进行差异显著性检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 大鼠的运动距离和运动时间
一次力竭运动组和重复力竭运动组大鼠的平均运动距离和平均运动时间见图4。通过图4 可以看出重复力竭运动组随着训练时间的延长,大鼠平均运动距离和运动时间均呈现出增加趋势,但与一次力竭运动组相比不具有显著性差异(P>0.05)。
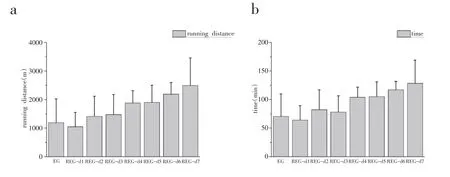
图4 大鼠运动时间和运动距离
2.2 大鼠纹状体背外侧MSN 和PV 神经元放电频率的特征变化
记录了不同状态下大鼠纹状体背外侧神经元的放电,通过Offline Sorter 软件采用K-means 方法对神经元放电进行3D集群分类,并进一步根据神经元放电波形的半波宽度和放电频率对神经元进行分类:神经元放电频率>5 Hz,半波宽度<0.2 ms的神经元为PV神经元;神经元放电频率<10 Hz,0.2 ms<半波宽度<0.6 ms的神经元为MSN神经元[20]。在纹状体背外侧部我们共记录到369个神经元放电,其中249个神经元的放电波幅较宽,放电频率较低,这种放电模式是典型的MSN神经元;其中有81个神经元,放电波幅较窄,放电频率明显很高,这种放电模式的神经元为PV 神经元;剩余27个神经元为放电波幅大、频率低的胆碱能神经元。MSN 和PV 神经元锋电位波形图及峰峰间隔直方图见图5。对MSN 和PV 神经元放电频率统计分析发现,MSN神经元放电频率在7天重复力竭运动后与安静状态下相比出现了显著性升高(P<0.01),见图6A;PV 神经元放电频率在重复力竭运动后有所升高,但与各组相比不具有统计学差异(P>0.05),见图6B。
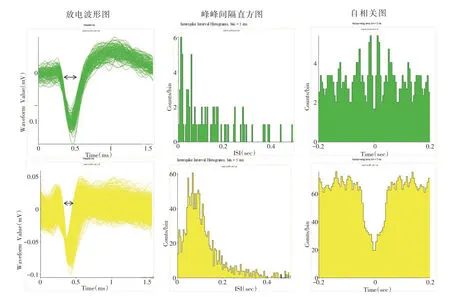
图5 MSN、PV神经元放电波形及锋电位间隔直方图及自相关图
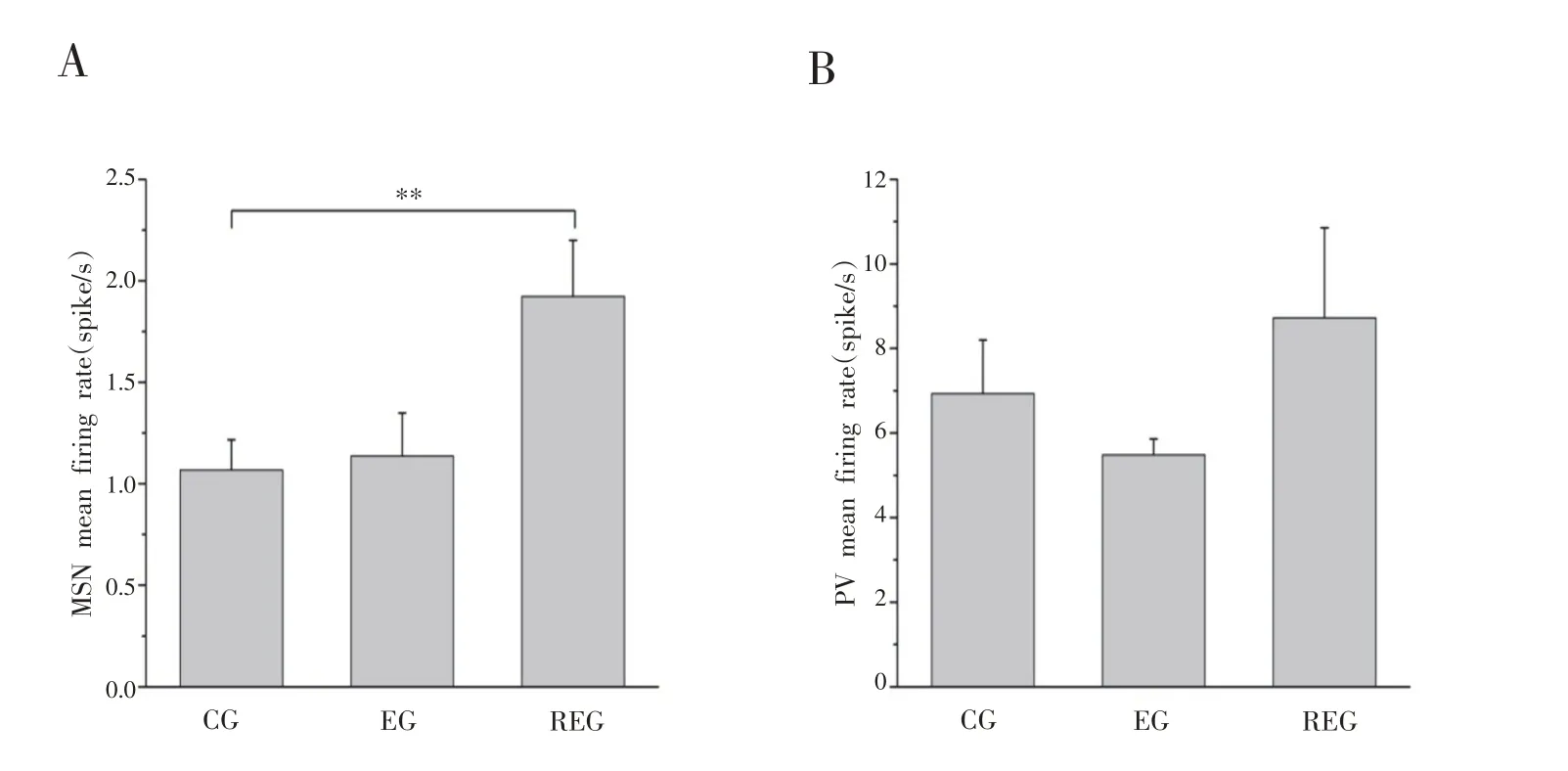
图6 MSN和PV神经元放电频率图(n=6)
2.3 大鼠纹状体背外侧局部场电位的变化
大鼠在不同状态下的功率频谱和功率谱密度见图7,由大鼠纹状体背外侧功率频谱图可以看出重复力竭运动后较一次力竭运动后各频段的能量值有所增强。
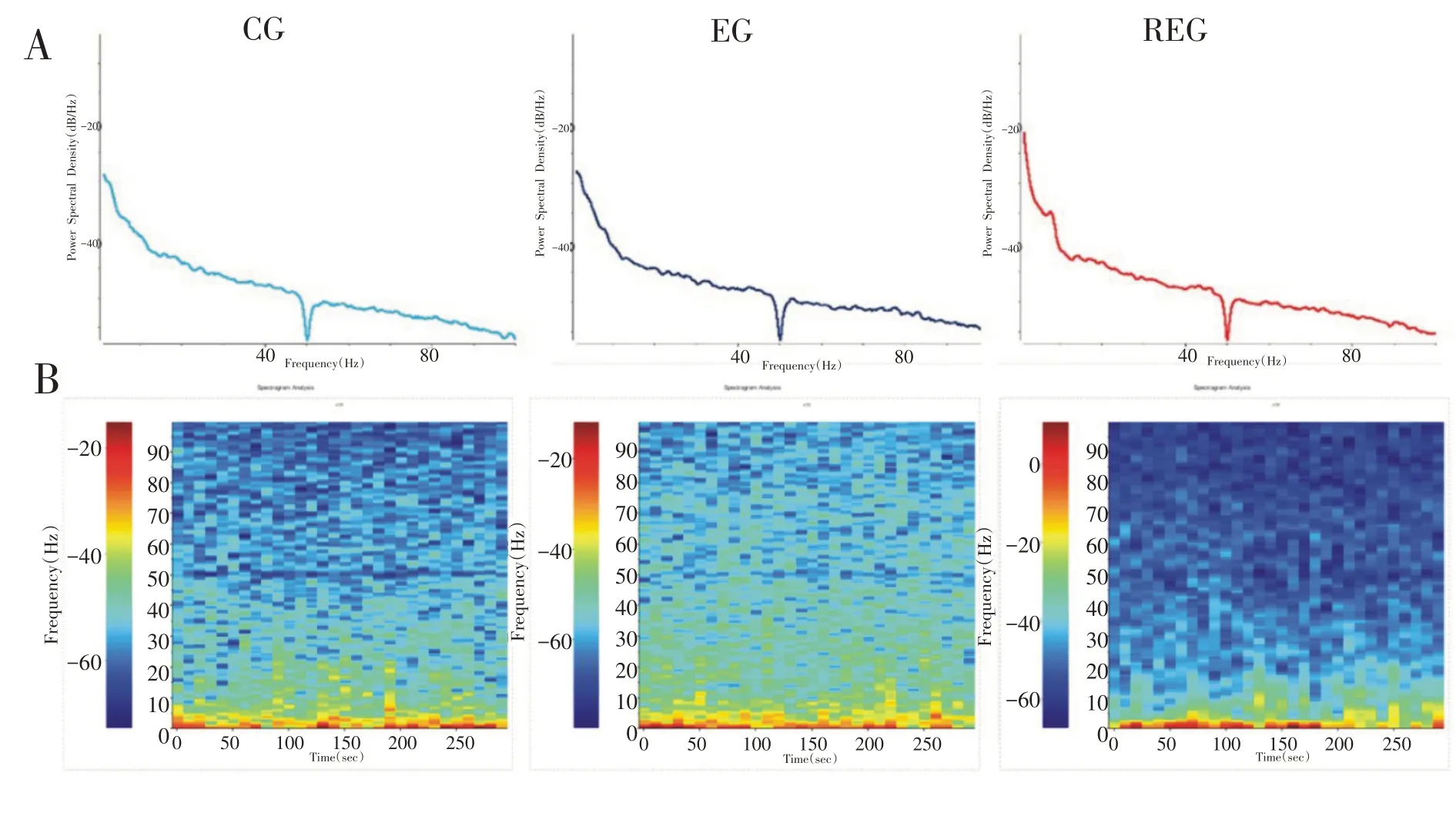
图7 三组大鼠纹状体功率谱密度和功率频谱图
大鼠安静状态下、一次和7 天重复力竭运动后纹状体背外侧LFP 的功率谱密度对比见图8A,通过对比可以看出7天重复力竭运动后30~80 Hz的γ频段的功率谱密度有所升高。进一步对γ频段的功率谱密度进行分析发现一次和重复力竭运动后与安静状态下相比均出现了明显升高(P<0.01),7天重复力竭运动后升高更加明显且与一次力竭运动后相比也明显升高(P<0.05),见图8B。
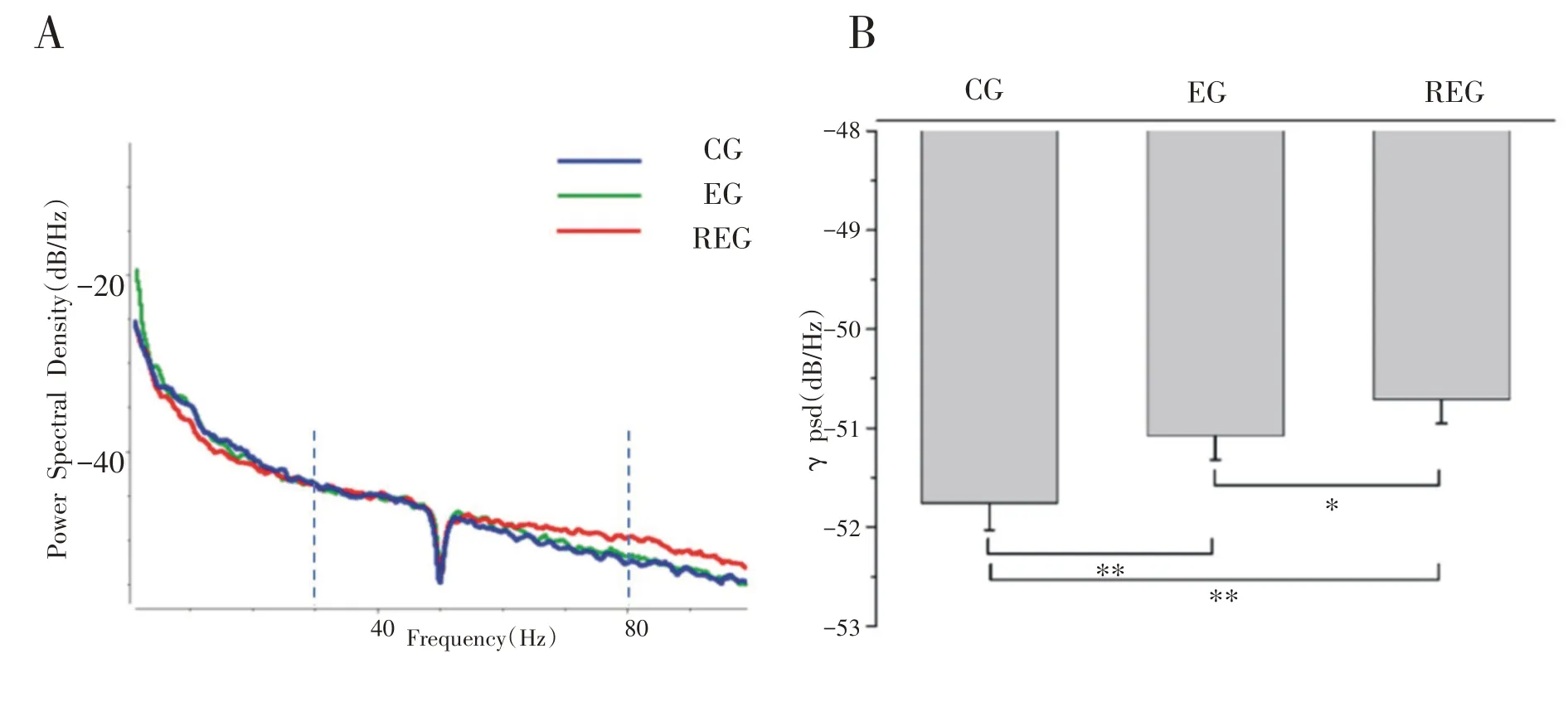
图8 纹状体背外侧LFP的功率谱密度
2.4 力竭运动前后大鼠纹状体背外侧PV 阳性神经元及NMDAR2B阳性神经元的表达
通过图9a可以看出REG组纹状体背外侧PV阳性神经元表达最明显,EG组次之,CG组表达最弱。通过对各组PV 阳性神经元个数分析发现,EG 组较CG 组PV阳性神经元个数有显著性增加(P<0.05),REG 组较CG组PV阳性神经元个数增加更加显著(P<0.01)。EG组和REG组NMDAR2B阳性神经元在纹状体背外侧均有较明显的表达,但EG组和REG组NMDAR2B阳性神经元个数与CG 组相比无显著性差异(P>0.05)。在REG 组PV 阳性神经元与NMDAR2B 阳性神经元共表达明显,REG组共表达神经元个数与CG组相比具有显著性差异(P<0.01)。

图9 纹状体背外侧PV和NMDAR2B阳性神经元的表达(n=8)
3 讨论
3.1 一次力竭和7 天重复力竭对纹状体背外侧神经元电活动的影响
本研究结果显示,一次力竭运动后纹状体背外侧MSN 放电频率并未出现显著性改变,在7 天重复力竭运动后纹状体背外侧MSN的放电频率均出现了显著升高,PV 神经元的放电频率在7 天重复力竭运动后也出现了升高。Yin 等发现大鼠在进行转棒训练的初期大鼠的背内侧纹状体有短暂的激活,而纹状体背外侧没有显著性改变[5],提示一次急性运动未能明显激活纹状体背外侧。Costa 等发现大鼠在进行转棒训练过程中和经过过度训练后,大鼠纹状体神经元放电的数量和频率也都出现了增加[21]。本研究中大鼠经过了7 天的力竭性跑台训练,与转棒训练所引起的神经元放电的改变相一致,这提示7 天重复力竭运动与过度训练所引起的神经元的激活可能存在共同的神经调节机制。
经过7天重复力竭运动后纹状体背外侧MSN神经元放电频率出现了显著性增加,Kim 等也发现在小鼠糖水奖赏实验中纹状体MSN 和PV 神经元的放电频率与头的运动速度呈正相关关系[6],7 天重复力竭运动运动时间和距离的增加与纹状体背外侧MSN电活动的改变有密切相关。研究发现任务训练可引起与任务相关的神经元放电的增加以及非任务相关的神经元放电得到抑制,这种神经元放电模式的变化与行为表现高度相关[19]。长期运动训练及应激可引起纹状体背外侧的激活,在行为决策和表现中更倾向于习惯化[3]。由此我们推测长期训练引起的疲劳与纹状体背外侧电活动的改变有关。
纹状体PV神经元虽然相对较少,但对MSN神经元的兴奋性输出起重要的调控作用,对神经网络的可塑性,抑制非任务相关的神经元放电起重要作用。纹状体背外侧PV 神经元主要是来自初级运动皮层和躯体感觉皮层的GABA 能投射[22],纹状体PV 神经元可以将皮层的感觉运动信息通过前馈抑制对MSN神经元进行调节[23]。Lee等发现PV神经元影响了大鼠最初的条件性奖赏反应的表现,PV神经元对MSN活性的调节较为敏感,而随着训练的增加这种调节作用出现了降低[11]。由此来看,一次急性力竭运动导致的疲劳,来自皮层对纹状体背外侧的抑制性调节更加敏感,而7 天重复力竭后皮层向纹状体的这种抑制性投射有所增强。本研究中发现在一次力竭运动后PV 神经元放电有所降低,可能与MSN对PV神经元的抑制作用较为敏感有关,而在7天重复力竭运动后PV 神经元放电频率出现了一定升高,重复力竭运动后PV神经元对MSN的抑制作用增强,提示重复力竭运动后皮层的抑制性信息传入增强。局部场电位(LFP),更能反映神经元集群的放电效应,对纹状体背外侧LFP 分析发现一次力竭运动后和7 天重复力竭运动后γ频段功率谱密度均出现了显著性升高。Thron 等对纹状体背外侧的神经元放电频率和局部场电进行了同步记录,结果发现PV神经元呈现出任务相关和训练相关电变化与对应的MSN的相一致[20]。这与本研究中7 天重复力竭运动引起了MSN放电频率的升高以及局部场电位γ频段功率谱密度升高相一致。MSN放电频率的增高一方面可能是来自皮层的谷氨酸能兴奋性传入增强,引起MSN兴奋性升高,导致MSN的放电频率增强,另外MSN也接受来自黑质多巴胺的投射,在力竭后DLS区多巴胺D2受体的减少[14],引起直接通路和间接通路调节失衡从而可能导致了MSN 的过渡激活。MSN 的突触在PV 神经元上尚未发现,但PV神经元与MSN形成了广泛的突触联系。PV神经元在力竭后产生的γ波的增强,这种增强更多表现出皮层与纹状体联系的增强,同时MSN 也出现了放电的增加。MSN也接受来自PV的抑制性输入,在重复力竭后这种抑制增强,但与皮层的兴奋性输入增强相比,皮层的兴奋性输入对MSN起更大作用(见图10)。

图10 PV神经元对MSN调节模式图
3.2 一次力竭和7 天重复力竭对DLS 区PV 神经元及NMDAR2B表达的影响
NMDA受体的变化可以直接影响神经元电活动的变化。NR2B 亚型是NMDA 受体重要的功能亚型。谷氨酸激活NMDA受体的NR2B亚型,可引起Ca2+的内流和K+外流,持续的突触传递活动可以通过激活NMDA受体,进而通过Ca2+的信使途径使得AMPA 受体磷酸化,导致AMPA受体通透性增加,甚至使突触后胞浆内的AMPA 受体转运到突触后膜上,从而导致突触后膜对谷氨酸的敏感性增加,引起突触可塑性改变。PV神经元为与钙结合的神经元,它的激活与钙离子的变化也有关。NMDAR2B 的激活可引起对钙离子的通透增加[24],并且NMDA 受体对PV 神经元的γ振荡起重要作用[25]。本研究中一次力竭运动后纹状体背外侧NMDAR2B 在一次力竭运动后有明显表达,提示来自皮层的谷氨酸的兴奋性投射更加敏感,重复力竭运动后NMDAR2B表达明显,提示运动疲劳后纹状体背外侧对来自皮层的谷氨酸的兴奋性投射更加敏感,更容易受到兴奋性毒作用和氧化应激的损害[26]。研究发现纹状体NMDAR2B参与了灵活性行为的调节[27],前期研究也发现,大鼠前额叶皮层NMDAR2B 的表达与大鼠的运动距离呈负相关关系[28]。重复力竭运动后PV 阳性神经元在纹状体背外侧有较为明显的表达,这也进一步证实,重复力竭运动后纹状体背外侧PV阳性神经元调节作用增强。而对局部场电位分析发现,一次和重复力竭运动后γ频段均出现了增加,这与PV 神经元在纹状体背外侧的表达相一致,脑内高强度的γ波参与了兴奋性和抑制性神经元之间相互反馈。PV 神经元活性的调节受到来自谷氨酸能兴奋性的调节,并且研究发现阻断NMDA 受体可明显的破坏γ波振荡的产生,NMDA 受体对PV 神经元的兴奋性起很重要的调节作用[29]。NMDAR2B 参与了中间神经元兴奋性以及神经环路功能的调节,并且NMDAR2B抑制剂可以影响γ振荡的产生[30]。由此我们推测在重复力竭运动中纹状体PV神经元可能通过NMDAR2B对神经环路的前馈及反馈抑制调节起重要作用。重复力竭运动后纹状体背外侧PV 神经元呈显著激活状态,重复力竭运动后PV 神经元在纹状体背外侧的高表达提示PV 神经元对MSN的调节作用出现增强,从而在一定程度上降低谷氨酸对MSN的兴奋性毒作用和氧化损伤。
由以上可以看出随着训练的时间的延长,疲劳程度加深,纹状体背外侧PV神经元通过前馈抑制对MSN神经元的调节作用增强。PV 神经元主要是接受来自初级运动皮层的投射,在感觉运动的整合中起主要作用,这提示纹状体背外侧的感觉运动的整合有一定增加。综上可以看出长时间训练引起的疲劳可以使纹状体背外侧显著激活,且NMDAR2B 对纹状体背外侧神经元的激活起了介导作用。
4 总结
一次力竭运动后纹状体背外侧神经元电活动未出现显著性改变,7天的力竭性跑台训练引起了纹状体背外侧MSN 神经元放电频率明显增加,局部场电位也出现了γ频段功率谱密度的增强,PV 神经元也出现明显表达,这提示7 天的力竭性跑台训练引起了纹状体背外侧被明显激活,对躯体感觉运动调节作用加强。本研究还发现NMDAR2B 有明显表达且与PV 神经元共表达,提示NMDAR2B 介导了纹状体背外侧PV 神经元对MSN的兴奋性调控。重复力竭运动引起的疲劳的产生与一次性运动疲劳的产生在中枢调节中有所不同,纹状体背外侧在重复力竭运动疲劳的中枢调节中的作用增强。

