人参皂甙Rd降低Nod样受体蛋白3表达保护神经细胞创伤性损伤的作用*
陈燕伟,王 利,王 凯,李 侠,林 伟,蒋晓帆,张 磊
中国人民解放军空军军医大学第一附属医院 神经外科(西安 710032)
人叁皂甙Rd(ginsenoside Rd,GSRd)是从中药人参中提取的三萜类皂甙单体物质,由于其亲脂的特性,即便在能量缺乏情况下,也能轻易穿过血脑屏障和细胞膜,从抗氧化、抗炎和减轻线粒体损伤等方面影响多种神经细胞的活性和代谢,对缺血性脑卒中、阿尔茨海默病和脑创伤等中枢神经系统疾病发挥广泛而独特的作用[1-2]。近年有研究[3]表明,除谷氨酸具有兴奋毒性作用,钙离子具有超载和氧化应激损伤外,炎症在创伤性脑损伤(traumatic brain injury,TBI)的发生发展中发挥关键作用。在前期脑缺血性疾病的分子病理机制研究[4-5]中发现,以先天免疫通过模式识别Nod样受体蛋白3(nod-like receptor protein 3,NLRP3)等受体,激活Caspase-1,形成炎性小体,可进一步促进大量白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-18(interleukin-18,IL-18)等炎性因子分泌和释放,加重神经细胞死亡——焦亡。但GSRd能否通过拮抗焦亡影响TBI的研究少见报道。本研究旨在观察GSRd对神经细胞划伤后焦亡的影响,探讨其可能存在的分子机制,为GSRd临床治疗TBI提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞 HT22细胞系购自上海吉凯基因有限公司并由实验室保存。
1.1.2 试剂 GSRd购自美国Sigma公司; 兔抗大鼠NLRP3单克隆抗体购自美国AdipoGen公司;兔抗大鼠β-Actin单克隆抗体购自美国Cell Signaling公司;山羊抗兔IgG/辣根酶标记购自北京中杉金桥生物技术有限公司;IL-1β和 IL-18 ELISA试剂盒购自武汉博士德生物工程有限公司;链霉菌抗生物素蛋白-过氧化物酶免疫组化试剂盒购自北京中山生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养 HT22细胞经复苏、培养和扩增后,诱导其向交感神经元样细胞分化:取传5代以上HT22细胞,经消化分散后,制成5×105个/mL细胞悬液,接种于塑料培养皿中,置于培养箱内进行培养。每周换液2次,每次更换1/2新鲜培养液。
1.2.2 神经细胞划伤损伤模型制作、GSRd治疗及分组准备6孔板,将HT22细胞悬液均匀铺种于孔板中,将孔板放置于37 ℃,5% CO2孵箱中培养6 d,随机分为空白组(Sham组)、生理盐水组(Con组)和GSRd治疗组(GSRd组),GSRd组又分为10 μmol/L和50 μmol/L两个亚组。在HT22细胞培养皿中用10 μL灭菌枪头划伤各孔均匀横竖6道(共12道),GSRd培养48 h后提取细胞。GSRd组维持培养基GSRd 10 μmol/L和50 μmol/L,Con组同时给予等剂量生理盐水,Sham组细胞不做任何处理。
1.2.3 细胞活力实验 细胞接种到96孔板中(5 000个/孔),每组设置5个复孔,培养24 h。再按细胞分组,采用细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK8)检测各组细胞活力,根据450 nm下的吸光度(D)值对结果进行计算。
1.2.4 荧光免疫组化法检测NLRP3蛋白表达 HT22细胞经4%多聚甲醛固定后,驴血清封闭30 min,加入一抗抗体(NLRP31∶100)4 ℃过夜,PBS洗涤3遍,加入驴抗兔荧光二抗抗体(1∶1 000)室温孵育3 h,PBS洗涤5遍,Hoechst 染料染核5 min,PBS洗涤5遍,镜检。
1.2.5 蛋白质印迹技术检测NLRP3表达变化 收集各组处理过的HT22细胞,提取细胞总蛋白,考马斯亮蓝法测定蛋白浓度,聚丙烯酰胺凝胶电泳,分离蛋白后转移到硝酸纤维素膜上,与NLRP3(1∶500),β-actin(1∶2 000)抗体结合,然后与辣根过氧化物酶标记的二抗结合,电化发光法显色后照相。最后用凝胶成像系统(Image master VDS)摄影,图像分析软件 (Image J) 行灰度扫描分析。以目的蛋白与β-actin 的蛋白产物条带灰度值比值作为其蛋白水平的相对量,并用扫描图像分析仪计算蛋白条带的表达。
1.2.6 酶联免疫吸附测定检测IL-1β和 IL-18表达变化 将HT22细胞接种于96孔板中,同体外培养HT22细胞划伤的制作、Res预处理及分组,按照ELISA试剂盒流程进行IL-1β和 IL-18表达变化的检测。
1.3 统计学方法
2 结果
2.1 CCK8检测各组HT22细胞活力
Con组的细胞活力明显低于Sham组,不同剂量GSRd组的细胞活力高于Con组(P<0.05)(图1)。
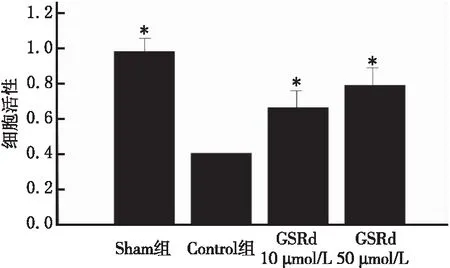
图1 CCK8检测各组HT22细胞活力
2.2 荧光免疫组化检测各组HT22细胞NLRP3表达水平
NLRP3蛋白主要分布在细胞膜和细胞质上。与Sham组比较,Con组HT22细胞死亡较多,但存活细胞中NLRP3的染色阳性率较高;与Con组比较,GSRd 10 μmol/L和50 μmol/L组HT22细胞存活较多,且NLRP3表达降低(图2)。
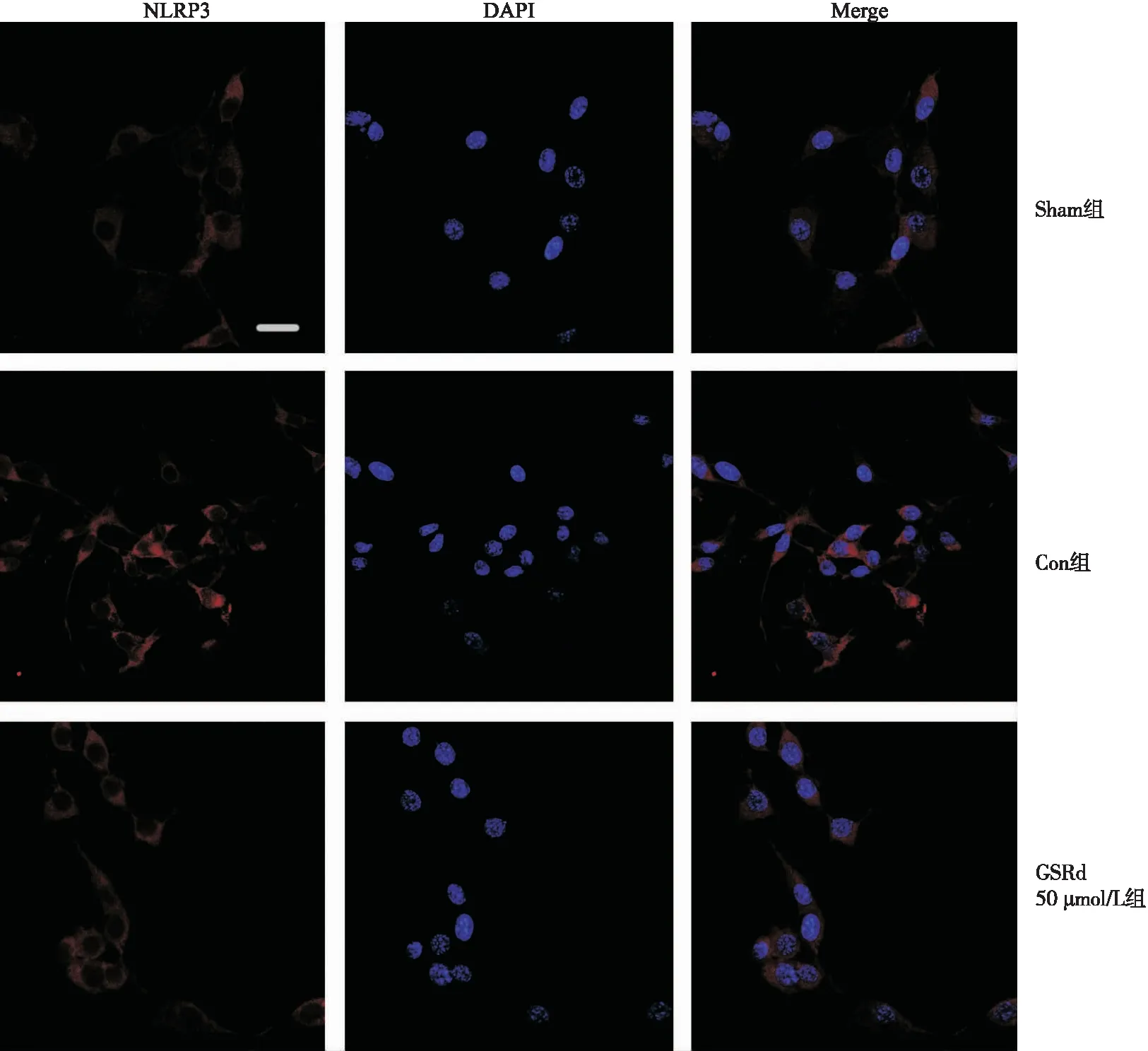
图2 3组HT22细胞中NLRP3蛋白表达情况(×400)
2.3 蛋白质印迹技术检测各组HT22细胞NLRP3的表达变化
与Sham组比较,Con组中NLRP3表达水平增高,差异有统计学意义(P<0.05);GSRd 10 μmol/L和50 μmol/L组中NLRP3表达水平也增高,差异均有统计学意义(P<0.05);GSRd 10 μmol/L和50 μmol/L组与Con组比较,均可明显降低NLRP3表达,差异均有统计学意义(P<0.05);GSRd 10 μmol/L和50 μmol/L组比较, NLRP3表达差异有统计学意义(P<0.05)(图3)。
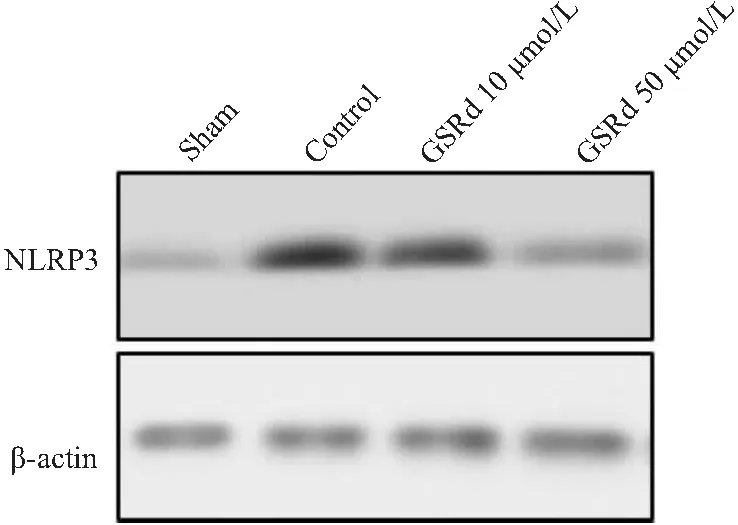
图3 蛋白质印迹技术检测NLRP3蛋白在各组中的表达变化
2.4 酶联免疫吸附测定检测各组HT22细胞IL-1β和 IL-18表达
与Con组比较,GSRd 10 μmol/L和50 μmol/L组的IL-1β和 IL-18表达水平较低,差异有统计学意义(P<0.05);而GSRd 10 μmol/L和50 μmol/L组IL-1β和 IL-18表达比较,差异无统计学意义(P>0.05)(表1)。

表1 4组细胞IL-1β和 IL-18表达对比
3 讨论
TBI具有高发生率、高致残率和高致死率,已成为威胁人类健康和生命的一类疾病。据统计,每年全世界超过5 000万人经历TBI,给家庭及社会带来了沉重的负担。TBI 致伤机制复杂,创伤后神经递质释放、自由基产生、钙介导损伤、线粒体功能障碍和凝血功能异常等病理生理过程可造成机体二次损伤,导致患者预后不佳[6-7]。近年来,关于机体固有免疫系统在疾病诱发炎性反应中发挥作用成为研究热点。有研究[8]表明,溶酶体损伤可释放大量组织蛋白酶,激活NLRP3 因子,通过细胞凋亡相关斑点样含有胱天蛋白酶募集结构域蛋白与Caspase-1结合,形成NLRP3炎性小体,促进IL-1β和IL-18等炎性因子大量释放,加重疾病的发生发展,影响患者预后。Irrera等[9]在最新一篇综述中说明TBI发生后NLRP3、Caspase-1、IL-1β和IL-18明显上调;同时,利用特异性NLRP3抑制剂可减轻TBI发生后以神经炎症为特征的损伤。此外,NLRP3和与其激活相关的分子可被认为是TBI导致的其他神经退行性疾病的生物标志物和预测因子,提示NLRP3炎性小体在TBI的发生发展,特别是炎性损伤中发挥核心作用。本研究结果发现,神经细胞划伤模拟TBI的模型中,神经细胞内NLRP3染色阳性率较高,IL-1β和IL-18也大量释放,加重神经细胞死亡,提示寻找有效拮抗神经炎症的药物或方法可改善TBI的预后。
GSRd是一种古老的传统中草药——人参的提取物,在许多疾病的预防治疗中发挥疗效。研究[10-12]证实,GSRd主要作用机制包括:1)抑制氧自由基作用,抑制活性氧的过量积聚和脂质过氧化反应;2)抑制炎性反应作用,包括自由基的清除与小胶质细胞释放炎性因子(IL-1β、IL-18和TNFα)的抑制;3) 抑制兴奋性氨基酸毒性和钙超载作用;4)减轻线粒体损伤作用,改善线粒体功能失调,重建能量代谢系统以及抑制继发的神经细胞凋亡等。Li等[13]发现,人参皂苷 Rg1 具有抗炎作用,在中枢神经系统疾病的炎症反应中,可抑制下游炎症因子产生,保护受损神经细胞。还有研究[14]表明,Aβ 1-42诱导的BV-2细胞模拟阿尔海默茨病时,不同浓度的人参皂苷Rg1可不同程度抑制IL-1β、IL-18分泌,促进抗氧化酶活力,具有明显的抗炎活性,其分子机制是通过抑制NLRP3炎性小体激活来实现的。本研究则发现,低剂量(10 μmol/L)和大剂量(50 μmol/L)GSRd对神经细胞损伤均有治疗作用,这种保护作用是通过降低NLRP3表达,抑制IL-1β和 IL-18的大量释放,减轻炎性反应,从而降低神经细胞死亡实现的。上述结果表明,神经细胞受损后,氧化应激反应和炎性反应同时加剧其损伤程度,而不同浓度的GSRd均可有效抑制氧化应激毒性作用,减轻白介素等炎性因子的释放,阻断神经细胞死亡通路,发挥神经细胞保护作用。
综上所述,GSRd可通过抑制NLRP3信号通路,减少IL-1β和 IL-18的释放,进而抑制神经细胞死亡。但GSRd作用后拮抗的炎性反应和氧化应激之间信号通路,以及在体内治疗的作用有待进一步实验验证。

