术前增强CT影像组学预测肝癌术后早期复发的价值
熊亮霞,方淇民,李淑豪,彭云,龚良庚
肝细胞肝癌(hepatocellular carcinoma,HCC)是全球第六大常见恶性肿瘤,其死亡率位于全球癌症的第三位[1]。手术切除是肝功能良好HCC患者的主要治疗方法[2]。然而,肝癌患者切除术后的复发率仍高达50%~70%,并导致不良预后[3-4]。准确预测肝癌术后早期复发风险对临床复发的监测、预防和治疗策略的制订具有关键性作用。影像组学作为一种新的影像学生物标志物,通过非侵入性特征分析技术获得与疾病相关的各种隐藏信息,有助于HCC的诊断、术前微血管侵犯(microvascular invasion,MVI)的预测及疗效评估等[5-6]。本研究旨在探讨术前临床资料及增强CT图像影像组学方法预测HCC切除术后早期复发的价值。
材料与方法
1.临床资料
回顾性分析2017年1月-2019年7月本院行肝部分切除术并经组织病理学确诊为HCC患者的病例资料。纳入标准:①经手术病理证实为HCC;②在术前2周内行上腹部CT增强扫描;③CT图像质量满意。排除标准:①术前有HCC治疗史;②临床资料不完整;③术后2年内失访。共有130例HCC患者纳入研究,男100例,女30例;年龄23~83岁,平均(55.6±12.6)岁;肿瘤最大直径0.9~18.0 cm,平均(5.9±3.9) cm。从临床病历系统中搜集患者的年龄、性别、乙肝表面抗原(HBsAg)、血清甲胎蛋白(AFP) 、血清球蛋白(GLB) 、血清总胆红素(TBIL) 、谷草转氨酶(AST)、谷丙转氨酶(ALT)、γ-谷氨酰转肽酶(γ-GT)、血小板计数(PLT)、中性粒细胞与淋巴细胞比值(NLR)、凝血酶原时间(PT)、凝血酶原时间国际标准化比率(INR)、病理分化程度、微血管侵犯(MVI)及肿瘤最大径(maximum tumor diameter,MTD)等基本临床资料。
2.CT扫描方案
使用Siemens Somatom Definition Flash双源CT机行上腹部CT扫描,扫描参数:120 kV,210 mAs,层厚5.0 mm,层间距5.0 mm,矩阵512×512,重建层厚1.25 mm。首先进行常规平扫,然后以2.4 mL/s的流率经肘静脉注入对比剂碘普罗胺(370 mg I/mL),剂量1.1 mL/kg,随后以同样流率注入20 mL生理盐水冲管,延迟25 s行动脉期扫描,于动脉期开始后30 s进行静脉期扫描。
3.随访及复发评估
通过门诊、电话和病例查询系统对所有患者进行规律随访,术后每3个月定期监测HCC患者的血清AFP等肿瘤标志物及腹部超声、CT、MRI或肝动脉造影等检查。早期复发定义为HCC患者手术切除后2年内通过超声、CT、MRI或肝动脉造影等影像学检查发现新的肝内病灶或肝外转移,标准如下:①新的肝内病灶,具有典型的HCC影像学表现,且经组织病理学证实或术后TACE术中DSA显示肿瘤染色;②典型的影像学特征或组织病理学证实为肝外转移[7]。本研究中患者随访时间为1~46个月,中位数为24个月。
4.图像勾画及特征提取
病灶分割:首先标准化图像灰阶,由一位高年资放射科医师(具有5年以上腹部影像诊断经验)使用ITK-SNAP软件,分别在动脉期和静脉期图像上逐层沿靶病灶边缘勾画ROI,最后经软件处理融合成三维容积ROI(volume ROI,VOI),然后由另一位高年资放射科医师(具有10年以上腹部影像诊断经验)对结果进行核查和验证(图1a~b)。
特征提取:应用GE 公司AK(Artificial Intelligence Kit, Version: 3.2.0.R)软件对已勾画ROI的CT图像进行特征提取,每个期相提取8大类共569个特征参数,分别为一阶特征、灰度直方图(图1c)特征、灰度共生矩阵(gray-level co-occurrence matrix,GLCM)特征、灰度游程矩阵(run-length matrix,RLM)特征和灰度步长矩阵(gray-level run-length matrix,GLRLM)特征。以均值替换异常值对特征数据进行预处理,同时采用Z-score标准化特征参数。

图1 特征参数提取。a)使用ITK-SNAP软件,在动脉期图像上沿病灶边缘手动勾画ROI(红圈);b)将每个层面勾画的病灶ROI融合,获得三维VOI;c)经AK软件提取获得的灰度直方图示意图。横坐标为灰度级,纵坐标表示对应各灰度值的像素在图像中出现的频数。
5.统计学方法
临床数据:使用SPSS 25.0软件进行统计分析。分类变量采用卡方检验进行分析;连续变量采用Kolmogorov Smirnov检验判断是否符合正态分布,符合正态分布者组间比较采用独立样本t检验,不符合者采用Mann WhitneyU检验。以P<0.05为差异有统计学意义。对单因素分析中P<0.05的临床因素进行多因素logistic回归分析并建立回归模型。
组学特征数据:均采用IPMs 2.4.0软件进行统计学处理。先对所有特征参数进行Pearson相关性分析以去除冗余,随后采用t检验及Wilcoxon秩和检验降低特征维度;按照2∶1的原则将130例患者随机分为训练集(84例)和测试集(46例),以本研究中早期复发作为二分类问题,采用支持向量机方法(support vector machine,SVM)对已筛选的特征进行建模,采用ROC曲线分析评估模型的诊断效能,计算敏感度、特异度、符合率和ROC曲线下面积(area under curve,AUC)等效能指标。模型间AUC的比较采用Delong检验。
结 果
1.一般资料
130例中,早期复发61例(46.9%),无早期复发69例。两组患者临床资料的单因素分析结果见表1。
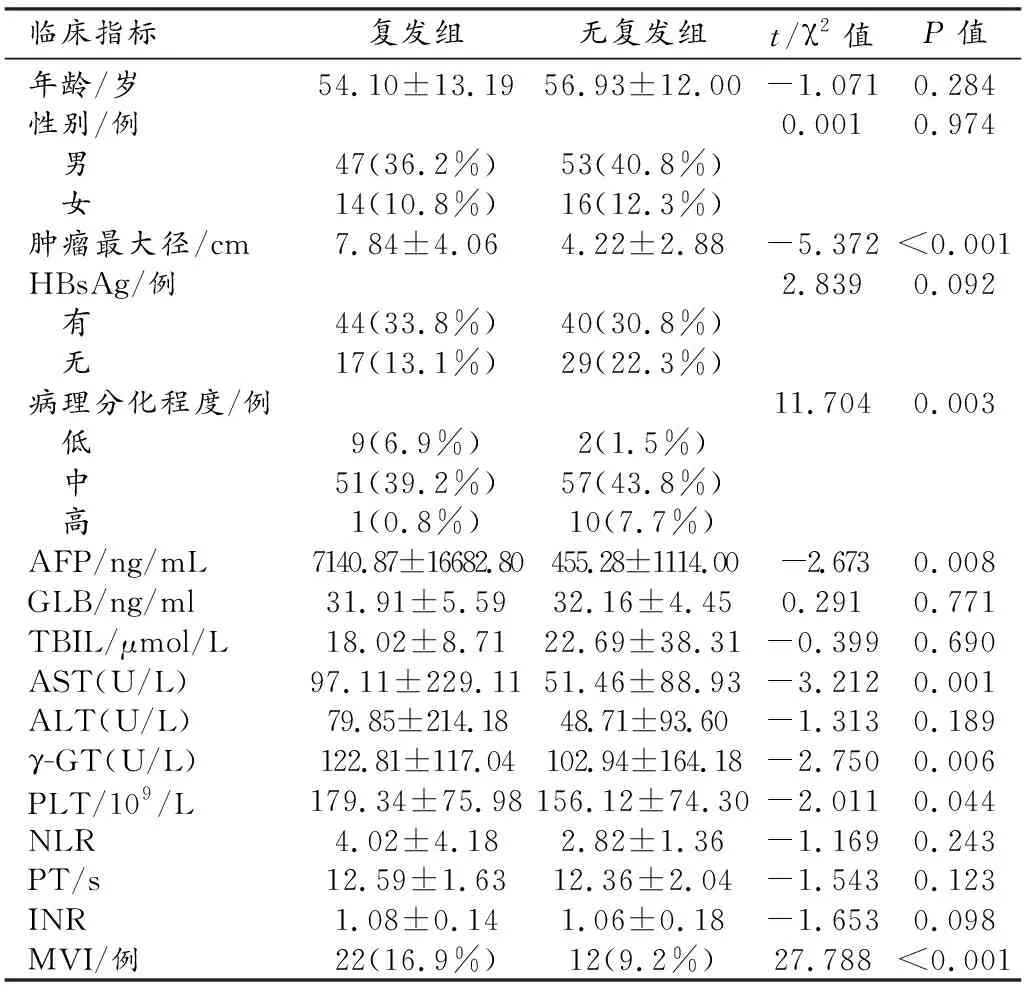
表1 HCC患者早期复发的单因素分析
早期复发组与无复发组之间肿瘤最大径、AFP 、AST、γ-GT、PLT、病理分化程度和MVI的差异有统计学意义(P<0.05);其它指标间的差异无统计学意义(P>0.05)。
多因素logistic回归分析结果显示肿瘤最大径和MVI是HCC患者术后早期复发的独立危险因素(P<0.05),详见表2。
2.组学特征分析和预测模型的建立
特征降维筛选后,获得动脉期4个、静脉期2个最佳组学特征,特征名称及统计分析结果见表3。
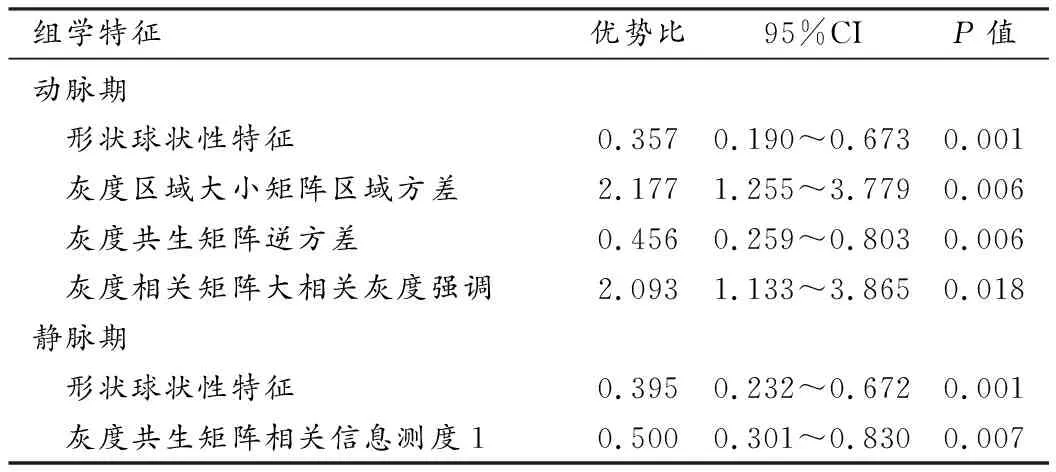
表3 降维后筛选出的动脉期和静脉期最佳组学特征
基于动脉期和静脉期最佳特征集及临床风险因子,采用SVM算法基于训练集中样本数据分别建立相应的预测模型,采用ROC曲线分析评估其诊断效能,并在验证集中进行验证,结果见表4、图2。以动脉期预测模型的AUC值大于静脉期及临床模型,其在训练集中AUC为0.847;在验证集中为0.858(图3),Delong检验结果表明动脉期预测模型效能优于静脉期模型及临床模型(P=0.018;P=0.026)。联合动脉期的有效特征参数与临床有意义因子建立组合模型,其预测性能较单纯动脉期模型显著提高(Delong检验示P=0.022),在训练集中AUC为0.882,在验证集中AUC为0.938。

图2 不同纳入因子建立的预测模型的ROC曲线,以组合模型的AUC最大。SVM_1代表动脉期模型,SVM_2代表静脉期模型,SVM_3代表临床模型,SVM_4代表组合模型。 图3 基于动脉期CT图像组学特征建立的预测模型的ROC曲线。a)模型在训练集中的ROC曲线,AUC为0.847;b)模型在验证集中的ROC曲线,AUC为0.858。

表4 各模型在训练集合验证集这的预测效能
讨 论
HCC肿瘤组织异质性明显,肝部分切除术后复发率仍较高,患者的预后较差[8]。近年来,有研究者探讨了临床指标及常规影像表现预测HCC切除术后早期复发的可能性,但发现部分临床实验室指标短期波动较大、可重复性不高,且影像学征象的评估较为依赖医师的主观经验[9-11]。影像组学可将图像信息与病理、临床疗效和预后相关联,已广泛应用于肿瘤的诊断、疗效及预后预测中[12]。Zhang等[13]构建了基于CT影像组学特征的晚期胃癌患者根治性切除术后早期复发的预测模型并绘制了诺模图,其结果显示该模型的预测效能良好(AUC=0.831)。这些研究证实了影像组学方法可以预测肿瘤术后早期复发并指导临床治疗。本研究使用SVM方法建立了CT影像组学模型,结果显示模型对HCC患者肝切除术后早期复发具有较高的预测价值,其中基于动脉期组学特征集的预测模型优于静脉期和临床模型,将动脉期最优特征集与临床风险因子结合后,模型的预测效能较前明显提升。
影像组学提取了大量涉及图像各个层次和方面的图像特征,主要包括一阶直方图特征、二阶纹理特征、高阶滤波特征等。然而海量的特征数据集具有复杂度高、针对性差和分类性能差的特点,为了提高特征的普适性和可重复性,本研究对特征进行了降维[14]。在经过降维筛选后,最终选取了4个动脉期、2个静脉期最优特征子集,其中,形状特征中的球状性(Sphericity)是动、静脉期特征集的共有特征,它既可描述图像的二维、也可描述三维信息;灰度区域大小矩阵特征中的区域方差(ZoneVariance)和灰度相关矩阵特征中的大相关灰度强调(Large Dependence Emphasis)的优势比(odds ratio)较高,表明两者与早期复发显著相关。不同特征类型反映的具体意义不同,灰度区域大小矩阵是纹理特征的高级统计矩阵,它反映了图像纹理的均匀性,矩阵越宽大、平坦,表示图像纹理越均匀;灰度相关性矩阵是基于灰度共生矩阵计算出来的统计量,反映了图像局部灰度的相关性,主要用来度量行或列上的图像灰度级的相似程度,矩阵各项参数值越大,与早期复发的相关性也越大[15-16]。
本研究中,动脉期降维筛选后与早期复发相关的特征参数多于静脉期,且动脉期预测模型的诊断效能优于静脉期,笔者分析可能的原因如下。①根据HCC病理生理学原理,肿瘤细胞的小血管大多由肝动脉供血,增强扫描动脉期可见病灶有明显强化[17]。②肿瘤周围微小癌栓形成,导致门静脉微小分支阻塞,进而引起静脉血供减少或缺乏,造成“代偿性动脉灌注”,即短暂性肝密度差异[18]。以上HCC的特征性影像学表现主要出现于动脉期,表明动脉期图像可以更好地反映肝癌病灶的异质性[19],且在特征提取软件中可以更好的被捕捉到。
多因素分析结果显示肿瘤最大径和MVI是HCC患者肝切除术后早期复发的独立危险因素。有研究发现肝癌肝切除术后复发风险随着肿瘤直径的增加而增加,肿瘤直径的增大通常伴随着HCC恶性生物学行为的进展,如侵犯微血管、形成癌栓、出现子灶或卫星结节等[20-21]。微循环浸润是HCC恶性度增加及侵袭性增强的标志,且多发生于晚期肝癌中。MVI是目前较为公认的预测早期复发的指标,因此术前评估MVI对指导HCC患者的临床治疗决策及预防术后早期复发具有重要的临床意义[5]。我们的研究结果与之一致。本研究将临床风险因子与动脉期最优组学特征子集组合并采用SVM方法构建预测模型,此组合模型对HCC切除术后早期复发的预测效果较单序列模型明显提升。
本研究的局限性:①为单中心研究,样本量偏小,有待多中心外部验证。②没有研究影像组学与肿瘤基因之间的关联,应探讨基于影像组学分析肿瘤早期复发与肿瘤基因之间的相关性,以更好的为精准医学服务。③大多数患者有肝硬化背景,可能存在选择偏倚,且很难区分HCC的早期复发和新生HCC。
综上所述,基于CT的影像组学模型可以有效预测HCC切除术后早期复发,从而为患者的临床个性化治疗策略提供指导。

