血管内皮抑制素联合TACE对肝癌的疗效和CT纹理特征的影响
吕银章,罗彦,胡学梅,王南
肝细胞癌(hepatocellular carcinoma,HCC)在我国发病率和致死率均较高,我国肝癌死亡病例数常年居全球第一[1]。经动脉导管化疗栓塞术(transcatheter arterial chemoembolization,TACE)是HCC非根治性治疗中的主要方法,近期疗效明确、创伤小且应用广泛。但TACE术后常发生残留、复发和转移等,TACE术后残存的肿瘤细胞和诱导的肿瘤新生血管可能是肿瘤复发的影响因素。TACE后肿瘤组织缺血、缺氧导致相关促血管生长因子增多,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)的升高可促进HCC组织微血管生长,致使HCC侵袭性和转移能力增强[2]。血管内皮抑制素是抗血管生成的靶向药物,是VEGF受体的抑制剂。很多研究表明血管内皮抑制素联合TACE治疗HCC的疗效更好,且不良反应并不增加[3]。
纹理分析采用统计、模型和变换等方法对医学影像图像中的纹理基元信息进行处理,计算出特征参数,探索其蕴含的规律,从而量化分析肿瘤的异质性[4]。本研究试图分析血管内皮抑制素联合TACE对肿瘤组织纹理特征的影响,通过对血管内皮抑制素联合TACE和单纯TACE两种方法治疗HCC后CT增强门静脉期图像进行纹理分析,对比两组中HCC病灶的纹理参数,以明确不同的治疗方法对肿瘤异质性的影响。
材料与方法
1.一般材料
将2012年9月-2020年1月在本院初诊为HCC且随后采用血管内皮抑制素联合TACE治疗的37例患者作为观察组。纳入标准:①按照2019年版《原发性肝癌诊疗规范》(后文简称《规范》)中临床诊断标准明确诊断或肝穿刺活检病理检查证实为HCC;②符合《规范》中TACE治疗适应证,且不符合外科手术治疗适应证,或者患者及其代理人不愿意接受手术治疗;③采用美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)提出的功能状态评分来评估患者的全身情况,体能评分为0~2分,肝功能Child-Pugh评分为A或B级;④初次治疗方案为血管内皮抑制素联合TACE治疗;⑤TACE治疗的靶病灶中有最长径≥5 cm的病灶;⑥TACE治疗前4周内和治疗后4~8周内均完成了CT三期动态增强扫描,有治疗前和治疗后1.25 mm层厚的薄层CT图像。排除标准:①在治疗前CT动脉期图像上HCC病灶无明显强化;②确诊HCC时已经发现了远处转移,如肺转移、骨转移等;③TACE治疗的所有靶病灶最长径小于5 cm;④从发病至CT复查的这段时间内,接受了除TACE之外的其它抗肿瘤治疗方法,包括口服靶向药物、外科切除术、肝移植手术、局部消融治疗和放疗等;⑤治疗前、后无CT检查图像,或仅为平扫图像,或CT图像质量不佳,或层厚不符合要求。
将同期在本院初诊为HCC、初次主要治疗方法为TACE但未联合血管内皮抑制素的52例患者作为对照组纳入本研究。除第④条纳入标准外,其它纳入和排除标准与观察组相同。
所有病人在接受治疗前签署知情同意书。
2.TACE操作步骤
用导管或微导管超选择性插管至肿瘤每一支供血动脉内,缓慢推注超液化碘油和洛铂混合成的乳剂进行化疗栓塞,超液化碘油用量不超过20 mL,洛铂用量不超过50 mg。化疗药物推注完成后,将导管或微导管置于肿瘤供血动脉主干,观察组给予适量的明胶海绵颗粒和15 mg血管内皮抑制素的混悬液进行栓塞,对照组仅给予适量明胶海绵颗粒进行栓塞。
3.CT扫描方法
使用GE LightSpeed VCT型CT扫描仪,治疗前和治疗后均在屏气状态下行三期动态增强CT扫描,扫描范围自膈顶至肝下缘水平。扫描参数:20 kV,250 mA,层厚5.00 mm,层距5.00 mm,矩阵512×512。使用碘普罗胺注射液(370 mg I/mL)作为对比剂,总量按[身高(cm)-100+体重(kg)]/2的公式计算,使用高压注射器经肘静脉留置针给药, 再给予生理盐水25 mL,对比剂和生理盐水的注射流率均为3.0 mL/s。采用智能追踪技术,监测ROI置于腹主动脉管腔内,当ROI的CT值达120 HU时立即启动动脉期扫描,30 s后扫描门静脉期,200 s后扫描延迟期。扫描结束后采用1.25 mm层厚进行薄层重建。
4.图像纹理分析及评价
采用FireVoxel软件(Build 257A-362;https://wp.nyu.edu/firevoxel/或https://firevoxel.org/)对治疗前、后CT增强门静脉期1.25 mm薄层图像进行纹理分析。ROI的勾画由两位放射科医师协商一致后完成,两位医师均具有3年以上腹部放射诊断工作经验且对患者的预后情况不知情。在最大靶病灶的所有层面勾画ROI,经后处理融合形成病灶的容积ROI(图1a~b)。在勾画ROI过程中,手动剔除病灶中的大片状液化坏死区域和明确的大血管。治疗后图像在ROI勾画完成后,基于CT值分割ROI(软件操作工具: Split ROI with Threshold),取CT值低于200 HU的体素值,舍弃CT值大于200 HU的体素,以剔除碘油沉积的影响(图1c~d)。基于治疗前、后的CT图像,分别获得16个灰度直方图参数:平均数、标准差、不均一性、偏度、峰度、熵、最小值、最大值、中位数及第 5、10、25、50、75、90和95百分位数(percentile,Pk)。FireVoxel软件为运算方便,在原始CT值的基础上相应增加1024 HU,故本论文结果中所有统计图表,均为增加了1024 HU后的数值。
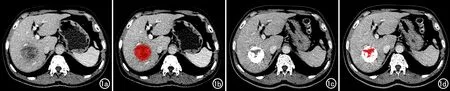
图1 HCC患者,男,55岁,丙肝,治疗前AFP阴性。a)TACE治疗前门静脉期薄层CT图像,显示肝右叶类圆形低密度病灶;b)图a上勾画ROI后的图像,ROI为红色;c)血管内皮抑制素联合TACE治疗后CT增强门静脉期图像,病灶内可见碘油沉积的致密高密度影,仅部分中心区域无碘油沉积;d)在图c上勾画ROI后,基于CT值分割ROI,CT值大于200HU的白色区域为碘油沉积区,小于200HU的红色区域为最终ROI,对最终ROI进行纹理分析。
5.TACE治疗的疗效评价
疗效判定由两位具有3年以上腹部放射诊断经验的医师按照修订版实体瘤疗效评估标准(the modified response evaluation criteria in solid tumors,mRECIST)标准独立完成,结果不一致时请一位具有10年以上腹部放射诊断经验的医师参与会诊,协商达成一致意见。这3位医师均未参与ROI勾画过程,且对患者的预后情况不知情。mRECIST 将肿瘤对治疗的反应分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病进展(progressive disease,PD)和疾病稳定(stable disease,SD)。有效率(response rate,RR)为在复查时间点CR和PR患者占患者总数的比例。
6.统计学处理
使用SPSS 23.0软件进行统计学分析。对治疗前、后两组之间各项灰度直方图参数进行比较。计数资料的组间比较采用卡方检验;对计量资料,先采用Shapiro-Wilk检验分析各项参数的正态性,符合正态分布者用均数±标准差表示,不符合正态分布者采用中位数表示,符合正态分布者组间比较采用独立样本t检验,不符合者采用Mann-WhitneyU检验。以P<0.05为差异具有统计学意义。对有统计学意义的参数,采用受试者工作特征(ROC)曲线分析其诊断效能,计算曲线下面积(AUC)和最大约登指数(Youden's index)。
结 果
1.两组患者一般特征的比较
观察组37例,其中男36例,女1例;年龄15~74岁,平均(50.19±13.05)岁。对照组52例,其中男46例,女6例;年龄34~81岁,平均(53.13±11.42)岁。两组共89例,男82例,女7例;年龄15~81岁,平均(51.91±12.14)岁。两组患者在接受TACE治疗前一般特征的比较结果见表1。两组之间性别、肝炎情况、AFP、病灶数目、门静脉瘤栓和肝硬化的比较采用卡方检验;两组的年龄均符合正态分布,组间采用独立样本t检验;两组的病灶体积均不符合正态分布,组间比较采用Mann-WhitneyU检验。两组患者一般情况的差别均无统计学意义(P>0.05)。
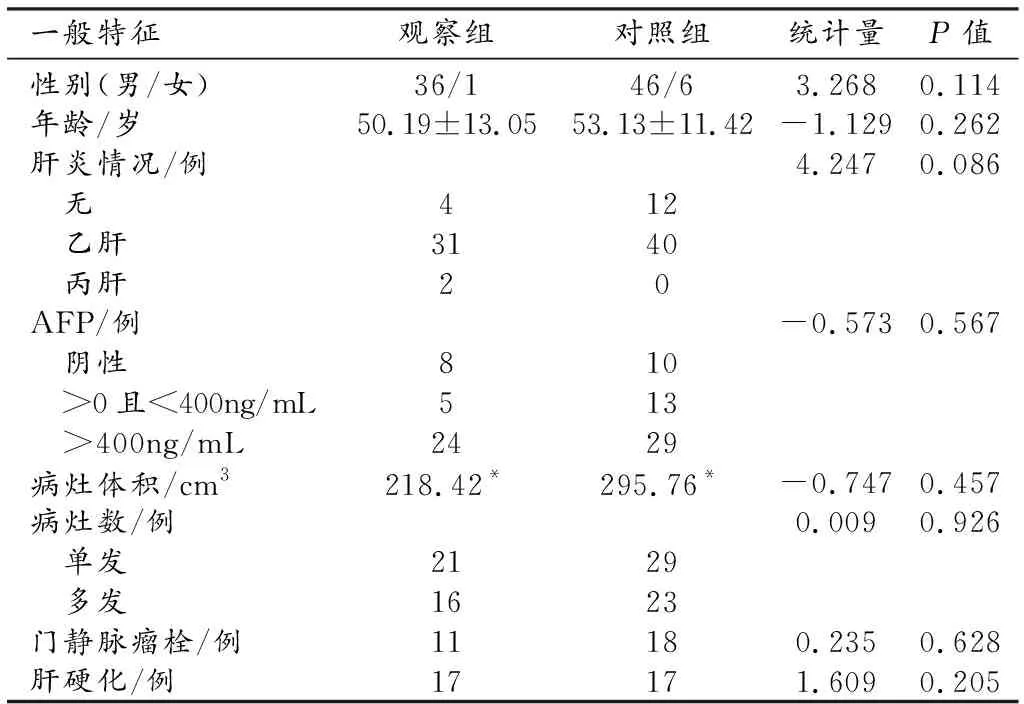
表1 两组患者TACE治疗前一般特征的比较
2.两组患者疗效的比较
两组患者疗效的对比见表2。观察组有效率为48.65%(18/37),对照组为26.92%(14/52),两组间疗效的差异有统计学意义(Z=-2.045,P=0.041<0.05)。
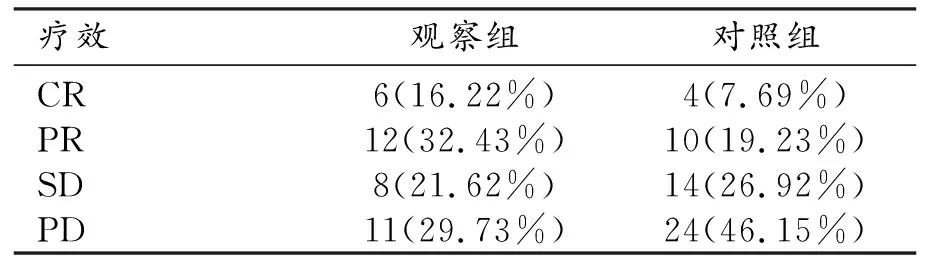
表2 两组患者治疗效果的比较 /例
3.两组灰度直方图参数的比较
治疗前、后观察组和对照组纹理参数的比较结果见表3。治疗前两组之间仅最大值的差异有统计学意义(P=0.006),其它参数的差异无统计学意义(P>0.05)。治疗后两组之间标准差、不均一性、峰度、熵、P90和P95值的差异有统计学意义(P<0.05)。
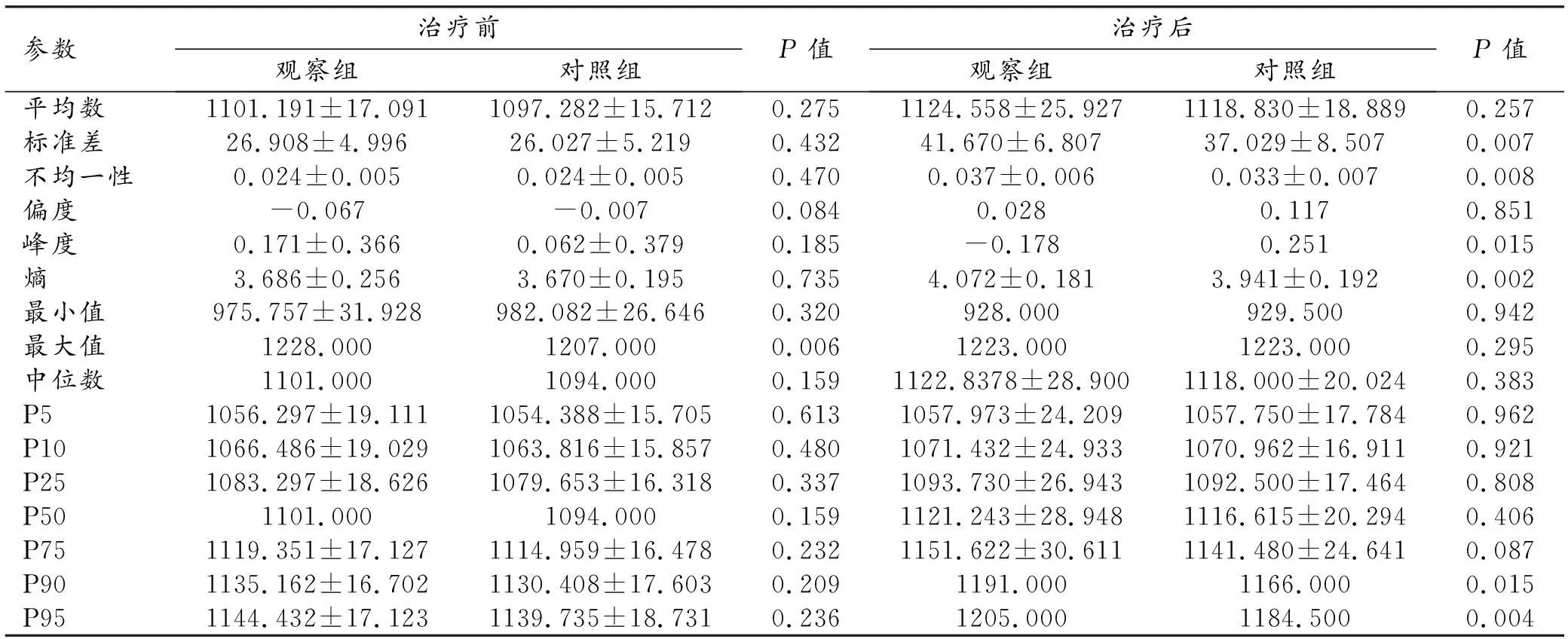
表3 治疗前、后两组灰度直方图参数的比较
4.ROC曲线分析
对组间差异有统计学意义的7个直方图参数采用ROC曲线分析其诊断效能,结果见表4和图2~3。治疗前直方图参数中最大值的AUC为0.671,当截断值为1210.000时,约登指数最大,为0.478,对应的敏感度和特异度分别为0.784和0.694。治疗后的6个直方图参数中,以熵的AUC最大(为0.701),其阈值为3.945时,约登指数最大(为0.369),对应的敏感度和特异度分别为0.811和0.558。
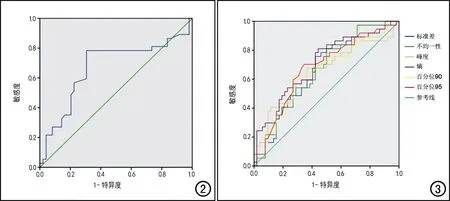
图2 治疗前直方图参数中最大值的ROC曲线,AUC为0.671。图3 TACE治疗后的组间差异有统计学意义的有6项灰度直方图参数的ROC曲线,以熵的AUC最大,为0.701。

表4 有统计学意义的直方图参数的诊断效能指标值
讨 论
TACE除了是中晚期HCC的标准治疗方法之一[5],还适用于多种情况,如等待肝移植期、降期使部分患者重获手术机会、外科切除术后的辅助治疗、外科切除术后复发灶以及门静脉癌栓但无其它疗效明确的方法可选择等情况[6-10]。TACE治疗HCC的主要机制是栓塞血管使肿瘤细胞缺血坏死和化疗药物对肿瘤细胞的杀灭效果。TACE治疗后发生肿瘤残留或复发、转移可能与HCC供血动脉栓塞后肿瘤组织缺血、缺氧导致相关促血管生长因子增多有关。TACE应用广泛但仍有许多不足之处,提高TACE疗效意义重大。有研究者将抗血管生成药物和TAE联合,在动物实验上取得了提高疗效的结果[11]。多项研究将索拉非尼联合TACE用于治疗肝癌患者,取得了延长疾病进展时间和提高生存获益的效果[12-13]。本研究中观察组患者的早期疗效优于单纯TACE治疗的对照组,差异具有统计学意义(P<0.05),这一结果与国内外多项研究结果基本一致[3,14,15],这些研究发现血管内皮抑制素联合TACE在提高疗效的同时,还能降低术后复发率,且术后不良反应并不增加。
纹理分析可以用于HCC的筛查、诊断、鉴别诊断及临床分级、分期和决策,可以用于预测和评价外科切除术、TACE治疗及靶向药物等的疗效和预后[16-23]。本研究中对比分析了血管内皮抑制素联合TACE与单纯TACE治疗后门静脉期CT图像上HCC病灶的灰度直方图纹理参数,以观察在TACE治疗中使用血管内皮抑制素对HCC肿瘤组织异质性的影响,结果显示两组之间多个灰度直方图参数的差异有统计学意义(P<0.05),表明血管内皮抑制素联合TACE能改变肿瘤异质性,这些改变可以表现为纹理特征的变化,从而被灰度直方图参数所反映。洪之海等[24]进行的一组单臂研究表明,基于治疗后CT纹理分析建立的影像组学模型是可以评价血管内皮抑制素联合其他药物治疗非小细胞肺癌的疗效的。
本研究选取CT门静脉期图像进行纹理分析。多项研究的结论表明增强CT门静脉期图像的纹理分析,可以反映HCC的肿瘤异质性,为预测疗效、预测手术切除术后生存期、预测早期复发等方面提供帮助[22,25-28]。黄燕琪等[29]的研究表明,纹理分析在鉴别肝内病灶的良、恶性方面,增强图像优于平扫图像,门静脉期图像优于动脉期和延迟期图像。Ng等[30]认为,全体积数据的纹理分析能能更准确地反映肿瘤的异质性。故本研究中选择全体积数据 进行纹理分析。Echegaray等研究[31]发现最大内切圆法与人工手动分割病灶获得的纹理参数值具有很好的相关性,勾画ROI时不纳入病灶边缘(不能确定为病灶部分)是通用的做法,但TACE术后病灶复发或进展以及残留的肿瘤中反而可能是病灶边缘的血供更丰富,这一矛盾及其对ROI勾画的影响有待进一步研究。此前几乎没有关于传统碘油栓塞TACE治疗后CT图像纹理分析的报道。高密度的碘油会干扰灰度直方图参数值,本研究选择通过CT值的方法剔除碘油沉积的影响。采用200 HU的CT值作为阈值是否准确,是否存在更好的剔除碘油沉积的方法,有待进一步的探索和研究。本研究采用的纹理分析方法是灰度直方图,后续研究中倘若能使用更多的纹理分析方法,提取二阶、高阶或其它基于变换和模型的纹理特征,可能可以获得更多、诊断效能更高的信息。
本研究的不足之处:①仅为回顾性研究;②病例数有限,肝癌患者的个体异质性和肿瘤内部异质性都很大,但病例筛选和病灶ROI的手动勾画需要花费大量的时间和精力,后续研究将开展大样本影像组学研究。总之,血管内皮抑制素联合TACE治疗,可以提高疗效,可以改变治疗后HCC病灶的纹理特征。

