流感病毒先天免疫应答和先天免疫逃逸的机制*
张乃心 许程志 吴运谱 乔传玲** 陈化兰
(1)中国农业科学院哈尔滨兽医研究所/兽医生物技术国家重点实验室,哈尔滨 150069;2)辽宁中医药大学实验动物中心,沈阳 110847)
流感病毒是一种多节段的单股负链RNA病毒,主要分为A、B、C 和D 4 种类型。A 型流感病毒(influenza A virus,IAV)的研究最为广泛,IAV的基因组全长约13 500 bp,包含8 个基因片段(PB2、PB1、PA、HA、NP、NA、M 和NS)(图1),可以编码至少20 种蛋白质[1],其中参与先天免疫逃逸的蛋白质主要有NS1、PB1-F2 和PA-X 蛋白。IAV感染宿主广泛,禽、猪、人、马、蝙蝠及海洋哺乳动物等均可被IAV感染。IAV感染的主要靶组织是宿主的上呼吸道和肺泡上皮细胞,使得机体气体交换失败,严重时可导致死亡。
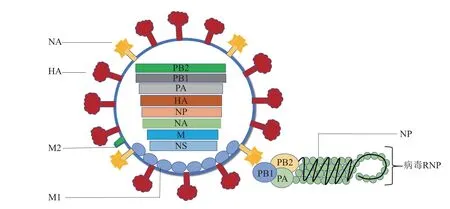
Fig.1 Structure diagram of influenza virus图1 流感病毒结构示意图
在与宿主共同进化的过程中,IAV不时地引起季节性流行或世界性大流行。流感病毒生存能力强的原因主要有两个方面:a.IAV不同亚型间基因片段的重组[2];b.在天然免疫的压力下,IAV演变出一系列逃避病毒中和抗体的识别和免疫清除的策略。因此,了解IAV 如何设法逃逸宿主的天然免疫,对于有效监测流感病毒的抗原变异、病毒防控和致病机制研究显得尤为重要。
1 IAV感染引起的宿主先天性免疫应答
当IAV入侵宿主呼吸道后,天然免疫反应被迅速启动。天然免疫系统是由物理屏障、先天性免疫细胞、细胞因子、干扰素等组成[3]。先天性免疫机制虽然应答速度快,但缺乏特异性和记忆性。天然免疫系统通过模式识别受体(pattern recognition receptors, PRRs) 识 别 病 原 相 关 分 子 模 式(pathogen-associated molecular patterns,PAMPs),启动抗病毒级联反应。激活转录核因子κB(nuclear factor κB,NF-κB) 和干扰素调节因子(interferon regulatory factor,IRF),从而导致干扰素(interferon,IFN)等的生成、先天免疫细胞的招募或程序性细胞死亡的激活。
IAV可以被多种PRRs识别(图2)。首先,Toll样受体(Toll-like receptors,TLRs) 中的TLR3、TLR7/8 分别可以识别内噬体中的dsRNA 和ssRNA[4-5],随后招募和活化TRIF、MyD88接头分子。TRIF 依赖性途径直接招募TRAF3 和TRAF6。TRAF6 通过多泛素化激活RIPK1,又经磷酸化激活TAK1,导致NF-κB、IRF7和AP1的激活和核易位。TRAF3 通过多泛素化激活IKK 激酶复合物,然后通过磷酸化激活IKKε/TBK1,导致IRF3 的激活和核易位。经MyD88 依赖性途径进行的信号传递通过多泛素化与TRAF6 激活TAK1,TAK1 活化后经磷酸化激活IKK 激酶复合物和MAPK 激酶,导致NF-κB、IRF7 和AP1 的激活和核易位[6]。最终各途径在细胞核内编码I型、III型干扰素和促炎性细胞因子。RIG-I 样受体(RIG-I-like receptors,RLRs)大部分存在于细胞质,有一小部分定位于细 胞 核[7]。RNA 解 旋 酶 结 构(RNA helicase domain,helicase)是RIG_I的一个功能区,特异性识别10~19 bp 的较短dsRNA。RIG-I 样受体可使线粒体抗病毒信号转导蛋白(mitochondrial antiviral signaling protein,MAVS)的构象发生改变,暴露出caspase 活化与招募功能区(caspase activation and recruitment domain,CARD)[8]。活化的MAVS 可以与TRAF3 结合,TRAF3 通过多泛素化激活RIPK1,然后通过磷酸化激活IKK 激酶复合物,直接导致NF-κB的激活及核易位,或通过IKKε/TBK1 导致IRF3、IRF7 的激活及核易位[9-10]。值得注意的是,核内RIG-I识别了核内vRNPs后发生寡聚化,并在细胞核和线粒体膜之间的邻近区域与MAVS相互作用,从而诱导抗病毒信号通路[11]。NOD 样 受 体(nucleotide-binding oligomerization domain-like receptors,NLRs)中NLRP3 炎性小体被IAV 激活时可以促进IL-1β 和IL-18 的成熟和分泌[12]。其可以主要通过以下3 种方式激活:a. 通过IAV dsRNA 激 活Pro-IL-1β、Pro-IL-18 和Procaspase-1[13];b. 通过M2 离子通道触发Pro-IL-1β和Pro-IL-18 的剪切[14];c.通过在巨噬细胞溶酶体中IAV PB1-F2蛋白的积累[15]。

Fig.2 Schematic diagram of host innate immune response caused by influenza A virus图2 IAV感染引起的宿主先天性免疫应答示意图
包浆蛋白Z-DNA 结合蛋白1(Z-DNA binding protein 1,ZBP1)作为先天免疫领域的新星,其可诱导IAV感染过程中程序性细胞死亡途径、炎症小体激活和细胞因子的产生。Kuriakose 等[16]认为ZBP1 蛋白可以识别胞质中的NP 和PB1 蛋白。ZBP1 蛋白的Zα2 结构域识别了胞质中的IAV RNA后可以在感染的细胞中引发多种反应[11]:ZBP1蛋白的RHIM 结构域可以与丝氨酸激酶RIPK1 和RIPK3 相互作用,ZBP1-RIPK1 通路可导致NF-κB的活化及核易位;ZBP1-RIPK3 通路可使得MLKL磷酸化导致细胞程序性死亡;ZBP1-RIPK3-RIPK1-FADD-caspase8通路可以激活NLRP3炎性小体,导致细胞焦亡[16-17]。
干扰素主要分为3 种类型,其中I 型干扰素α、β和III型干扰素λ 在天然免疫抑制IAV病毒的复制中发挥极其重要的作用[18]。分泌出的干扰素作用于同一细胞的干扰素受体(interferon receptors,IFNR) 启动级联反应,级联反应依赖于Jak1、Tyk2、STAT1 和STAT2 的磷酸化复合物。最终结果是与干扰素调节因子9 (interferon regulatory factor,IRF9)组成干扰素刺激基因因子3(IFNstimulated gene factor-3 transcription factor complex 3,ISGF3)[19],ISGF3 的激活可以直接刺激下游干扰素诱导反应中300多个基因的转录。
2 IAV利用自身蛋白质逃避宿主天然免疫应答
2.1 PB1-F2蛋白

Fig.3 Multifunctional schematic diagram of PB1-F2 protein图3 PB1-F2蛋白多功能示意图
IAV 的聚合酶蛋白PB1 有2 个开放阅读框(open reading frame,ORF),其中第二个ORF编码辅助蛋白——PB1-F2蛋白[20]的羧基端可以结合在线粒体内膜上,产生多种先天免疫逃逸机制(图3):a. PB1-F2 蛋白与MAVS 结合使线粒体膜电位(mitochondrial membrane potential,MMP)坍塌,抑制RIG-I-TRIM25介导的抗病毒信号通路,降低I型干扰素的转录[21];b. 在某些情况下核点蛋白NDP52 (nuclear dot protein 52, NDP52) 与PB1-F2 蛋白的结合力强于MAVS,在感染的早期可以负向影响TBK1 诱导的信号通路(IRF3/IRF7激活),I 型干扰素生成受阻[22],感染后期MAVS不再被降解并保持活性,积累的MAVS 可以激活NF-κB信号通路,加剧I型干扰素的产生[23];c.PB1-F2 蛋白通过与线粒体膜腺嘌呤核苷酸转运蛋白3 (adenine nucleotide translocator 3,ANT3)和电压依赖性阴离子通道蛋白1(voltage dependent anion channel 1,VDAC1)结合[24],破坏线粒体完整性,释放细胞色素C(cytochrome C,Cyto C),加快对感染细胞的促凋亡作用[25],增强病毒粒子的释放;d. PB1-F2 蛋白可以作为自噬受体通过Tom40 通道进入线粒体内膜间隙,使得MMP 下降[26],同时与线粒体蛋白TUFM 及LC3B 相互作用,诱导线粒体自噬从而加速MAVS 降解,抑制I型干扰素的产生[27];e. H7N9 亚型禽流感病毒PB1-F2 蛋白增加线粒体活性氧(reactive oxygen species,ROS)和Ca2+的外流激活NLRP3 炎性小体,造成IL-1β 产生过多处于失衡状态,细胞因子风暴加强了IAV 感染对宿主的损伤[28],而且PB1-F2 的缺失会导致IL-6、IL-1β 和IL-8 的表达显著增加[29]。因此,PB1-F2 蛋白可以在多种信号水平上调节天然免疫反应,研究PB1-F2 蛋白的天然免疫逃逸机制可为IAV的预防和控制提供新的线索和策略。
2.2 NS1蛋白
Isaacs 等[30]第一次发现了IAV 的“反向干扰”现象,而这种“反向干扰素”就是IAV NS1 蛋白。NS1蛋白是IAV非常重要的多功能先天免疫反应调节蛋白,其氨基端有一个RNA 结合功能域(RNA binding domain,RBD),羧基端有一个效应功能域(effect domain,ED),可以通过多靶点多方式同时在细胞核和细胞质中影响宿主的先天性免疫反应(图4)。

Fig.4 Multifunctional schematic diagram of NS1 protein图4 NS1蛋白多功能示意图
首先,泛素化是激活RIG-I 通路的必要条件。例如H5N1亚型猪流感病毒ED功能域EALQR基序天然缺失,EALQR 基序对于NS1 维持稳定的二聚体和与RIG-I竞争结合dsRNA至关重要。该基序的缺失使得NS1蛋白不能阻断TRIM25寡聚化和泛素化,进一步削弱了对TRIM25 介导的RIG-I 泛素化的抑制作用,从而减弱了RIG-I信号通路中对干扰素的抑制作用[31]。但B 型流感病毒的NS1 蛋白不能与RIG-I 相互作用,并且其RBD 功能域与TRIM25的相互作用阻断了ED功能域对RIG-I泛素化的抑制作用[32]。其他RIG-I介导的负责病毒识别的因子也会受到NS1蛋白的抑制,如ATF-2/c-Jun、IRF3 和NF-κB 等的激活和易位。所以通过抑制RIG-I 的泛素化从而促进病毒的复制,是流感病毒进行免疫逃逸的一种新机制。NS1 蛋白与NLRP3炎性小体结合可以损害含有Caspase-1 募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like containing a caspase-recruitment domain,ASC)的形成及泛素化,负面影响IL-1β 和IL-18水平,为病毒免疫逃逸另一个策略[33-34]。NS1蛋白与磷脂酰肌醇3-激酶(phosphatidylin-ositol-3-kinase,PI3K)的p85β 亚基相互作用[35],PI3K 的激活对于病毒的有效复制非常重要,增加了流感病毒内化速率、抑制细胞凋亡[36]。
其次,NS1 蛋白对宿主细胞核内mRNA 的转录、加工和运输过程有抑制作用。这种抑制作用可通过3 种方式完成:a.感染早期,30-ku 亚单位腺苷酸化特异因子(cleavage and polyadenylation specificity factor 30,CPSF30)和聚合A结合蛋白II(poly A binding protein II,PABII)[37-38]可以阻断pre-mRNA的加工和mRNA的核输出,导致宿主基因表达的普遍抑制[39]。进化后的马流感病毒(equine influenza virus,EIV)NS1蛋白还可以干扰JAK/STAT通道,特异性阻断ISG的诱导[40];b.作为干扰素诱导的一种核孔蛋白,Nup98可与mRNA输出因子对接,导致mRNA 出核障碍,允许IAV的高度复制[41];c.H3N2亚型人流感病毒的NS1蛋白含有一种独特的ARSK 尾序列,可与人PAF1转录延伸复合物 (human PAF1 transcription elongation complex,hPAF1C)结合,因为hPAF1C是抗病毒反应的关键介质,所以导致其转录延伸受阻[42]。
不仅如此,NS1蛋白也可以阻碍干扰素诱导基因(IFN-induced genes,ISGs)的表达。由于RBD功能域与 2'-5' 寡腺苷酸合成酶(2'-5'oligoadenylate synthetase,OAS)的相互作用胜于与dsRNA 的相互作用,可以通过抑制OAS/RNase L 的活性来保护病毒RNA 不被降解[43]。NS1 蛋白结合蛋白激酶R(protein kinase R,PKR),导致PKR 活性降低,阻断eIF2α 磷酸化[44],抑制宿主抗病毒的状态。此外,NS1 能与eIF4F 的大亚基真核启动因子4GI (eukaryotic translation initiation factor 4GI,eIF4GI) 结合,优先增强流感病毒mRNA 的翻译[45]。核因子90 蛋白(nuclear factor 90-protein,NF90)的抗病毒活性是通过调节NS1蛋白对PKR 磷酸化的抑制作用和感染细胞中应急颗粒的形成而实现的[46]。H3N2亚型猪流感病毒的NS1 蛋白ED 功能域可以与干扰素诱导蛋白35(interferon inducible protein 35,IFI35)高效结合,使RIG-I 免受IFI35 介导的K48 连接泛素化,但在H7N9亚型禽流感病毒中IFI35发挥了相反作用[47]。总体来讲,在IAV的天然免疫逃避策略中,NS1蛋白所扮演的角色非常重要,是作用靶点和作用方式最多的干扰素拮抗蛋白,其不仅可以拮抗干扰素和细胞因子通路,还参与病毒复制的各个过程。
2.3 聚合酶复合体
在IAV聚合酶复合体中,PB2蛋白是IAV致病的主要决定因素之一[48],其可定位于线粒体中。TRIM35是TRAF3的调节因子,虽然IAV PB2蛋白可抑制TRAF3 的K63 泛素化连接,但TRIM35 可直接介导K48泛素化连接并降解IAV PB2蛋白,激活RIG-I抗病毒信号保护宿主免受IAV感染[49]。但不同亚型IAV的PB2蛋白与线粒体的结合能力有所差异,特别是禽流感病毒的PB2蛋白定位于非线粒体[50]。PB2 蛋白与PB1-F2 作用机制相似,不同的是PB1-F2 在通过MMP 和/或TUFM 与MAVS 互作抑制干扰素启动子激活的同时,还可以增强PB1和PB2蛋白的干扰素拮抗功能[21]。
IAV 的PB1、PA 和NP 蛋白也具有干扰素拮抗功能。PB1 和NP 蛋白分别可以与TRIM32、TRIM22 结合降低聚合酶活性[51-52]。已有研究表明,宿主DDX21 RNA解旋酶是通过结合PB1蛋白和阻碍聚合酶的组装抑制病毒蛋白质的合成[53];而且NS1蛋白的RBD功能域与DDX21相互作用也可调控病毒基因的表达[54]。PA蛋白氨基端具有核酸内切酶活性,可以通过阻断IRF3 的磷酸化和二聚化,导致IRF3 在细胞质中积累,抑制干扰素β的产生[55]。作为一种干扰素诱导基因,抗黏病毒蛋白A(myxovirus resistant protein A,MxA)可以和PB2、NP 蛋白结合抑制病毒的转录[56-57]。但是H7N9亚型的NP蛋白却是RIG-I受体介导的阳性调节蛋白,上调I型干扰素的产生,可使病毒复制能力减弱[58]。
2.4 病毒编码的其他蛋白质
在流感病毒编码的多种蛋白质中,其余的蛋白质是否也参与以及通过怎样的方式进行天然免疫逃逸还需进一步探索。
PA-X 蛋白作为一种辅助蛋白,可以利用宿主的RNA Xrn1酶降解宿主细胞核内的转录子,促进病毒的复制[59-60],但具体机制尚且不清楚。PA-X蛋白不仅降解细胞mRNA[61],还可以降解病毒dsRNA 以逃避多种PRRs 的识别[62]。在感染早期,PA-X蛋白还通过RIG-I-MAVS途径防止I型干扰素mRNA 在肺内的积累[63]。作为一种小分子离子跨膜蛋白,M2 蛋白也是一种精密的调节因子:a.可固定在线粒体上,增加细胞质Ca2+水平并产生ORS,导致自噬的激活,从而调控MAVS介导的信号通路[64];b.M2 和NP 蛋白可以通过热休克蛋白40 (heat shock protein 40, hsp40) 蛋 白 促 进p58IPK 蛋白(58 ku inhibitor of PKR,p58IPK)的释放,间接抑制PKR 的活性,促进了病毒粒子的释放[65-66]。内质网应激反应通路可以识别感染细胞中高效表达的HA 蛋白,从而触发先天性免疫应答。内质网相关蛋白降解(endoplasmic-reticulumassociated protein degradation, ERAD) 通 路 因EDEM1、EDEM2和ERManI这3种I型α-甘露糖苷酶的重要参与使得HA蛋白发生降解[67]。
众所周知,线粒体自噬也参与IAV 的复制过程,但具体的机制迄今不是十分清楚。NP 和M2蛋白可上调HSP90AA1 的表达,HSP90AA1 通过AKT-mTOR 信号通路调控NP 和M2 蛋白介导的自噬,自噬加速病毒聚合酶活性,导致病毒RNA 合成和vRNP核输出增加,进而导致病毒蛋白积累和病毒子代产量的上调[68]。
3 展 望
本文针对流感病毒先天免疫反应和天然免疫逃逸的策略进行了详细的论述。众所周知,宿主的天然免疫对抗IAV的早期感染是由一个多层面相互协调的复杂过程完成的。IAV之所以难以防控,就是因为在免疫压力之下,可以利用自身编码蛋白和非编码蛋白产生对宿主天然免疫系统的各种逃逸策略,平衡自身的生存和宿主的抗病毒反应。本文具体阐述了IAV 的PB1-F2、NS1、PA-X 等蛋白质在抗病毒先天免疫反应中起负调控的关键机制,但是IAV的聚合酶蛋白及其他蛋白质是如何调控先天信号通路的,目前还不完全清楚,还有很多机制有待进一步解析,也意味着这将是未来一个有趣的研究方向和探索目标。由于病毒的迅速进化和逃逸,新亚型病毒及耐药株的出现使得疫苗和药物的有效性受到了极大限制。因此,需要利用现有知识和技术增强宿主的天然免疫,实时监测进化的IAV来控制这种疾病。这也助于发现预防和治疗新靶点,设计和研发高效、科学防控流感病毒的药物和疫苗。

