精神分裂症断裂基因1启动子的高甲基化增加阿尔茨海默病的发病风险*
鲍荣荣 陈韦华 王 欣 许春双 牛艳芳 王 芳 楼 琼宋 飞 朱斌斌 王钦文* 徐淑君1,***
(1)宁波大学医学院,浙江省病理生理学重点实验室,宁波315211;2)宁波大学医学院附属医院神经内科,宁波315020;3)宁波医疗中心李惠利医院神经内科,宁波315000;4)浙江医药高等专科学校,宁波315000;5)宁波大学医学院附属医院麻醉科,宁波315020)
阿尔茨海默病(Alzheimer’s disease,AD)是一种进行性的神经退行性疾病,临床上主要表现为渐进性的认知功能减退、学习记忆能力下降和精神行为异常,在老年人群中AD发病率占各类痴呆的60%以上[1],并且随着平均寿命的增加,AD的发病率也会急速上升[2]。
AD 是一个受环境和基因影响的复杂疾病,其中70%AD 发生的风险因素是由于遗传改变引起的[3]。AD主要的致病蛋白β淀粉样蛋白(amyloid beta,Aβ)是由40 或42 个氨基酸构成的短肽,是淀粉样前体蛋白(amyloid precursor protein,APP)的水解产物[4]。APP是一种跨膜蛋白,在细胞生理功能的调节中起重要作用,它参与突触发生和突触可塑性[5]。APP在体内的裂解存在两种途径:一种是α 分泌酶在Aβ 结构域内切割,产生具有神经营养功能和神经保护作用的APP 片段,称为非淀粉样肽源途径(non-amyloidogenic)[6];另一种是β位 点 剪 切 酶(β-site APP cleaving enzyme 1,BACE1)和γ 剪切酶在Aβ 结构域的两端切割,产生Aβ片段,称为淀粉样肽源途径(amyloidogenic)[7]。大量研究都表明,BACE1基因删除或表达抑制后,Aβ 生成显著减少[8]。因此,BACE1的调节在AD发生发展中起着重要的作用。
精神分裂症断裂基因1 (disrupted-inschizophrenia-1,DISC1)位于1号染色体,最初发现于一个精神疾病高发的苏格兰家族[9]。DISC1的基因突变与精神分裂症、双向情感障碍、重度抑郁症等精神疾病的发病有着密切联系[10]。最近的全基因组关联性分析发现,DISC1的一个单核苷酸多态性(SNP1q42,rs6675281)与AD的发病有显著相关性[11]。在皮质发育过程中,DISC1和APP的结合在神经元迁移中起关键作用,增加DISC1的表达挽救了由APP 表达缺失引起的迁移缺陷[12]。在8 月龄APP/PS1AD 转基因鼠中,DISC1的表达下降,增加DISC1的表达会促进BACE 1往溶酶体的转运,从而导致BACE 1在溶酶体的降解[13]。据此,可以推断DISC1和AD 的发病有着显著相关性。
表观遗传学是连接环境与遗传基因变化的桥梁,DNA 甲基化是一种经典表观修饰,参与多种疾病的发生,包括糖尿病、精神分裂症、AD等[14]。然而目前有关人体血液样本中DISC1的甲基化修饰与AD的相关性尚不清楚。本研究采用亚硫酸氢盐转化后焦磷酸测序分析的方法,检测了中国汉族51 例AD 患者和63 例健康对照者DISC1的甲基化水平,分析其与AD发生的关系。
1 材料与方法
1.1 血液样本收集
本研究收集了来自宁波第一医院和宁波康宁医院的散发性AD患者51例(男性27人,女性24人)和与AD组性别、年龄相匹配的正常对照63例(男性39人,女性24人)。散发性AD患者由两位有经验的神经内科临床医生(CZ 和ZQ)根据ICD-10、国家神经和交流障碍及中风-阿尔茨海默病的相关疾病协会标准诊断,结合患者的病史和家族史、神经系统检查、血液研究、脑成像研究、神经心理测试和认知筛查测试等方法进行判定。所有的对照人群都没有任何类型的身体或精神障碍。所有参与者为居住在宁波市的汉族人。本研究经宁波大学伦理委员会审核批准。所有参与者或其监护人均已签署知情同意书。
1.2 生化因子检测
分别采用双缩脲法和溴甲酚绿法测定血清总蛋白(total protein,TP)和白蛋白(albumin,ALB)浓度,球蛋白(globulin,GLB)计算为TP 减去ALB。采用速率法测定谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)的含量。使用循环酶法测定总胆汁酸(total bile acid,TBA)和同型半胱氨酸(homocysteine,Hcy) 的水平。采用酶法测糖(glucose,Glu)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、肌酐(creatinine,CRE)和尿酸(uric acid,UA)含量。使用一步检测法测定高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平。通过比浊法测量载脂蛋白A(apolipoprotein A,ApoA)和载脂蛋白B(apolipoprotein B,ApoB)含量。分别采用终点法和胶乳凝集法检测血清脂蛋白a(lipoprotein A,Lp(a))和C 反应蛋白(C-reactive protein,CRP)浓度。使用免疫比浊法检测载脂蛋白E(apolipoproten E,ApoE)水平。
1.3 亚硫酸氢盐转化后焦磷酸测序分析
用核酸提取分析仪(Lab-Aid 820,厦门,中国) 根据操作规程从外周血提取DNA。使用Nanodrop 1000测定DNA浓度和纯度。通过亚硫酸氢 钠DNA 转 化 化 学(EpiTech Bisulfite Kits;Qiagen) 和 聚 合 酶 链 式 反 应(PCR) 扩 增(Pyromark PCR试剂盒;Qiagen)制备DNA。为检测DISC1甲基化水平,使用Pyromark Q24 仪器进行焦磷酸测序分析。用于甲基化定量的PCR 正向引 物:5'-GGGGATTTAGAGAGGTTGTAAAG-3'、反向引物:5'-生物素-CCTAAACTACCTCCTACTCCT-3'和 测 序 引 物:5'-GTTAATGTTGGAAAGGAAAT-3'。
1.4 统计分析
采用SPSS 软件16.0进行统计学分析,采用两独立样本t检验或Mann-Whitney U秩和检验来确定AD病例和对照之间基线数据的差异。通过Pearson或Spearman 相关性检验评估DISC1甲基化与代谢特征之间的关联(P<0.05 被认为具有统计学意义)。
2 结 果
2.1 DISC1启动子的CpG岛区甲基化分析
对DISC1启 动 子 的CpG 岛 区 (chr1:231 762 415~231 763 115) 进 行 焦 磷 酸 测 序(图1),共测量2 个CpG 位点,发现2 个CpG 位点的甲基化水平之间存在显著相关性(r>0.671,P<0.001,表1),因此在随后的分析中进一步测量了2种CpG的平均DNA甲基化。

Fig.1 Correlations among seven promoter CpG sites of DISC1

Table 1 Comparisons of DISC1 methylation levels between cases and controls
2.2 生化因子与AD之间的关联分析
本研究共纳入51 名AD 患者和63 名对照。在19 个临床特征中(表2),AD 组中ALB、Lp(a)和Hcy 水平均高于对照组(P=0.04,P=0.000 4,P=0.01);AD 组ALT、HDL-C 和CRP 水平低于对照组(P=0.04,P=0.000 4,P=0.02)。通过Logistic回归分析进一步证实Lp(a)升高增加AD 的风 险(OR(95% CI)=19.72 (2.072, 187.693),P=0.009,表3)。
2.3 DISC1甲基化与AD 的相关性分析
本研究结果表明,DISC1的两个CpG 位点在AD 组均能观察到显著的甲基化水平升高(P=0.000 7;P=2.27E-6,表1)。通过ROC 曲线用来评估诊断能力[15],DISC1启动子甲基化的曲线下面积(ACU) 为0.726 (95% CI:0.626~0.827),灵敏度和特异度分别为0.569和0.869(图2)。这些结果表明,DISC1启动子高甲基化可能是AD 潜在的生物标志物。运用Logistic 回归分析评估AD 的风险,结果显示,DISC1启动子高甲基化增加了AD 的风险(OR(95% CI)=2.403(1.117,5.171),P=0.025,表3)。随后进一步分析DISC1启动子甲基化与患者生化指标之间的相关性(图3),女性患者中ApoA(r=0.490,P=0.003)与DISC1启动子甲基化呈正相关(r=0.431,P=0.010);男性患者中Lp(a)与DISC1启动子甲基化呈正相关(r=0.538,P=1.14E-4)。
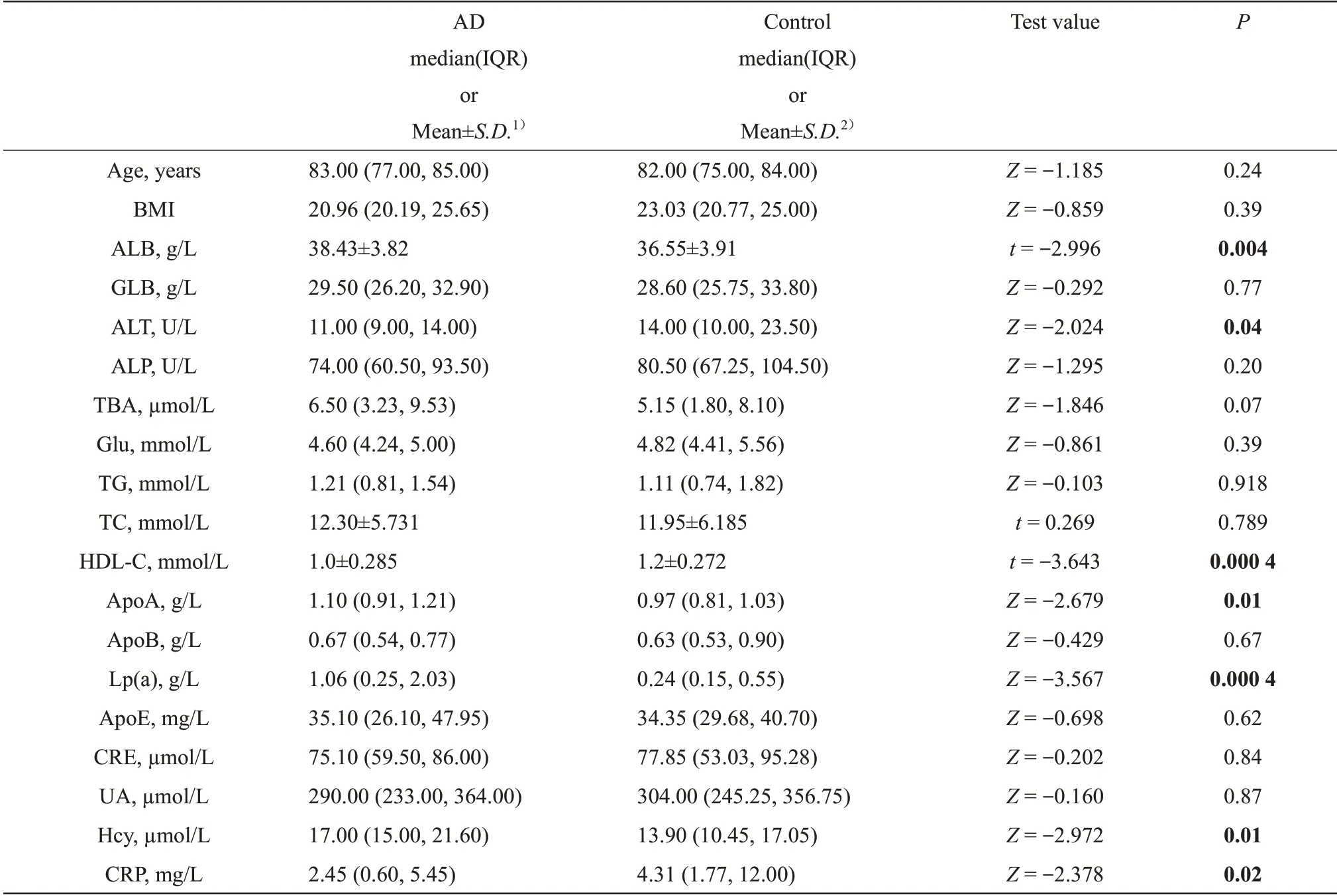
Table 2 Characteristics of subjects from cases and controls

Table 3 Logistic regression analysis of the risk of AD

Fig.2 The receiver operating characteristic(ROC)curve analysis of AD

Fig.3 Correlations between biochemical parameters of samples and DISC1 promoter methylation level
3 讨 论
本研究分析了AD患者和对照组DISC1的启动子甲基化水平,以阐明DISC1的启动子甲基化与AD 的关联性,结果显示AD 组的甲基化水平显著高于对照组。AD的ROC曲线也表明DISC1的启动子高甲基化可以作为AD的潜在生物标志物。相关分析显示,ApoA 与DISC1的启动子甲基化在女性病例中呈正相关;Lp(a)与DISC1的启动子甲基化在男性病例中呈正相关。
外周血样本方便易得,且甲基化水平与脑组织甲基化水平具有良好的一致[16-17]。本研究表明,AD 组的DISC1启动子甲基化程度显著高于对照组,DISC1启动子的高甲基化可能会降低DISC1的表达,进而导致AD 发生。以往的研究表明,在8月龄APP/PS1AD 转基因鼠中,DISC1的表达下降[13],本研究结果提示在AD 病人中也存在类似的改变。DISC1 降低参与AD 的可能机制是,DISC1 下降使BACE1 往溶酶体的转运降低,从而导致BACE 1在溶酶体的降解减少[13]。DISC1含有LC3 的结合位点,DISC1 有助于促进Aβ 引起的受损线粒体自噬,而DISC1 降低,使线粒体自噬过程受阻,从而引起突触可塑性损伤和AD认知功能障碍[18]。
本研究检测了19个生化与AD的关联性,发现AD 组中ALB、Lp(a)和Hcy 水平均高于对照组。AD组ALT、HDL-C和CRP水平低于对照组。血浆Hcy 水平的增加被认为是AD 的危险因素,并且最近的研究已经证明Hcy浓度的增加能增加总Tau和磷酸化Tau,并形成Tau 寡聚体,从而增加AD 风险[19]。之前的研究也证实了中度AD 患者血浆CRP 水平的降低[20]。此外,较低的CRP 水平与较快的认知衰退相关[21]。
为了找出DISC1启动子甲基化与生化指标之间的关联,本研究还进行了相关分析。结果显示,ApoA 水平与女性DISC1启动子甲基化有关,Lp(a)水平与男性DISC1启动子甲基化有关。ApoA有转运胆固醇和调节炎症的作用,并且影响Aβ 聚集和沉积[22],因此ApoA 也被视为神经退行性疾病潜在的诊断标志物[23];临床研究结果证实,Lp(a)血清浓度与AD风险呈非线性关系显著相关,可能的原因是Lp(a)血清浓度的升高会增加脑血管疾病的风险从而间接影响AD的发病[24]。
4 结 论
总之,本研究表明,AD 患者DISC1启动子的甲基化水平显著高于对照组,外周血DISC1启动子高甲基化是AD 发生的高风险因素,其可能是AD诊断潜在的生物标志物。

