miRNA在心肌缺血再灌注损伤诊疗中作用的临床研究进展
李宇轩,李冬,燕荣锟,李鹏,崔晓云,逯金金,刘静,吴旸,林谦,李岩
心血管疾病占我国城乡居民总死亡原因的首位,而急性心肌梗死(actue myocardial infarction,AMI)是常见的心血管疾病,且血运重建是其重要治疗方案,虽然全国血运重建率明显提高,但AMI患者1年病死率仍高达28%[1-2]。此外,AMI患者预后较差与心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)密切相关,约50%的AMI患者接受再灌注治疗后会出现MIRI[3]。目前临床对于MIRI尚无有效治疗方法,因此探索如何减轻MIRI对提高血运重建疗效、改善AMI患者预后具有重要意义。miRNA在心血管系统中有众多潜在作用,如参与调控血管内皮细胞生成、心肌细胞收缩、脂质代谢、斑块形成、心率等。本文旨在对miRNA在MIRI诊疗中作用的临床研究进展进行综述,以期为MIRI的临床诊治提供参考。
1 MIRI的发病机制及临床表现
1.1 MIRI的经典发病机制 冠状动脉狭窄或闭塞患者行血运重建时,可能会因多种因素造成MIRI,如血运重建过程中血栓及微小斑块破碎直接堵塞远端微小血管或冠状动脉内皮受损部位的白细胞与血小板聚集物阻塞微小血管,导致心肌细胞或内皮细胞坏死,从而引起MIRI[4];心肌缺血缺氧也可诱发氧化应激与炎症反应,进而损伤心肌组织,并扩大梗死面积,从而导致MIRI[5];血运重建治疗后快速复氧可导致Ca2+稳态失衡和/或细胞内pH值快速变化,引起心肌细胞肌膜破裂,发生细胞凋亡,进而引起MIRI[6];钙超载和pH值快速变化也可引起线粒体通透性转换孔开放,进而释放大量细胞凋亡因子,从而引起MIRI[7],或诱发心肌细胞过度收缩,加剧MIRI程度[8],见图1。
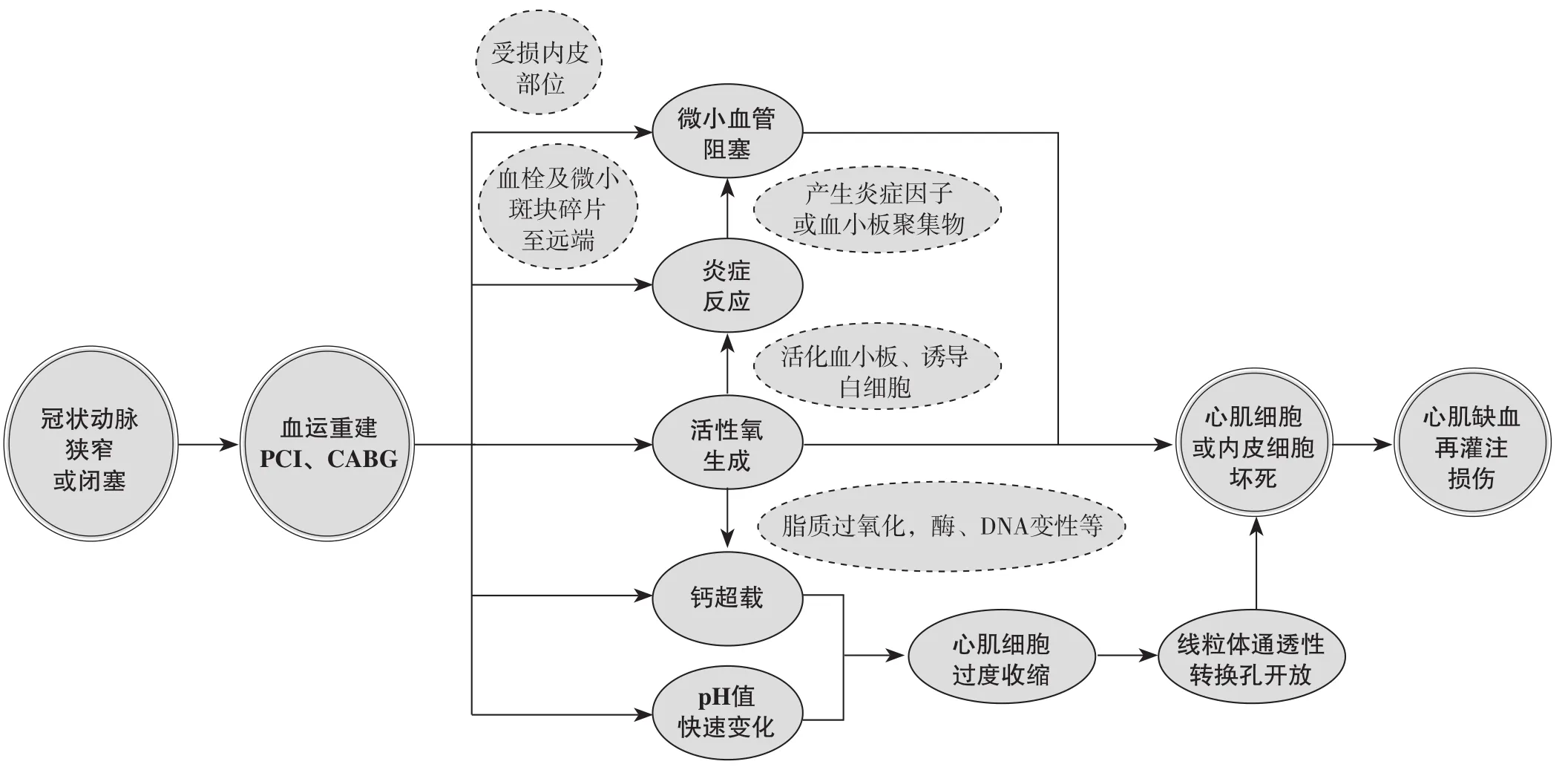
图1 MIRI的发病机制Figure 1 Pathogenesis of MIRI
1.2 MIRI的临床表现 MIRI有多种临床表现,高达80%的AMI患者出现再灌注心律失常,表现为心房颤动、室性心动过速等,当其血流动力学稳定被破坏时需紧急转复[9]。急性MIRI可致心肌顿抑,但心肌顿抑多不影响血流动力学,可于再灌注后1周内恢复[10]。MIRI所致微血管阻塞(microvascular obstruction,MVO)可致无复流现象,甚至出现梗死面积扩大和心室重构(ventricular remodeling,VR)、射血分数下降等[11],而目前尚无有效手段防治MIRI后MVO。严重MIRI诱发心肌梗死被称为致死性MIRI,是MIRI重要的临床表现。研究显示,治疗性干预MIRI可缩小心肌梗死面积40%~50%,间接证明MIRI可导致心肌梗死面积扩大[12]。此外,MIRI所致心肌梗死后VR可严重影响再灌注治疗效果[3]。
2 miRNA的结构与作用
miRNA是内源性、稳定的单链非编码RNA,大多来源于血细胞,其可通过包裹在微粒中或与蛋白质或高密度脂蛋白结合的方法来避免被降解,在调控基因表达及表观遗传学方面有重要作用。miRNA与靶mRNA之间的互补碱基配对可影响多个基因的表达,因此单个基因可以受到许多miRNA的调控[13]。
miRNA在心血管疾病的发生发展中发挥多种作用,其可调控MIRI后的心肌细胞,降低心肌组织和血清中炎症因子水平,进而调控MIRI后的炎症反应,从而缩小心肌梗死面积[14]。miRNA抑制心肌细胞凋亡、调控心肌细胞存活及重塑是其改善心功能的关键环节[15],其介入心肌细胞的途径可能是通过血小板释放出的囊泡和外泌体转移至心肌细胞而发挥作用,或通过配体-受体信号传导或其他递质介导[16]。
3 miRNA在MIRI中作用的临床研究进展
研究表明,在再灌注心律失常、心肌顿抑、无复流、致死性MIRI及VR等MIRI的各种临床表现中,miRNA可通过多种机制参与MIRI以调控其病理生理过程[14-16]。
3.1 miRNA与MIRI患者炎症反应的关系 WANG等[17]发现,miR-126与PCI诱导产生的hs-CRP和血管内皮细胞黏附分子1呈负相关。研究显示,术前接受高剂量瑞舒伐他汀可能通过抑制miR-155/SHIP-1信号通路来降低炎症标志物水平,从而有效降低急性冠脉综合征(acute coronary syndrome,ACS)患者PCI后不良心血管事件发生率[18]。WANG等[19]研究发现,CABG引起的MIRI及炎症反应与miR-1、miR-133a和miR-208a有关,其中miR-208a是唯一与CK-MB、cTnT和IL-6相关的指标,能反映MIRI患者心肌损伤和炎症反应情况。有报道显示,miR-146a和miR-21可参与炎症反应[20]。而AMI患者血运重建治疗后的炎症反应是引发MIRI的经典机制之一,可能导致心肌损伤或VR等,与不良心血管事件有关。LIU等[21]研究报道,miR-146a和miR-21可能是预测AMI患者再灌注治疗后发生VR的新型生物标志物,且ROC曲线分析结果显示,二者联合比单独预测VR的价值高。上述研究提示,多种miRNA作为中间环节或生物标志物来参与MIRI患者的炎症反应,与众多炎症反应标志物具有相关性,进一步提示miRNA具有作为重要生物标志物的潜力,但其确切机制还需进一步研究。
3.2 miRNA与MIRI患者血小板的关系 miRNA大部分来源于血细胞,可以在血小板等血细胞中稳定存在,并且血小板可分泌大量双向调节MIRI的因子,这使众多研究者探索miRNA与MIRI患者血小板间的关系。ZAMPETAKI等[22]研究发现,AMI患者的miR-126、miR-197、miR-223水平会随着AMI病情进展而变化,与预后密切相关;而上述miRNA在血小板及其衍生微粒中呈高表达,提示miRNA可能与炎症细胞破坏血小板、清除血小板衍生微粒有关[23]。研究显示,血小板中含有miRNA的外泌体,也可参与调控血管内皮损伤[24]。综上,笔者认为,miRNA可稳定存在于MIRI患者的血小板中,其由血小板外泌体释放,并可能通过调节内皮细胞损伤来参与MIRI的发生发展,同时炎症反应导致MIRI的过程中可能伴随血小板的破坏,导致miRNA发生动态变化。
3.3 miRNA与MIRI相关血管内皮功能障碍的关系 血管内皮细胞有抗白细胞黏附、血小板聚集及抗炎、维持血管张力等作用,而MIRI可通过多种途径诱发血管内皮功能障碍,如使活性氧(reactive oxygen species,ROS)过量产生进而引起氧化应激、使pH值快速变化、抑制内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和NO的分泌等[25]。研究表明,在缺氧条件下,抑制miR-24-3p介导的抗血管生成作用可以修复血管内皮损伤[26]。也有临床研究发现,miR-138可靶向调节S100A1基因,是参与缺氧诱导的血管内皮功能障碍的关键影响因子[27]。GENG等[28]研究AMI患者血浆外泌体时发现,外泌体中miR-143水平明显降低,其可通过靶向胰岛素样生长因子1受体和增加NO水平来促进血管内皮细胞再生。目前临床可通过外源性NO供体定量释放NO,以减轻血管内皮功能障碍、防治MIRI,但其作用依赖于NO浓度、生物利用度,故风险和收益比需进一步评估[29]。而有研究表明,外泌体miR-126可调控氧化应激状态下人内皮细胞中ROS水平,激活PI3K/eNOS信号通路,减轻人内皮细胞损伤,这提示内皮细胞特异性miRNA可通过调控氧化应激来减轻内皮细胞损伤,进而防治MIRI,这可能是提高MIRI患者心脏手术效果的突破点[30-31]。血管内皮功能障碍与MIRI直接相关,miRNA可通过调控MIRI患者NO等关键因子的水平来改善其血管内皮功能,或通过调控氧化应激水平来促进血管内皮细胞再生,进而减轻MIRI程度。
3.4 miRNA与MIRI患者心肌损伤程度的关系 SU等[32]发现,曲美他嗪可通过增加CD4+T淋巴细胞中miR-21水平来抑制炎症反应,进而降低PCI后围术期心肌损伤发生率。EITEL等[33]检测PCI后患者miR-133a水平,并评估其与心肌损伤程度间的相关性,结果发现miR-133a水平升高的PCI后患者心肌损伤程度加重,且心血管事件发生风险明显增加。GRABMAIER等[34]评估AMI患者PCI后梗死面积并分析其与miR-1、miR-29b水平的关系,结果显示,miR-1、miR-29b水平与梗死面积呈负相关,miR-29b水平与左心室舒张末期容积呈负相关。COELHO-LIMA等[35]研究了AMI患者PCI后miRNA表达水平与MVO程度的关系,结果显示,PCI后3 h内miR-1、miR-133b水平升高与MVO程度和PCI后左心室功能呈负相关。上述临床研究提示,miRNA与MIRI患者心肌损伤程度密切相关,可通过miRNA水平预测心肌损伤程度。未来临床研究中,miRNA可能作为新型生物标志物在MIRI诊断、预后的评估中发挥作用。
3.5 miRNA与MIRI患者心肌细胞的关系 ZILE等[36]发现,部分AMI患者的循环miR-1、miR-15a、miR-208a水平与VR有关,心肌梗死早期其水平快速升高,并伴随着左心室舒张末期容积增加。NO可调控平滑肌细胞、内皮细胞和血细胞,阻止血管平滑肌细胞迁移和增殖,减少内膜新生,保护血管内皮,若内皮损伤导致局部NO生成不足则可能出现动脉粥样硬化、再狭窄或MIRI[37]。LI等[38]研究发现,缺氧的心肌细胞可释放外泌体进入冠状动脉血液循环,而外泌体中的miR-939-5p可促进内皮细胞产生NO,在心肌缺血患者血管内皮新生中扮演重要角色。D'ALESSANDRA等[39]研究发现,AMI患者血浆miR-133a可作为AMI、MIRI的标志物;基础研究也提出,miR-133可抑制心肌肥厚相关基因表达[40]。综上,miRNA可通过调控NO等因子或相关基因的表达来保护MIRI患者的心肌细胞。
3.6 miRNA与MIRI患者发生VR的关系 AMI患者PCI后出现新的节段性运动异常属于MIRI范畴,而原有室壁节段运动异常结合新发节段性运动异常,常会导致梗死后VR。研究显示,VR普遍存在于AMI患者中,且与心源性死亡和心力衰竭的发生风险增加有关[41]。研究表明,miR-208b、miR-34a、miR-146a、miR-21可预测AMI患者VR发生风险[42]。MA等[43]研究发现,AMI患者入院时miR-1水平是6个月后其发生VR的独立预测因子,临床症状结合心肌梗死面积及miR-1水平对VR有更好的预测效果。GRABMAIER等[34]观察AMI患者PCI后血浆miR-1、miR-29b水平发现,其与VR密切相关。但有临床试验发现,PCI后数小时miR-320a水平快速升高,且1个月内miR-320a水平降低与VR有关,认为miR-320a可作为VR的生物标志物[44]。也有研究发现,AMI患者入院后血浆miR-1254水平并不能准确预测其6个月后VR发生风险[45]。因此关于miRNA与MIRI患者发生VR的关系还需进一步研究证实。
3.7 miRNA与MIRI患者发生心血管事件的关系 MIRI患者发生心血管事件的风险较高,可用miRNA预测该风险。JAKOB等[46]研究发现,miR-26b-5p、miR-320a、miR-660-5p与GRACE评分和临床模型相结合,可预测AMI患者心血管事件发生风险。CORTEZ-DIAS等[47]发现,miR-122-5p/miR-133b比值是一种新的预后生物标志物,可用于早期识别PCI后发生严重不良事件发生风险高的AMI患者,miR-122-5p/miR-133b比值越高,MIRI发生风险越大。JANSEN等[48]也发现,外泌体中的miRNA表达水平可评估冠心病患者的预后,有助于冠心病患者不良心血管事件的风险分层。综上,miRNA可预测MIRI患者心血管事件的发生风险,而结合已有的风险预测评分可能预测效果更好,值得进一步研究。
4 中医药通过调控miRNA治疗MIRI的相关研究、挑战与前景
4.1 中医药通过调控miRNA治疗MIRI的相关研究 中医学理论认为,MIRI属于“胸痹”范畴。MIRI的中医病机包括气虚、血瘀、痰饮等[49]。有学者发现,通冠胶囊治疗冠心病的有效性与miR-320c、miR-17-5p有关,认为上述miRNA可作为冠心病气虚血瘀证的生物标志物[50]。有研究发现,miR-222-3p、miR-198能协助判别ACS患者血瘀轻、重证[51]。朱敬伟等[52]研究发现,AMI患者入院早期miR-223-3p呈高表达、miR-132-5p呈低表达,且益气活血中药联合常规西药治疗AMI的效果较好,可能与其可调节miR-223-3p、miR-132-5p的表达有关。WU等[53]采用临床研究结合基础研究来探索中医药治疗MIRI的机制,结果发现,黄芪甲苷可通过调控miR-101a来减轻H2C9心肌细胞的MIRI。基础研究发现,通心络胶囊可通过miRNA抑制心肌细胞凋亡并减轻MIRI严重程度[54]。一项Meta分析结果也显示,通心络胶囊可通过miRNA改善AMI患者预后,降低心血管不良事件、再发心肌梗死的发生率[55]。有研究发现,血栓通的主要成分——三七总皂苷可通过miRNA降低AMI患者PCI后心肌损伤标志物水平、缩小心肌梗死面积、改善心功能[56]。WANG等[57]发现,三七总皂甙可增加miR-30c-5p表达水平,并保护MIRI大鼠心肌细胞,其可能通过miRNA来治疗MIRI。
4.2 中医药通过调控miRNA治疗MIRI的挑战与前景 首先,目前关于中医药治疗MIRI的临床研究主要关注中医药对患者病情、预后的改善效果,其机制探索的研究相对较少,而明确作用机制是推广中医药面对的挑战之一。为此,应增加中医药机制探索类临床研究,但开展此类研究需要有足够的中医临床经验和基础研究支持。目前已有较多基础研究,因而应该增加相关临床研究,进而推动中医药的发展与推广。
其次,基础研究局限于模型,有别于临床实际情况,因此向临床治疗转化的效果不佳。为此,应增设临床研究以验证基础研究的成果,并逐步转化为临床治疗。笔者认为,此类临床研究在探索、验证药物作用机制时应循序渐进,适当限制样本量和检测指标,分步骤进行。此外,应尽快明确中医药通过调控miRNA来治疗MIRI的具体机制,且需要观察其临床效果。
再者,目前学术界对于中医药临床研究的可信度并不乐观,如何提高中医药临床研究的可信度成为必须面对的问题。笔者认为,应把控临床研究的规范性、科学性、伦理,严格控制试验质量,如确保中药制剂或中药颗粒的质量符合监管标准,未上市的制剂应该严格进行伦理审批。对于获得资助的临床研究应主动接受国内外学者的监督。
5 临床通过miRNA诊治MIRI存在的问题及挑战
目前临床通过miRNA诊治MIRI存在一些问题:其一是MIRI的诊断缺乏特异性指标,缺少相关诊疗指南及专家共识,临床研究标准不统一;其二是基础研究存在局限性,表现为相关基础研究成果在临床中治疗效果不佳,向临床转化存在困难。这可能与MIRI致病机制复杂、病因复杂有关,无法针对性治疗,且基础研究无法充分模仿临床实际,故而存在局限性。笔者认为,可通过探索miRNA参与MIRI发生发展的机制来解决上述问题。首先,miRNA具有作为MIRI生物标志物的潜力,若能找到MIRI的特异性标志物,对于MIRI的诊断有重要意义,也有助于临床诊疗。其次,多数MIRI相关基础研究只是针对某一致病机制,但MIRI可由多种机制共同致病。可结合miRNA多机制、多靶点参与MIRI的特点,研究miRNA在MIRI发生发展中的确切作用机制,这可能对MIRI的诊治有所帮助。
目前临床通过miRNA诊治MIRI也存在一些挑战:目前证实miRNA与MIRI有关的临床研究样本量较小,结果可能存在偏倚,需要扩大临床研究规模以增加可信度。目前已知部分miRNA参与MIRI的病理过程,但暂无以miRNA为靶点精确干预MIRI的临床治疗方法,还需进一步研究。
6 小结及展望
MIRI影响血运重建疗效,不利于AMI患者预后,因此研究MIRI的诊治方法是目前提高血运重建疗效、改善患者预后的重点。目前MIRI相关基础研究较多,但其临床转化效果不佳,这可能与MIRI致病机制复杂有关。miRNA具有可多靶点、多通路干预心血管疾病的特点,在既往诸多学者的基础研究成果支持下,未来应积极通过临床研究探索miRNA在MIRI发生发展中的作用机制。临床研究可克服诸多基础研究的缺点,更贴近临床实际,是MIRI基础研究成果向临床治疗转化的重要中间环节,因此,miRNA在MIRI中作用的临床研究可能是提高MIRI临床诊治效果的突破点。
作者贡献:李宇轩、李岩进行文章的构思与设计、可行性分析;李冬、燕荣锟、李鹏、逯金金进行文献/资料收集、整理;李宇轩撰写论文;李宇轩、崔晓云、刘静进行论文的修订;吴旸、林谦、李岩负责文章的质量控制及审校;李岩对文章整体负责、监督管理。
本文无利益冲突。

