术后辅助化疗对早期非小细胞肺癌患者预后的影响研究
王秋桐,曹婷婷,周玮玮,王明,吴爽,赵瑞,姜俊杰
肺癌是全球死亡率最高的恶性肿瘤,2021年,全美新增189万例肺癌患者,死亡约60万例患者[1],中国肺癌患者死亡率也一直远高于其他肿瘤[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)患者约占肺癌患者总例数的85%,手术切除是其主要治疗策略,而早期NSCLC患者术后的预后情况存在较大差异,仍然有肿瘤复发和转移的风险[3],且NSCLC患者术前也可能因肿瘤细胞微转移导致局部复发和远处转移[4-6]。有研究指出,术后辅助化疗可明显延长ⅡA~ⅢA期NSCLC患者的总生存期(overall survival,OS),但并不能使ⅠA期和ⅠB期NSCLC患者获益[7-8]。《中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)》[9]指出,对于有低分化肿瘤、胸膜浸润等高危因素的ⅠB期NSCLC患者术后不推荐采用辅助化疗;而美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)却指出,对于存在高危因素的ⅠB期NSCLC患者术后推荐采用辅助化疗[10]。此外,PARK等[11]的研究结果显示,术后辅助化疗并不能给早期NSCLC患者带来生存获益;而ZHANG等[12]的研究却指出,ⅠB~ⅡA期NSCLC患者术后接受辅助化疗可明显延长生存期。综上,早期NSCLC患者术后接受辅助化疗的疗效仍存在争议。本研究旨在分析术后辅助化疗对早期NSCLC患者预后的影响,以期为早期NSCLC患者术后是否接受辅助化疗提供参考依据。
1 对象与方法
1.1 研究对象 选取2013—2018年沧州市中心医院肿瘤科收治的早期NSCLC患者1 460例为研究对象。纳入标准:(1)接受楔形切除术、肺段切除术、肺叶切除术、全肺切除术并行淋巴结清扫或采样;(2)采用国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)第八版肺癌TNM分期标准[13],结合病理学和CT检查结果,确诊为早期(ⅠA、ⅠB期)NSCLC患者;(3)年龄>18岁;(4)病历信息、随访记录完整;(5)术后生存时间>1个月;(6)签署知情同意书。排除标准:(1)肿瘤直径>4 cm患者;(2)淋巴上皮癌、腺样囊性癌等不常见癌症类型患者;(3)术后接受辅助化疗以外的其他治疗方式(靶向治疗、放疗、免疫治疗)患者;(4)术前接受辅助放化疗患者;(5)NSCLC不是第一原发肿瘤患者。本研究经沧州市中心医院伦理委员会审核通过。
1.2 临床资料收集 收集患者一般资料,包括年龄、性别、肿瘤分化程度、病变侧别、病理学分型、肿瘤原发位置、手术类型、肿瘤直径、胸膜浸润情况、分期,统计患者术后辅助化疗情况、术后危险因素评分、生存情况、中位生存时间(median survival time,mST)和5年生存率。根据《NCCN 2021版NSCLC指南》[14]提出的NSCLC患者复发高危因素(肿瘤直径>4 cm、肿瘤低分化、神经内分泌肿瘤、脏器胸膜浸润、楔形切除术、血管浸润和淋巴结状态不明),对患者进行术后危险因素评分,1个危险因素记1分,≥2分为复发高危患者。由于本研究不包含肿瘤直径>4 cm的患者,所以这个高危因素已被排除。随访截止时间为2021-12-01,主要通过电话联系或患者来本院进行病理学或影像学复查获取其肿瘤复发和生存情况。生存时间指患者从确诊开始至因肺癌或其并发症死亡或随访截止时间。根据患者接受术后辅助化疗情况,将其分为术后辅助化疗组(251例)和未术后辅助化疗组(1 209例)。由于术后辅助化疗组与未术后辅助化疗组患者例数相差较大,本研究采用倾向性评分匹配来减少基线数据对最终结果的影响,采用邻近匹配算法,比例为1∶1,卡钳值设为0.01,数据完成匹配后变量绝对标准化平均差≤0.01被认为匹配平衡,最终两组均纳入237例患者。根据474例患者预后情况,将其分为死亡组(102例)和存活组(372例)。
1.3 统计学方法 采用SPSS 25.0进行数据分析。计数资料以相对数或绝对数表示,组间比较采用χ2检验;早期NSCLC患者预后影响因素分析采用多因素Cox回归分析;使用Graphpad Prsim软件和Kaplan-Meier法绘制生存曲线,mST比较采用Logrank检验,5年生存率比较采用Z检验。以P<0.05为差异有统计学意义。
2 结果
2.1 死亡组和存活组患者临床资料比较 死亡组和存活组患者年龄、病变侧别、肿瘤原发位置、手术类型、肿瘤直径、胸膜浸润情况、分期、术后辅助化疗情况比较,差异无统计学意义(P>0.05);死亡组和存活组患者性别、肿瘤分化程度、病理学分型、术后危险因素评分比较,差异有统计学意义(P<0.05),见表1。
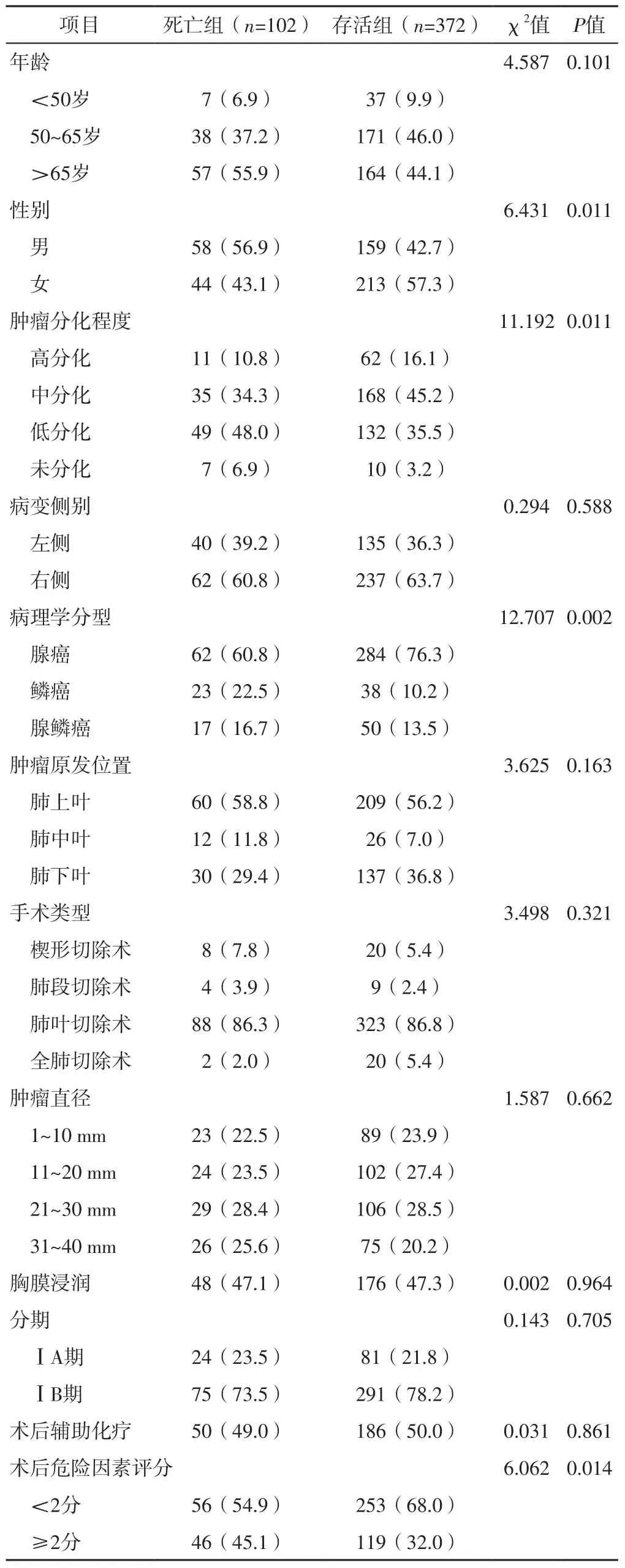
表1 死亡组和存活组患者临床资料比较〔n(%)〕Table 1 Comparison of clinical data between death group and survival group
2.2 早期NSCLC患者预后影响因素的多因素Cox回归分析 以年龄(赋值:<50岁=1,50~65岁=2,>65岁=3)、性别(赋值:男=1,女=2)、肿瘤分化程度(赋值:高分化=1,中分化=2,低分化=3,未分化=4)、病变侧别(赋值:左侧=1,右侧=2)、病理学分型(赋值:腺癌=1,鳞癌=2,腺鳞癌=3)、肿瘤原发位置(赋值:肺上叶=1,肺中叶=2,肺下叶=3)、手术类型(赋值:楔形切除术=1,肺段切除术=2,肺叶切除术=3,全肺切除术=4)、肿瘤直径(赋值:1~10 mm=1,11~20 mm=2,21~30 mm=3,31~40 mm=4)、胸膜浸润情况(赋值:是=1,否=2)、分期(赋值:ⅠA期=1,ⅠB期=2)、术后辅助化疗情况(赋值:是=1,否=2)、术后危险因素评分(赋值:<2分=1,≥2分=2)为自变量,早期NSCLC患者预后为因变量(赋值:死亡=1,存活=0),进行多因素Cox回归分析,结果显示,年龄为>65岁,性别,肿瘤分化程度为中、低分化及术后辅助化疗是早期NSCLC患者预后的独立影响因素(P<0.05),见表2。
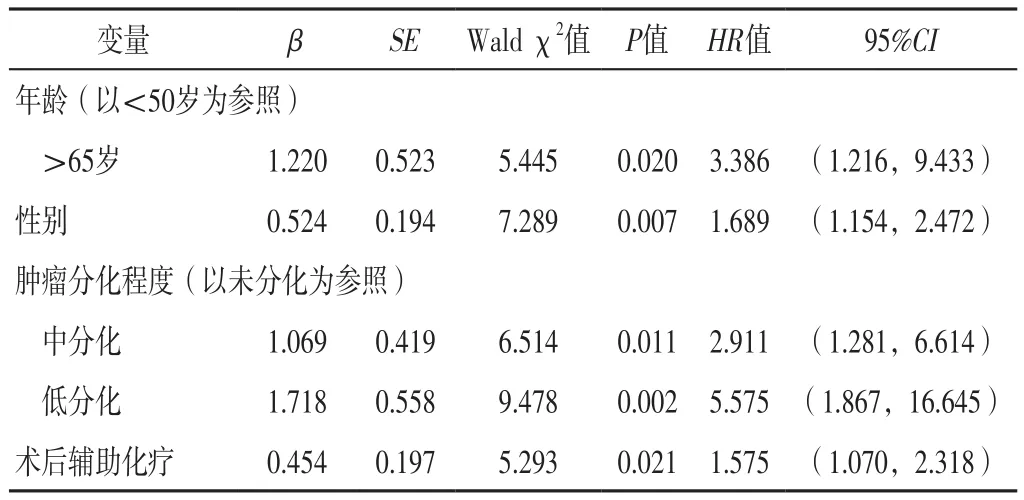
表2 早期NSCLC患者预后影响因素的多因素Cox回归分析Table 2 Multivariate Cox regression analysis of influencing factors of prognosis of patients with early NSCLC
2.3 术后辅助化疗组和未术后辅助化疗组患者临床资料比较术后辅助化疗组和未术后辅助化疗组患者年龄、性别、肿瘤分化程度、病变侧别、病理学分型、肿瘤原发位置、手术类型、肿瘤直径、胸膜浸润情况、分期、术后危险因素评分比较,差异无统计学意义(P>0.05),见表3。
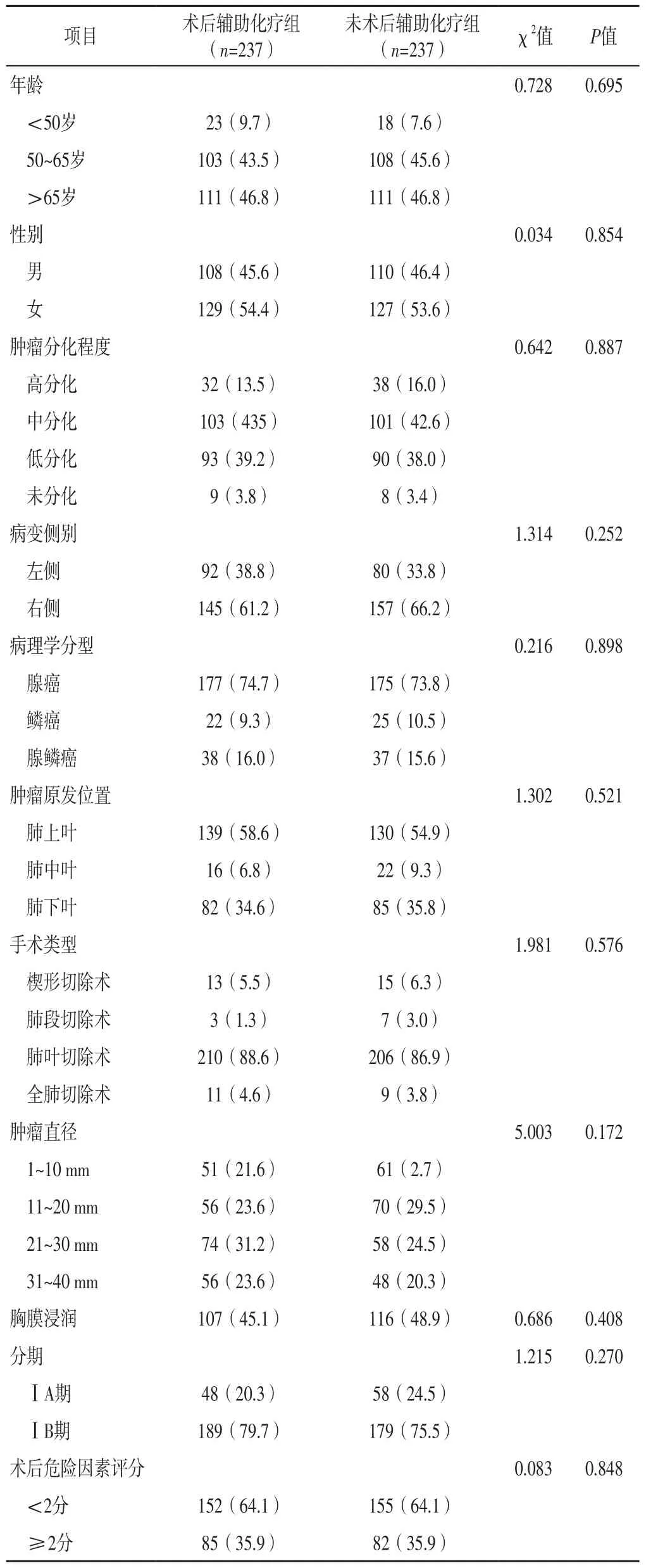
表3 术后辅助化疗组和未术后辅助化疗组患者临床资料比较〔n(%)〕Table 3 Comparison of clinical data between postoperative adjuvant chemotherapy group and non postoperative adjuvant chemotherapy group
2.4 术后辅助化疗组和未术后辅助化疗组患者mST、5年生存率比较 术后辅助化疗组患者mST为85个月,长于未术后辅助化疗组的74个月,差异有统计学意义(χ2=8.828,P=0.003);术后辅助化疗组患者5年生存率为74.3%,与未术后辅助化疗组的66.7%比较,差异无统计学意义(P=0.198),见图1。
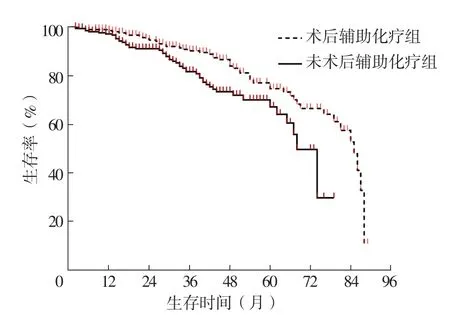
图1 术后辅助化疗组和未术后辅助化疗组患者生存曲线Figure 1 Survival curve of patients in postoperative adjuvant chemotherapy group and non postoperative adjuvant chemotherapy group
2.5 术后辅助化疗组和未术后辅助化疗组不同病理学分型、肿瘤直径、分期、术后危险因素评分患者mST、5年生存率比较
2.5.1 术后辅助化疗组和未术后辅助化疗组不同病理学分型患者mST、5年生存率比较 术后辅助化疗组病理学分型为腺癌患者mST为86个月,长于未术后辅助化疗组的74个月,差异有统计学意义(χ2=7.608,P=0.006)。术后辅助化疗组病理学分型为腺癌患者5年生存率为80.8%,高于未术后辅助化疗组的69.1%,差异有统计学意义(P=0.023),见图2A。
术后辅助化疗组病理学分型为鳞癌患者mST为81个月,与未术后辅助化疗组的68个月比较,差异无统计学意义(χ2=0.974,P=0.324)。术后辅助化疗组病理学分型为鳞癌患者5年生存率为63.6%,与未术后辅助化疗组的76.0%比较,差异无统计学意义(P=0.338),见图2B。
术后辅助化疗组病理学分型为腺鳞癌患者mST为67个月,与未术后辅助化疗组的74个月比较,差异无统计学意义(χ2=0.013,P=0.910)。术后辅助化疗组病理学分型为腺鳞癌患者5年生存率为39.5%,与未术后辅助化疗组的37.8%比较,差异无统计学意义(P=0.387),见图2C。

图2 术后辅助化疗组和未术后辅助化疗组不同病理学分型患者生存曲线Figure 2 Survival curves of patients with different pathological grades in postoperative adjuvant chemotherapy group and non postoperative adjuvant chemotherapy group
2.5.2 术后辅助化疗组和未术后辅助化疗组不同肿瘤直径患者mST、5年生存率比较 术后辅助化疗组肿瘤直径为1~10 mm患者mST为84个月,与未术后辅助化疗组的80个月比较,差异无统计学意义(χ2=0.245,P=0.620)。术后辅助化疗组肿瘤直径为1~10 mm患者5年生存率为68.6%,与未术后辅助化疗组的72.1%比较,差异无统计学意义(P=0.372),见图3A。
术后辅助化疗组肿瘤直径为11~20 mm患者mST为79个月,与未术后辅助化疗组的74个月比较,差异无统计学意义(χ2=1.999,P=0.155)。术后辅助化疗组肿瘤直径为11~20 mm患者5年生存率为83.9%,与未术后辅助化疗组的71.4%比较,差异无统计学意义(P=0.168),见图3B。
术后辅助化疗组肿瘤直径为21~30 mm患者mST为88个月,与未术后辅助化疗组的74个月比较,差异无统计学意义(χ2=2.964,P=0.085)。术后辅助化疗组肿瘤直径为21~30 mm患者5年生存率为87.8%,与未术后辅助化疗组的79.3%比较,差异无统计学意义(P=0.194),见图3C。
术后辅助化疗组肿瘤直径为31~40 mm患者mST为76个月,长于未术后辅助化疗组的65个月,差异有统计学意义(χ2=10.010,P=0.002)。术后辅助化疗组肿瘤直径为31~40 mm患者5年生存率为82.3%,高于未术后辅助化疗组的56.1%,差异有统计学意义(P=0.022),见图3D。
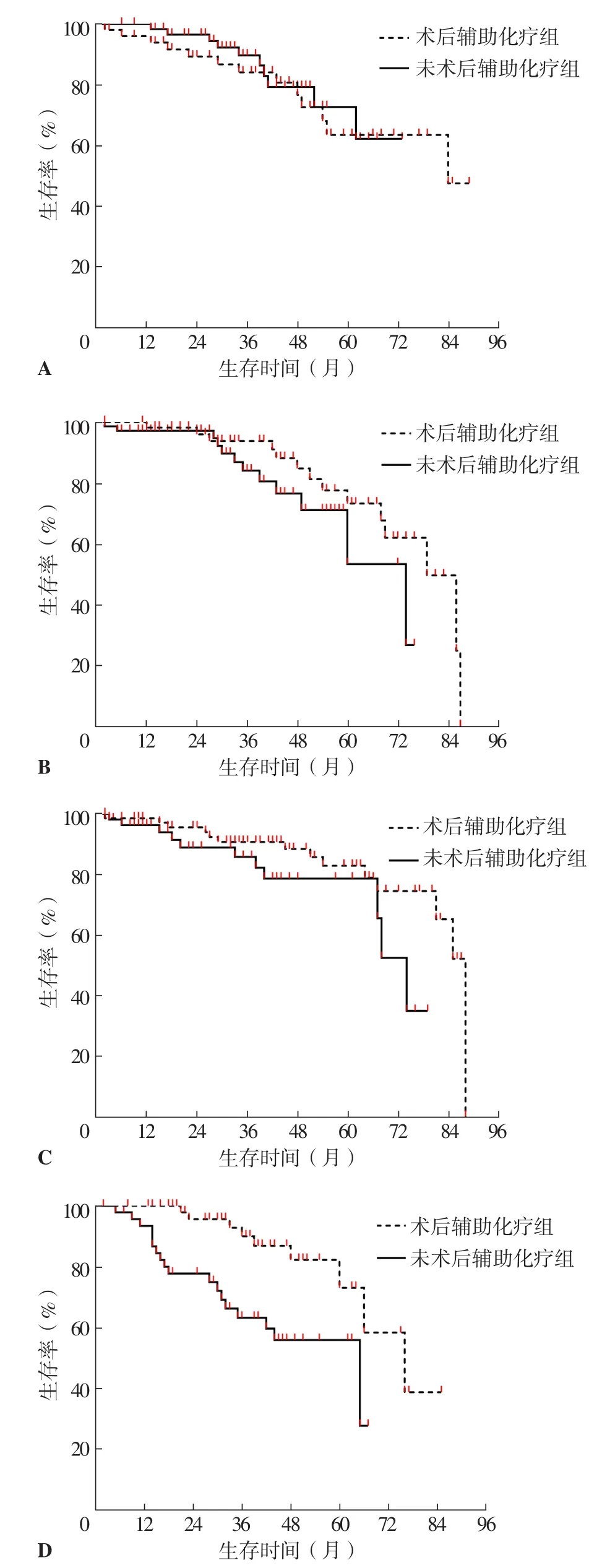
图3 术后辅助化疗组和未术后辅助化疗组不同肿瘤直径患者生存曲线Figure 3 Survival curves of patients with different tumor diameters in postoperative adjuvant chemotherapy group and non postoperative adjuvant chemotherapy group
2.5.3 术后辅助化疗组和未术后辅助化疗组不同分期患者mST、5年生存率比较 术后辅助化疗组ⅠA期患者mST为68个月,与未术后辅助化疗组的62个月比较,差异无统计学意义(χ2=0.421,P=0.516)。术后辅助化疗组ⅠA期患者5年生存率为58.3%,与未术后辅助化疗组的65.5%比较,差异无统计学意义(P=0.374),见图4A。
术后辅助化疗组ⅠB期患者mST为86个月,长于未术后辅助化疗组的74个月,差异有统计学意义(χ2=14.170,P<0.001)。术后辅助化疗组ⅠB期患者5年生存率为81.0%,高于未术后辅助化疗组的70.9%,差异有统计学意义(P=0.084),见图4B。
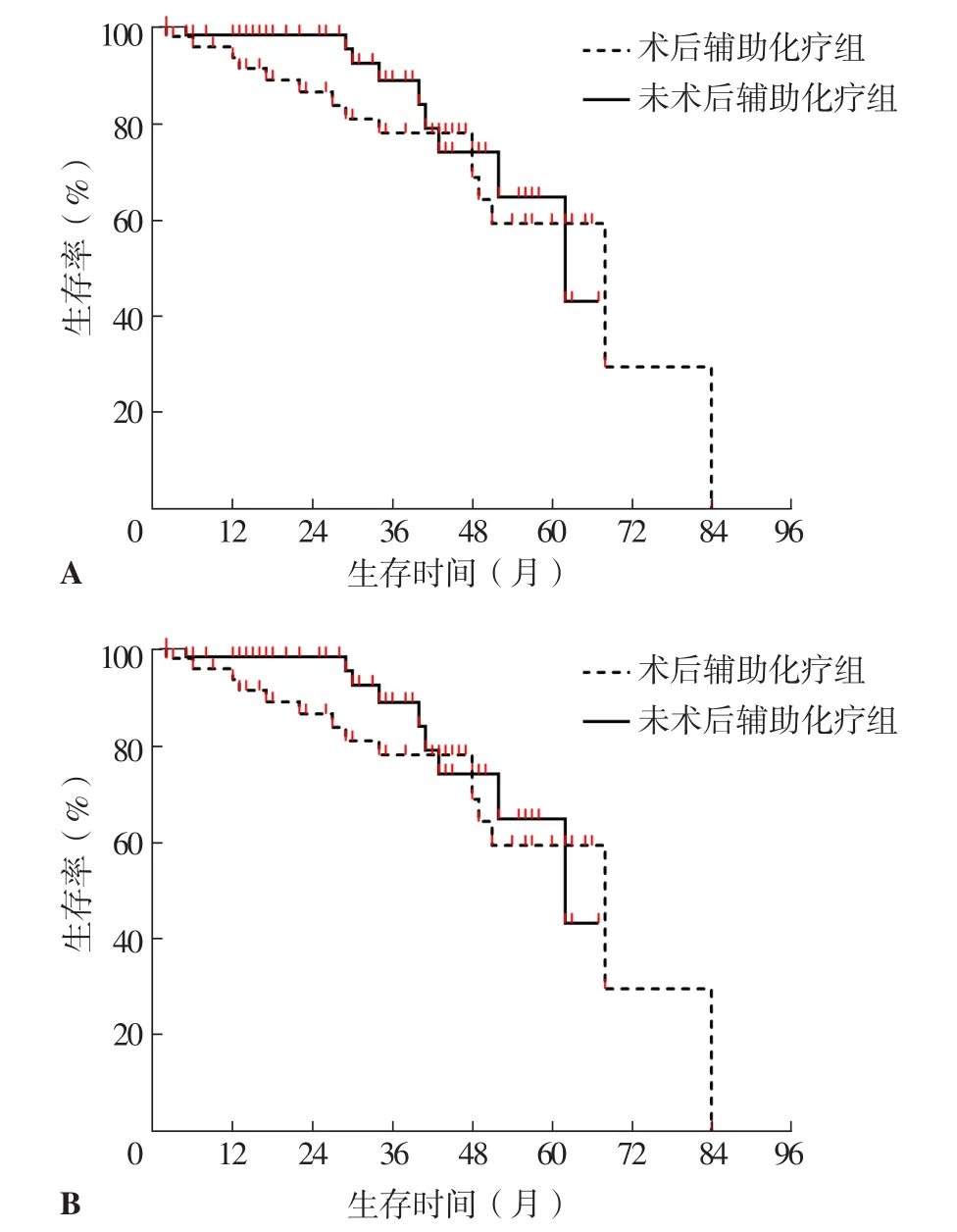
图4 术后辅助化疗组和未术后辅助化疗组不同分期患者生存曲线Figure 4 Survival curves of patients at different stages in postoperative adjuvant chemotherapy group and non postoperative adjuvant chemotherapy group
2.5.4 术后辅助化疗组和未术后辅助化疗组不同术后危险因素评分患者mST、5年生存率比较 术后辅助化疗组术后危险因素评分<2分患者mST为88个月,与未术后辅助化疗组的81个月比较,差异无统计学意义(χ2=1.049,P=0.306)。术后辅助化疗组术后危险因素评分<2分患者5年生存率为37.5%,与未术后辅助化疗组的38.1%比较,差异无统计学意义(P=0.090),见图5A。
术后辅助化疗组术后危险因素评分≥2分患者mST为79个月,长于未术后辅助化疗组的60个月,差异有统计学意义(χ2=11.870,P=0.001)。术后辅助化疗组术后危险因素评分≥2分患者5年生存率为77.6%,高于未术后辅助化疗组的47.6%,差异有统计学意义(P=0.002),见图5B。
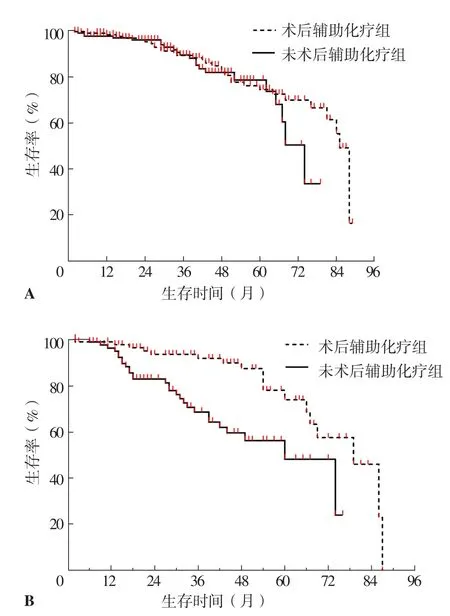
图5 术后辅助化疗组和未术后辅助化疗组不同术后危险因素评分患者生存曲线Figure 5 Survival curve of patients with different postoperative risk factor scores in postoperative adjuvant chemotherapy group and non postoperative adjuvant chemotherapy group
3 讨论
手术是NSCLC患者的首选治疗策略,但早期(Ⅰ期)患者术后5年生存率约为72.7%,ⅢA期患者术后5年生存率仅为23.6%[15],所以术后化疗是NSCLC患者的重要辅助治疗手段[16]。本研究结果显示,术后辅助化疗组患者mST长于未术后辅助化疗组,提示术后辅助化疗可以延长早期NSCLC患者的生存时间。术后辅助化疗组患者5年生存率与未术后辅助化疗组比较无统计学差异,这与蔡静静等[17]的研究结果一致,但MORGENSZTERN等[18]的研究却指出,术后辅助化疗可明显提高ⅠB期NSCLC患者的5年生存率(66%与51%,P<0.000 1),这可能与研究纳入患者的病理分期、数量及自身异质性有关。
既往研究结果显示,早期肺腺癌患者的复发率高于其他类型肺癌患者[17],但术后辅助化疗会明显改善患者OS[18]。本研究结果亦显示,术后辅助化疗组病理学分型为腺癌患者mST长于未术后辅助化疗组,5年生存率高于未术后辅助化疗组。XU等[19]的研究结果提示,肺鳞癌患者术后辅助化疗后有较好的OS和无进展生存期(progression-free survival,PFS)。但本研究结果显示,术后辅助化疗组病理学分型为鳞癌、腺鳞癌患者mST、5年生存率与未术后辅助化疗组比较无统计学差异,提示术后辅助化疗不会给早期鳞癌和腺鳞癌患者带来生存获益,分析原因可能与纳入患者所使用的分期标准不同及样本量差异有关。
肿瘤直径与NSCLC患者预后存在密切联系。本研究结果显示,术后辅助化疗组肿瘤直径为1~10、11~20、21~30 mm患者mST、5年生存率与未术后辅助化疗组比较无统计学差异;术后辅助化疗组肿瘤直径为31~40 mm患者mST长于未术后辅助化疗组,5年生存率高于未术后辅助化疗组;这与《美国临床肿瘤/癌症护理协会非小细胞肺癌临床实践指南》[20]和TU等[21]的研究结果一致,提示肿瘤直径为31~40 mm的早期NSCLC患者接受术后辅助化疗有助于延长其生存时间。
对于早期NSCLC患者,是否采用术后辅助化疗目前仍存在较大争议,尤其是ⅠB期患者。BURDETT等[22]和HE等[23]的Meta分析结果显示,术后辅助化疗可以延长早期NSCLC患者的生存时间,而LI等[24]并不推荐ⅠB期NSCLC患者进行术后辅助化疗,因为其通过Meta分析发现,术后辅助化疗并未提高ⅠB期NSCLC患者5年无病生存率(P=0.080),也未降低局部转移和复发的风险,这可能与纳入患者数量和患者个体差异有关。PIGNON等[5]的研究提出,术后辅助化疗不会明显延长早期(ⅠA期和ⅠB期)NSCLC患者的OS。本研究结果显示,术后辅助化疗组ⅠA期患者mST、5年生存率与未术后辅助化疗组比较无统计学差异;术后辅助化疗组ⅠB期患者mST长于未术后辅助化疗组,5年生存率高于未术后辅助化疗组;提示术后辅助化疗可延长ⅠB期NSCLC患者的生存时间,但并不能延长ⅠA期NSCLC患者的生存时间。目前国内外的诊疗指南均不推荐ⅠA期患者接受术后辅助化疗[9-10],而ⅠB期患者是否需要进行术后辅助化疗仍需要更多的随机对照试验来证明。
《NCCN 2021版NSCLC指南》[14]提出,NSCLC患者术后复发的高危因素主要包括肿瘤直径>4 cm、肿瘤低分化、神经内分泌肿瘤、脏器胸膜浸润、楔形切除术、血管浸润和淋巴结状态不明。但本研究使用的是IASLC第八版肺癌TNM分期标准[13],所以本研究不包含肿瘤直径>4 cm的患者。本研究按照包含危险因素个数对患者进行术后危险因素评分,结果显示,术后辅助化疗组术后危险因素评分<2分患者mST、5年生存率与未术后辅助化疗组比较无统计学差异;术后辅助化疗组术后危险因素评分≥2分患者mST长于未术后辅助化疗组,5年生存率高于未术后辅助化疗组;提示术后辅助化疗可明显改善复发高危NSCLC患者的预后,这与《Ⅰ~ⅢB期非小细胞肺癌完全切除术后辅助治疗指南(2021版)》[25]和《中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)》[9]推荐的治疗策略存在争议。但本研究接受术后辅助化疗的复发高危患者仅有85例,研究结果还需要进一步验证。
综上所述,术后辅助化疗可以延长早期NSCLC患者的生存时间,尤其是病理学分型为腺癌、肿瘤直径为31~40 mm、ⅠB期、术后危险因素评分≥2分患者。但本研究尚存在一定局限性,并未统计纳入研究的早期NSCLC患者的具体化疗方案及手术和化疗的间隔时间,并未细化病理学分类,且为单中心研究,样本量较小,以上因素可能会对研究结果造成一定影响。
作者贡献:王秋桐、曹婷婷、周玮玮进行文章的构思与设计、研究的实施与可行性分析、统计学处理;王秋桐撰写与修订论文;王明、姜俊杰进行数据收集、整理;王秋桐、吴爽、赵瑞进行结果的分析与解释;王秋桐、姜俊杰负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

