支气管动脉化疗栓塞术联合贝伐珠单抗治疗中晚期非小细胞肺癌患者的疗效及其对血浆miR-200a和miR-375表达水平的影响研究
辛鑫,梁志伟,余会敏,郧立杰
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最常见的病理类型,也是全球癌症相关死亡的主要原因,中晚期肺癌患者因失去根治性手术治疗的机会,能选择的治疗方案有限,主要有放疗、化疗、靶向治疗或免疫治疗等[1]。支气管动脉化疗栓塞术(bronchial arterial chemo embolization,BACE)是肺癌姑息治疗的方法之一,多用于丧失手术治疗机会的中晚期肺癌患者,支气管动脉是肺癌的主要供血动脉,BACE通过“首过效应”增加局部药物浓度,可提高治疗效果,且毒副作用较全身化疗轻[2]。贝伐珠单抗是一种血管生成抑制剂,临床常作为复发性晚期实体恶性肿瘤的后线用药,被证实可提高疾病控制率(disease control rate,DCR),延长患者总生存期(overall survival,OS)[3]。微小核糖核酸(micro ribonucleic acid,miRNA)在转录和/或翻译后通过调节基因表达,广泛参与人类生理和病理过程,包括NSCLC的发生,现有研究显示,miR-200a在NSCLC肺上皮细胞中表达下调[4],miR-375在NSCLC患者血清中表达下调[5],并且与NSCLC发病有着密切联系。BACE联合贝伐珠单抗治疗NSCLC的报道并不多见,其临床疗效尚待验证,鉴于此,本研究拟采用BACE联合贝伐珠单抗治疗中晚期NSCLC,探讨其疗效和安全性,以及对血浆miR-200a、miR-375表达的影响。
1 对象与方法
1.1 研究对象 选择2018年1月至2020年1月石家庄市第三医院收治的中晚期NSCLC患者172例为研究对象。纳入标准:(1)组织学或细胞学检验确诊为NSCLC;(2)TNM分期Ⅲ~Ⅳ期;(3)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分0~1分;(4)年龄>18周岁。排除标准:(1)近1个月有大咯血和出血病史者;(2)有严重心血管疾病、肺空洞性病变者;(3)妊娠期或哺乳期女性;(4)合并严重肝肾衰竭、骨髓抑制者;(5)EGFR基因突变者。采用随机数字表法将患者分为对照组和观察组,各86例。两组患者年龄、性别、TNM分期、病理类型、肿瘤大小、ECOG评分比较,差异无统计学意义(P>0.05),见表1。本研究获得石家庄市第三医院伦理委员会批准〔(2017)伦理审批第101号〕,患者及其家属对本研究知情同意并签署同意书。
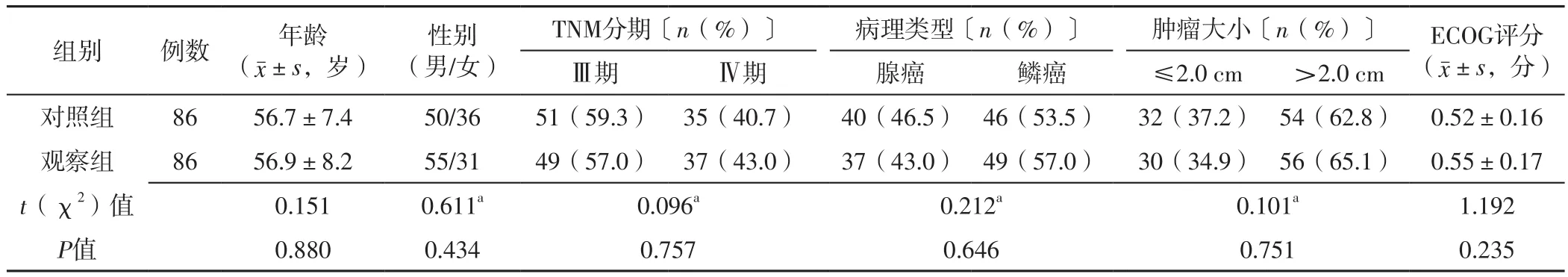
表1 两组患者基线资料比较Table 1 Comparison of baseline data between the two groups
1.2 干预方法 两组患者术前常规行凝血功能和血常规检查,术前8 h禁食,4 h禁饮。对照组:采用CT平扫及增强扫描确定肿瘤大小、位置和周围血供及支气管动脉走形,给予患者利多卡因进行局部麻醉,采用改良Seldinger技术行经皮右侧股动脉穿刺,将5 F猪尾导管(Terumo,日本)通过5 F血管鞘引入胸主动脉以获得胸主动脉造影,再置入5 F-Cobra导管(Terumo,日本)进行支气管动脉血管造影以识别肿瘤供血动脉。如果不能确定肿瘤供血动脉,行胸内动脉和肋间动脉血管造影以确认肿瘤供血动脉。通过同轴亲水导丝将2.6 F微导管(Asahi,日本)推进到肿瘤供血动脉中,采用100 ml 0.9%氯化钠溶液分别稀释吉西他滨(江苏豪森药业集团有限公司生产,药品批号:190532,规格:0.2 g)和顺铂(齐鲁制药有限公司生产,药品批号:F02326,规格:10 mg),先经微导管缓慢注入吉西他滨稀释液37.5 mg/m2,间隔30 min后经微导管缓慢注入顺铂稀释液37.5 mg/m2,化疗药物混合后,透视监控下采用明胶海绵颗粒栓塞,术毕拔除导管和血管鞘,纱布包扎穿刺点,间隔3周治疗1次,3周为1个周期,共需治疗4个周期,至少治疗2个周期。
观察组:在对照组基础上增加贝伐珠单抗(齐鲁制药有限公司生产,药品批号:J0356Y,规格:100 mg:4 ml),BACE治疗结束当天给予贝伐珠单抗15 mg/kg静脉滴注,间隔3周治疗1次,3周为1个周期,需治疗4个周期,至少治疗2个周期。
因毒副作用未能进入第4个周期的患者,待毒副作用缓解或病情稳定后,继续维持治疗,直至出现疾病进展(progress of disease,PD)或不可接受的毒副作用或退出研究。
1.3 临床疗效评估 参考RECIST 1.1版实体肿瘤疗效评价标准[6],分为完全缓解(complete response,CR):目标病灶消失,全部淋巴结短直径缩减至10 mm以内;部分缓解(partial remission,PR):目标病灶半径总和缩减至少30%;PD:目标病灶半径总和增加>20%,且>5 mm或出现新的病灶;稳定(stable of disease,SD):即达不到PR标准,又不满足PD标准。计算客观缓解率(objective response rate,ORR)和DCR,ORR=(CR例数+PR例数)/总例数×100%,DCR=(CR例数+PR例数+SD例数)/总例数×100%。
1.4 血浆miR-200a、miR-375表达水平检测 分别于治疗前1 d、治疗后第1天采集两组患者静脉血3 ml,置入EDTA抗凝管离心5 min(相对离心力700×g),取上层清液冷冻保存备检。采用TRIZOL试剂(美国赛默飞世尔科技公司)提取总RNA,PrimeScript 1st Strand cDNA Synthesis Kit〔宝生物工程(大连)有限公司〕合成cDNA,采用Taqman miRNA RT-Real Time PCR试剂盒(美国赛默飞世尔科技公司)、CFX96实时定量PCR系统(美国BIO-RAD公司)测量miR-200a、miR-375表达水平。反应体系:DNA模板2 μl,上、下游引物各1 μl,Premix Ex Taq DNA 聚合酶25 μl,RNase-Free ddH2O 21 μl。引物序列如下:miR-200a上游引物为5'-CGTAATACTGCCGGGTAATGAT-3',下游引物为5'-GTGTCGTGGAGTCGGCAA-3';miR-375上游引物为5'-GTGCAGGGTCCGAGGT-3',下游引物为5'-AGCCGTTTGTTCGTTCGGCT-3';U6(内参)上游引物为5'-GCTTCGGCAGCACATATACTAAAAT-3',下游引物为5'-CGCTTCACGAATTTGCGTGTCAT-3'。反应条件:95 ℃15 s,55 ℃ 30 s和 72 ℃ 30 s,共40个循环。采用2-ΔΔCt法定量计算miR-200a、miR-375表达水平。
1.5 安全性评估 记录两组患者治疗期间毒副作用发生情况,药物相关毒副作用包括骨髓抑制(红细胞、白细胞、血小板减少)、胃肠道反应(食欲减退、恶心呕吐)、肝肾功能损伤、心脏毒性、脱发、神经麻痹等。根据WHO NCI-CTC 4.0版《抗癌药物急性与亚急性毒性反应判定标准》[7]分级标准,记录Ⅲ度及以上毒副作用发生率。操作相关并发症:导管相关感染、非靶点栓塞。
1.6 随访 治疗结束后每3个月进行1次电话随访,随访时间截至2021-01-31,记录无进展生存期(progression-free survival,PFS)、OS,PFS定义为从入组到任何原因导致的PD或死亡的时间,OS定义为从入组到任何原因导致的死亡的时间。
1.7 统计学方法 采用SPSS 25.0统计学软件进行数据分析。计量资料采用Shapiro-Wilk检验,符合正态分布以(±s)表示,两组间比较采用独立样本t检验,同组间不同时间比较采用配对t检验;偏态分布计量资料采用M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验。计数资料以相对数表示,组间比较采用χ2检验。绘制生存曲线,采用Log-rank检验比较生存率的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 172例患者中168例完成治疗,其中2例因经济原因中途退出本研究,2例因严重毒副作用无法完成治疗,每组84例。治疗后,两组患者ORR比较,差异无统计学意义(χ2=0.807,P=0.369);观察组DCR高于对照组,差异有统计学意义(χ2=5.364,P=0.021),见表2。
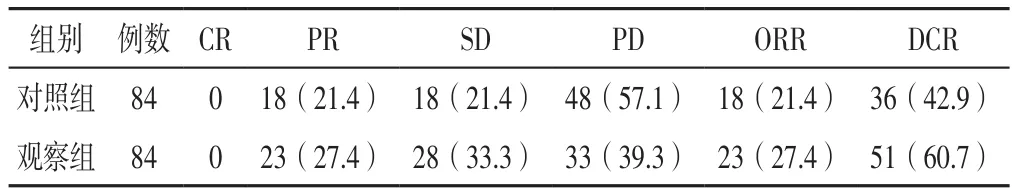
表2 两组患者临床疗效〔n(%)〕Table 2 Clinical efficacy of the two groups
2.2 血浆miR-200a、miR-375表达水平 治疗前两组患者血浆miR-200a、miR-375表达水平比较,差异无统计学意义(P>0.05);治疗后两组患者血浆miR-200a、miR-375表达水平分别高于本组治疗前,且观察组患者血浆miR-200a、miR-375表达水平高于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后血浆miR-200a、miR-375表达水平比较(±s)Table 3 Comparison of plasma miR-200a and miR-375 expression levels between the two groups before and after treatment
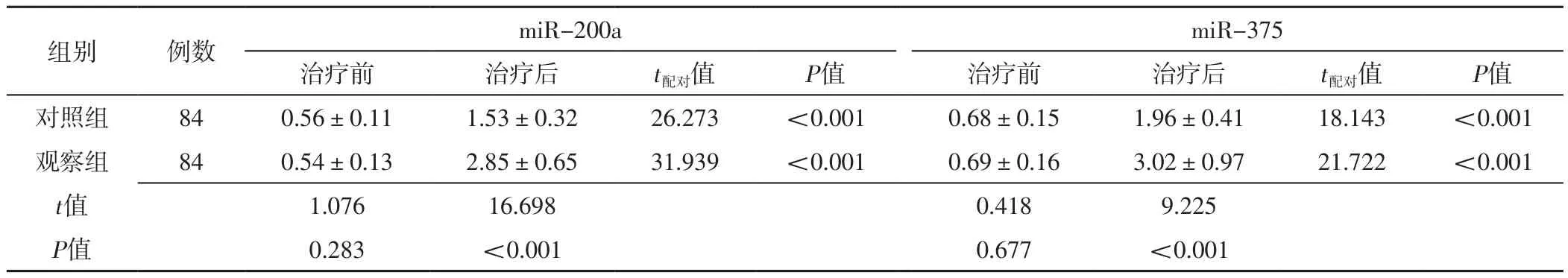
表3 两组患者治疗前后血浆miR-200a、miR-375表达水平比较(±s)Table 3 Comparison of plasma miR-200a and miR-375 expression levels between the two groups before and after treatment
组别 例数 miR-200a miR-375治疗前 治疗后 t配对值 P值 治疗前 治疗后 t配对值 P值对照组 84 0.56±0.11 1.53±0.32 26.273 <0.001 0.68±0.15 1.96±0.41 18.143 <0.001观察组 84 0.54±0.13 2.85±0.65 31.939 <0.001 0.69±0.16 3.02±0.97 21.722 <0.001 t值 1.076 16.698 0.418 9.225 P值 0.283 <0.001 0.677 <0.001
2.3 毒副作用 两组均未出现导管相关感染、非靶点栓塞,亦未出现Ⅲ度及以上肝肾功能损伤、心脏毒性、神经麻痹等毒副作用。两组患者Ⅲ度及以上毒副作用总发生率比较,差异无统计学意义(χ2=0.339,P=0.560),见表4。
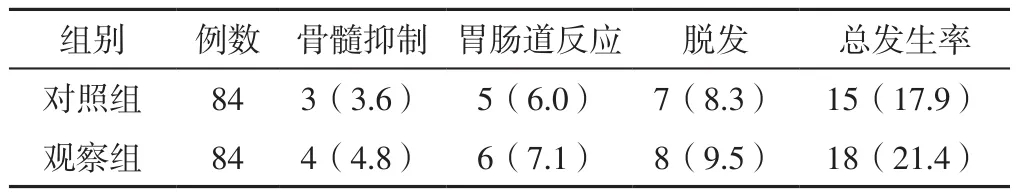
表4 两组患者Ⅲ度及以上毒副作用发生情况〔n(%)〕Table 4 The incidence of Ⅲ degree and above toxic and side effects in the two groups
2.4 生存状况 中位随访时间为25(12~36)个月,168例患者随访期间失访12例,其中观察组失访7例、对照组失访5例。两组患者中位PFS分别为9〔95%CI(5,14)〕个月、9〔95%CI(4,12)〕个月,中位OS分别为21〔95%CI(15,26)〕个月、17〔95%CI(13,21)〕个月。两组患者无进展生存率比较,差异无统计学意义(20.25%比20.77%,χ2=2.546,P=0.111),观察组患者总生存率高于对照组,差异有统计学意义(29.11%比38.96%,χ2=4.902,P=0.027),见图1。
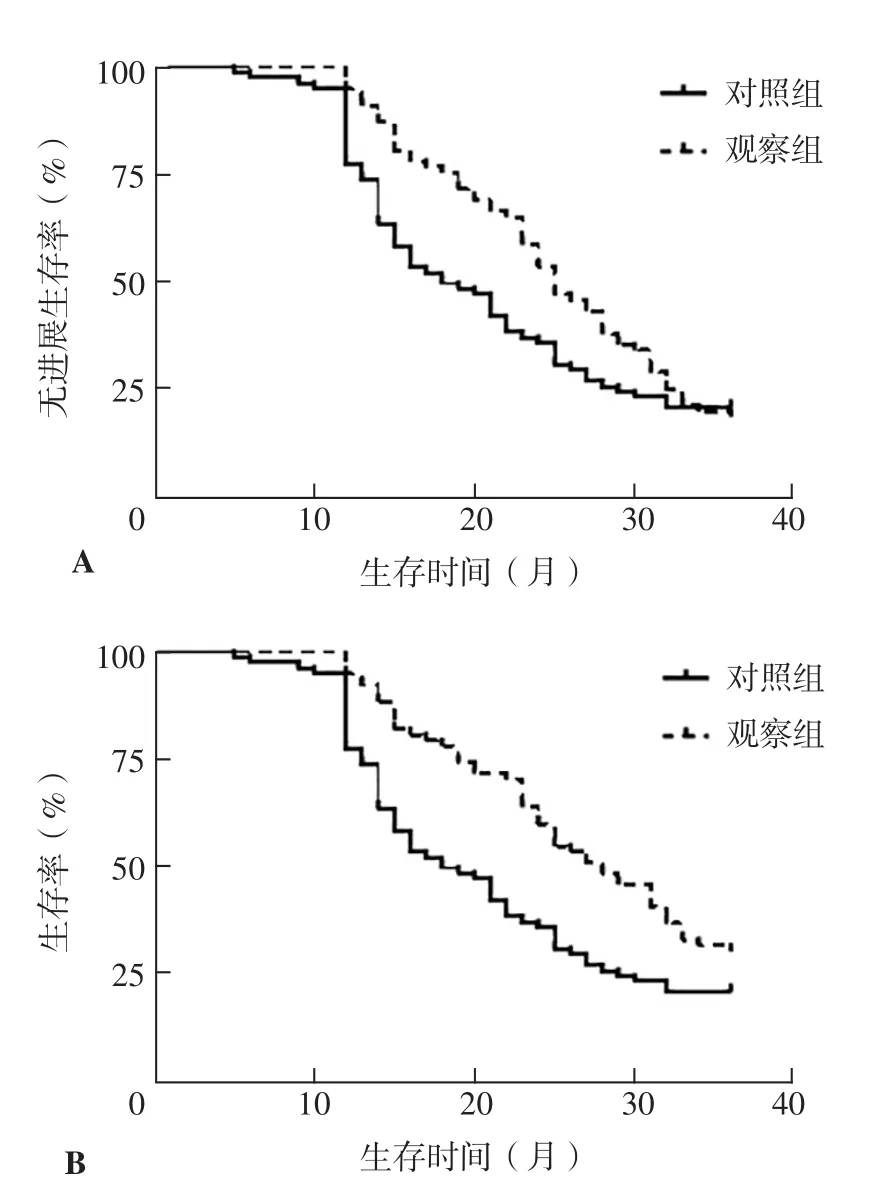
图1 两组患者无进展生存率、总生存率比较的生存曲线Figure 1 Survival curves of comparison of progression free survival rate and overall survival rate between the two groups
3 讨论
NSCLC是全球高发病率和高死亡率的恶性肿瘤,约占肺癌的85%,好发于有吸烟史和65岁以上的成年人,其他风险因素还包括环境污染和遗传。由于缺乏有效的筛查和早期诊断手段,大多数患者明确诊断时已失去根治性手术的机会,严重影响预后[8]。肺癌的非手术治疗主要包括化疗、放疗、靶向治疗、免疫治疗和介入治疗,其中放化疗可引起放射性肺炎、继发性支气管狭窄、胃肠道反应、骨髓抑制、免疫性肺炎等毒副作用,降低患者的生活质量;靶向治疗和免疫治疗对延长患者生存时间有益,但其治疗反应是短暂的,部分患者治疗后仍发生复发或转移,目前对于初始化疗和放疗后局部肿瘤进展的NSCLC患者,尚无有效治疗方法[9]。
介入治疗因其微创、易耐受、并发症少等优势越来越多地被用于中晚期肺癌的治疗。BACE最早用于咯血的治疗,其适应证不断扩展,目前已用于治疗良性和恶性咯血以及肺癌的治疗[10]。BACE可延长化疗药物在肿瘤部位的作用时间,增加治疗区域的药物浓度,更有效地杀死肿瘤细胞,还能阻止肿瘤供血动脉血流,导致肿瘤缺血坏死,对肺癌咯血患者也有明显的止血作用[11]。CHEN等[12]报道显示,采用BACE治疗Ⅲ~Ⅳ期NSCLC患者DCR达59.3%,中位PFS达8.2个月,中位OS达18.1个月。本研究对照组采用BACE治疗后DCR为42.86%,中位PFS为9个月、中位OS为17个月,与上述报道相似。肺癌细胞多浸润支气管腔内或周围,而支气管黏膜的血供主要依赖支气管动脉,这种解剖关系的存在为BACE治疗奠定了基础,由于正常动脉血流会迅速降低靶区药物浓度,缩短其作用时间,影响抗肿瘤效果,化疗栓塞可增加药物作用时间和浓度,并阻断肿瘤血液供应,增强抗肿瘤效果[13]。贝伐珠单抗是第一个获批的血管生成抑制剂,最早被批准与化疗药物联合治疗转移性结直肠癌,之后在转移性乳腺癌、NSCLC、胶质母细胞瘤、肾细胞癌、卵巢癌和宫颈癌等实体瘤治疗中均有应用[14]。现有研究显示,贝伐珠单抗单药治疗晚期NSCLC的中位OS为14.1个月,中位PFS为5.1个月[15],贝伐珠单抗联合程序性死亡受体1抑制剂、卡铂、紫杉醇也可一线治疗转移性非鳞状NSCLC,并可使患者获益[16]。本研究观察组采用BACE联合贝伐珠单抗治疗中晚期NSCLC患者,其DCR明显提高,提示BACE联合贝伐珠单抗可提高中晚期NSCLC治疗效果。
miR-200a是上皮间质转化过程的调节剂,锌指E盒结合同源框(zinc finger E-box binding homeobox,ZEB)1和ZEB2是其靶基因,在NSCLC中miR-200a通过调控rhophilin Rho GTPase结合蛋白2调节ZEB1和ZEB2,抑制上皮间质转化过程,在NSCLC中发挥抑癌基因作用[17]。miR-200a还可通过靶向肝细胞生长因子信使RNA的3'非翻译区负向调节其表达,减少NSCLC肿瘤细胞迁移和侵袭[18]。miR-375在NSCLC癌组织样本中表达下调,miR-375低表达与NSCLC病理分期和淋巴结转移有关,是总生存率低下的危险因素[19]。miR-375通过调控其靶基因——人表皮生长因子受体2抑制其表达,诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖,在NSCLC中发挥抑癌基因作用[20]。检测miR-200a、miR-375表达水平有助于评估NSCLC临床治疗反应,本研究结果显示,两组患者治疗后血浆miR-200a、miR-375表达水平均增高,且观察组患者高于对照组,表明BACE联合贝伐珠单抗可能上调miR-200a、miR-375表达水平,进而增强其抗肿瘤作用,抑制NSCLC进展。
综上所述,BACE联合贝伐珠单抗能更有效地上调miR-200a、miR-375表达水平,具有更好的疾病控制效果,并能延长患者OS,在中晚期NSCLC治疗中具有更大的优势。本研究局限之处在于尚不能证实BACE联合贝伐珠单抗对miR-200a、miR-375的调控机制,有待进一步开展基础研究加以证实。
作者贡献:辛鑫进行文章的构思与设计,撰写论文,负责文章的质量控制及审校,对文章整体负责、监督管理;辛鑫、梁志伟进行研究的实施与可行性分析,统计学处理;余会敏、郧立杰进行资料收集、整理;辛鑫、梁志伟、郧立杰进行论文的修订。
本文无利益冲突。

