基于核酸分子光开关的闭管可视化环介导等温扩增检测方法
王 芳,董 菁,李艳妮,徐秦峰
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
核酸分子的快速检测对疾病诊断、环境监测以及食品安全等领域具有十分重要的意义。传统聚合酶链式反应(PCR)[1]具有灵敏、准确度高等优势,但是需要复杂的操作和精密的温控仪器[2]。环介导等温扩增(LAMP)技术可以在恒温条件下实现特异、高效的核酸扩增,其灵敏度和扩增产物量比传统PCR高出一个数量级,适合于现场和检测条件较简单的实验室进行快速核酸检测[3-5]。
目前LAMP扩增产物的检测方法主要有凝胶电泳法、浊度法和荧光染料法[6-7]。凝胶电泳法用时较长不适合现场分析,并且需要开管操作,极易造成气溶胶污染;浊度法检测避免了开盖操作但仅在短时间内稳定,且存在主观误差和检出限高的缺点。LAMP可视化荧光染料如钙黄绿素和SYBR Green I均对扩增反应有一定抑制,且存在Stoke's位移小(40 nm)等问题,影响其对于核酸检测的实际应用。与有机染料相比,无机配合物核酸分子光开关[Ru(bpy)2(dppz)]2+具有Stoke's位移大(150 nm)、性质稳定、易于合成等优点[8-11],适合用作可视化核酸检测染料。最近有研究将[Ru(phen)2dppz]2+用于检测纸基芯片上的LAMP扩增反应产物[12],但开管检测容易造成扩增产物气溶胶的污染[13-15]。
本实验室前期研究发现,低浓度的[Ru(bpy)2(dppz)]2+对LAMP扩增的抑制作用较小,因此可以在扩增反应前加入,用于LAMP的实时荧光定量检测[8]。虽然实时检测可以实现全程闭管,但需要大型仪器,无法普及使用。为能闭管引入高浓度染料而不影响LAMP扩增反应,本实验通过采用微晶蜡[16-18]将扩增体系与[Ru(bpy)2(dppz)]2+检测试剂在一个反应管中分隔开,使扩增与检测染料在LAMP反应时互不接触,待反应结束时熔化微晶蜡使两者混合即可在蓝光激发下产生明显的红色荧光信号(图1)。该方法既克服了可视化检测所需的高浓度染料直接添加至反应溶液中对LAMP造成的强烈抑制,也避免了由于开盖引起的气溶胶交叉污染问题,实现了一种常见食源性致病菌(金黄色葡萄球菌,S.aur eus)DNA模型分析物的闭管、快速、可视化荧光检测。
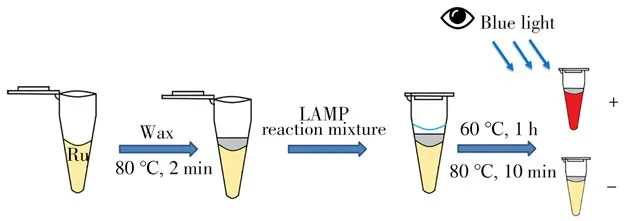
图1 闭管可视化LAMP检测示意图Fig.1 Schematic diagram of visualized closed-tube LAMP detection
1 实验部分
1.1 仪器与试剂
高速冷冻离心机、移液枪(Eppendorf AG公司);移液枪枪头(Axygen Scientific公司);电热恒温水槽(上海精宏试验设备有限公司);分析天平(北京赛多利斯仪器系统有限公司);琼脂糖水平电泳仪(Bio-Rad Laboratories公司);电泳图像分析系统(上海复日科技有限公司);B-BOX蓝光透射仪(Smobio Technology公司);超微量分光光度计(Thermo Scientific公司);生物洁净型标准洁净工作台(苏州安泰空气技术有限公司);微孔板(Corning公司);全波长扫描式多功能读数仪(Thermo Scientific公司);紫外-可见-近红外分光光度计(美国安捷伦公司)。
Deoxynucleotide(dNTP)Solution Mix、Bst 2.0 WarmStar®DNA Polymerase、MgSO4Solution(New England Biolabs);细菌基因组DNA提取试剂盒、普通DNA产物纯化试剂盒(天根生化科技(北京)有限公司);琼脂糖(Thermo Fisher Scientific);NaCl(Sigma公司);微晶蜡(沧州东方蜂蜡胶业有限公司);[Ru(bpy)2(dppz)]2+(Jena Bioscience公司)。
金黄色葡萄球菌和单核细胞增生李斯特菌的4条引物,以及沙门氏菌的4条引物均购于生工生物工程(上海)股份有限公司。引物序列如表1所示。

表1 实验所用引物序列Table 1 Sequence of primers used in the experiment
1.2 食源性致病菌DNA提取
本实验采用磁珠法[19]提取增菌培养液中的DNA。食源性致病菌分别为金黄色葡萄球菌(S.aureus)、沙门氏菌(S.spp)、单核细胞增生李斯特菌(L.mon)、溶藻弧菌(V.al g)。使用超微量核酸定量仪测定DNA浓度和纯度后分装放置于-20℃保存,备用。
1.3 闭管可视化LAMP检测
1.3.1 闭管LAMP扩增与可视化检测本实验采用10μL LAMP反应体系,包括等温扩增缓冲液(1.00μL,200 mmol/L Tris-HCl,100 mmol/L(NH4)2SO4,500 mmol/L KCl,20 mmol/L MgSO4,1%Tween-20,pH 8.8,25℃),dNTP(1.40μL,10 mmol/L),甜菜碱(1.60μL,5 mol/L),MgSO4(0.45μL,100 mmol/L),酶(0.40μL,8 000 U/mL),S.aur-F3(0.50μL,4 mol/L),S.aur-B3(0.50μL,4 mol/L),S.aur-FIP(0.32μL,50 mol/L),S.aur-BIP(0.32μL,50 mol/L)。按上述剂量配制反应基液,装入PCR管中,加入1μLS.aureusDNA;同时设置无模板阴性对照并用双蒸水补齐10μL体系。
在200μL PCR管中加入[Ru(bpy)2(dppz)]2+溶液,取适量微晶蜡(熔点78℃左右)加热至80℃使蜡融化,将检测溶剂密封于管底。待微晶蜡凝固后,在蜡上方加入扩增体系并设置有模板与空白对照进行扩增,水浴锅60℃温育60 min。在LAMP扩增时微晶蜡呈固态,染料与扩增体系分离,互不干扰。待扩增结束后升高温度至80℃使微晶蜡融化并使核酸扩增酶失活,摇晃离心管使染料与扩增产物接触,在蓝光透射仪下观察颜色。
1.3.2 凝胶电泳及荧光光谱表征采用2%的琼脂糖凝胶电泳法对S.aur eus的LAMP扩增产物进行分析鉴定。另取待检测样品100μL于微孔板中,使用全波长扫描式多功能读数仪测定荧光光谱,激发波长450 nm,激发和发射狭缝12 nm。
1.3.3 LAMP扩增与检测条件优化对荧光染料[Ru(bpy)2(dppz)]2+浓度(5、10、15、20、25μmol/L)、扩增温度(50、55、60、65、70℃)、扩增时间(20、40、60、80、100 min)以及镁离子浓度(0、2、4、6、8、10 mmol/L)等实验条件进行了优化。10μL LAMP反应体系中,扩增体系配置同“1.3.1”,在水浴锅中进行扩增后于蓝光透射仪下观察颜色,并通过智能手机进行拍照。
1.3.4 可视化闭管LAMP方法的灵敏度与特异性将S.aur eus模板DNA以10倍比例梯度稀释,浓度依次为:2×105、2×104、2×103、2×102、2×101、2拷贝/反应。每个梯度取1μL为模板,按优化的实验条件进行反应,验证方法灵敏度。
以S.s pp、L.mon、V.alg的基因组DNA分别作为待测样品模板,S.aureus的基因组DNA作为模板阳性对照,双蒸水作为模板阴性对照(NTC)。按照优化的实验条件进行反应,反应结束后通过观察颜色变化验证方法特异性。
1.3.5 可视化闭管LAMP方法的通用性及模拟样品检测将目标引物更换为S.s pp、L.mon的引物,以S.s pp、L.mon的基因组DNA分别作为待测样品模板,其它菌种基因组DNA和没有模板的样品作为对照。按照优化的实验条件进行反应,反应结束后通过观察颜色变化验证方法通用性。
以S.aureus人工污染超高温瞬时灭菌(UHT)常温奶作为模拟样品,磁珠法提取DNA作为扩增模板。按照优化的实验条件进行反应,反应结束后通过观察颜色变化验证方法实用性。
2 结果与讨论
2.1 基于核酸分子“光开关”的LAMP目视检测可行性验证
由实验室前期研究成果可知[8]:[Ru(bpy)2(dppz)]2+在LAMP扩增体系中的最大耐受浓度为2μmol/L,超过该浓度会抑制LAMP扩增反应;但[Ru(bpy)2(dppz)]2+浓度较高时(>10μmol/L)方能得到较好的可视化比色效果。LAMP扩增过程与可视化比色过程对[Ru(bpy)2(dppz)]2+的浓度要求差异较大,无法同时满足。因此不能将[Ru(bpy)2(dppz)]2+在扩增前直接加入至扩增体系中。而在扩增后开管加入[Ru(bpy)2(dppz)]2+进行比色,容易引起气溶胶污染造成“假阳性”,影响后续实验。因此本实验采用微晶蜡构建LAMP扩增与检测的闭管模式。该方法原理如图1所示,利用微晶蜡将位于反应管底部的[Ru(bpy)2(dppz)]2+检测溶液体系与LAMP扩增溶液体系分隔开来。由于LAMP扩增反应温度(60℃)低于微晶蜡熔点温度(78℃),因此在整个LAMP扩增反应过程中微晶蜡呈固态,扩增体系与染料分别处于微晶蜡的上下层,高浓度的染料不会对扩增反应造成干扰。待扩增结束后升温至80℃使微晶蜡融化,染料与扩增产物DNA相互混合,即可在闭管状态通过蓝光透射仪检测扩增反应是否发生。阳性发射红色荧光,阴性则无荧光发射。该方法解决了染料抑制扩增和开管气溶胶污染风险的问题,实现了LAMP扩增反应的闭管可视化检测。
如图2A所示,直接添加[Ru(bpy)2(dppz)]2+试剂未用蜡分隔时,阳性与阴性无明显区分;而用蜡将染料与扩增体系分隔开时,产生明显的颜色变化,红色阳性样品与无色阴性样品颜色对比明显。对两组样品进行荧光光谱扫描,结果与目视比色结果一致(图2B):用蜡分隔的阳性与阴性样品在[Ru(bpy)2(dppz)]2+最大发射波长处的荧光强度具有很大差异;而未用蜡隔开的样品,阳性与阴性样品的荧光强度均很弱且无明显区分。凝胶电泳表征结果(图2C)显示,直接加[Ru(bpy)2(dppz)]2+未用蜡分隔开时,高浓度的染料抑制了LAMP扩增反应,在凝胶电泳图中无LAMP扩增产物特征条带出现;当用蜡将染料与扩增体系分隔开时,在凝胶电泳图中有LAMP扩增产物特征条带出现,LAMP扩增反应正常,与可视化比色结果、荧光光谱图一致。综上所述,采用微晶蜡分隔扩增体系与检测染料可以实现可视化LAMP检测,且全程闭管避免污染。
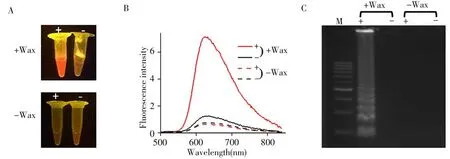
图2 LAMP检测的目视比色图(A)、荧光光谱图(B)与琼脂糖凝胶电泳图(C)Fig.2 Visual image(A),fluorescence spectrogram(B)and agarose gel electropherogram(C)of LAMP detection
2.2 实验条件优化
为了达到最佳的可视化检测效果,分别对扩增条件和检测条件进行了优化。[Ru(bpy)2(dppz)]2+浓度优化结果如图3A所示。只有当染料浓度大于10μmol/L时方可达到较明显的红色阳性、无色阴性的颜色对比。综合考虑检测效果的稳定性和实验成本,后续实验选择15μmol/L作为[Ru(bpy)2(dppz)]2+染料浓度。Mg2+浓度优化结果如图3B所示,镁离子浓度为8 mmol/L时,显色反应最为明显,当镁离子浓度小于8 mmol/L时,扩增效果不好,不能达到较好的显色。因此确定扩增最佳镁离子浓度为8 mmol/L。
对LAMP扩增反应时间和温度进行了优化。结果如图3C、D所示:反应时间大于60 min,阳性样品均有明显的颜色变化;反应温度为60℃时,阳性阴性颜色对比最为明显。综合考虑时间和最佳检测效果,选择60℃温度下反应60 min进行后续实验。
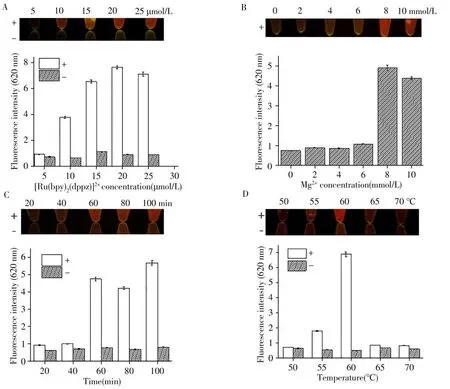
图3 [Ru(bpy)2(dppz)]2+浓度(A)、Mg2+浓度(B)、反应时间(C)及反应温度(D)的优化Fig.3 Optimization of[Ru(bpy)2(dppz)]2+concentration(A),Mg2+concentration(B),reaction time(C)and reaction temperature(D)
2.3 闭管可视化LAMP检测的灵敏度及特异性
为确定方法能够检测到的最低模板DNA的含量,以10倍比例梯度稀释S.aur eus模板DNA进行荧光目视比色实验。结果如图4A所示:可视化检测可达到20拷贝/反应的检出限,且可视化检测结果与凝胶电泳验证结果(图4B)相一致。表明基于[Ru(bpy)2(dppz)]2+的可视化检测方法具有较高的检测灵敏度。
方法的特异性检测结果如图4C所示:只有加入目标菌种S.aur eus模板DNA时有明显的红色,无模板或者加入其它非目标致病菌模板时均无明显颜色变化。凝胶电泳结果(图4D)显示,只有S.aureus样品有LAMP扩增产物特征梯状条带产生;其它非目标菌样品以及阴性对照无扩增条带产生。可视化检测结果与凝胶电泳结果一致,表明所建立的方法特异性强。

图4 LAMP荧光目视比色法的灵敏度目视图(A)和凝胶电泳图(B),以及特异性目视图(C)和凝胶电泳图(D)Fig.4 Fluorescent(A),gel electrophoresis(B)images for sensitivity detection,and fluorescent(C),gel electrophoresis(D)images for specificity detection of visualized closed-tube LAMP detection
2.4 闭管可视化LAMP的通用性及模拟样品检测
为验证该方法的通用性,分别采用L.mon和S.sp p特异性引物进行荧光目视比色实验。结果如图5A所示:只有加入目标菌种模板DNA时有明显的红色,无模板或加入其它非目标致病菌模板时均无明显颜色变化,表明该方法具有较好的通用性。
为验证所建立方法的实用性,对人工S.aur eus污染的UHT常温牛奶样品进行荧光目视比色检测。在无菌环境及操作下,设置S.aureus阳性实验组、UHT常温奶中加入S.aureus实验组、UHT常温奶实验组模拟样品进行检测,同时设置相应的无模板阴性对照。结果如图5B所示,向UHT常温奶中加入S.aureus实验组有明显的红色,与S.aur eus阳性实验组现象相一致,但UHT常温奶实验组并无明显颜色变化(图5B上排);并且3组无模板阴性对照均无明显的颜色变化(图5B下排)。因此,该方法在样品检测中具有一定的实用性且检测结果可靠。

图5 LAMP荧光目视比色法通用性目视图(A)和模拟样品检测荧光光谱图(B)Fig.5 Fluorescent images for universality detection of visualized closed-tube LAMP detection(A)and fluorescent images for milk sample detection(B)
3 结 论
本文将LAMP恒温扩增与[Ru(bpy)2(dppz)]2+相结合,建立了基于[Ru(bpy)2(dppz)]2+的闭管可视化LAMP检测方法。该方法采用微晶蜡分隔构建闭管检测模式,避免了LAMP大量产物可能造成的气溶胶污染风险问题。通过优化[Ru(bpy)2(dppz)]2+浓度、Mg2+浓度、反应时间与反应温度等实验条件,实现了高特异性和高灵敏度的可视化检测。该检测能够在1 h内完成,检出限低至20拷贝/反应。该方法具有可视化检测对比效果明显、特异性好、灵敏度高、通用性强以及简单快速等优势,可应用于环境检测、食品安全、临床诊断等领域的现场快速核酸检测。
- 分析测试学报的其它文章
- Research Progress of Hemicyanine Dye for Molecular Imaging
- 碱性磷酸酶的体外检测和体内成像研究进展
- Recent Progress in Nanoscale MOFs for Biological Imaging of Tumors and Tumor Markers
- I-Motif-based Nanosystems for Biomedical Applications:p H Imaging,Drugs Controlled Release and Tumor Theranostics
- A Low-cost,Automated Nucleic Acid Extraction System Converted from the Open-Source Rep Rap 3D Printer
- Research Progress on Analytical Methods for Deciphering Adenosine-to-inosine RNA Editing

