食源性创伤弧菌检测技术研究进展
姚文艳,姜 晖
(东南大学 生物科学与医学工程学院,江苏 南京 210096)
创伤弧菌(Vibrio vulnificus)是一种嗜盐性革兰氏阴性条件致病菌,主要存在于海水及海底沉积物中[1]。该菌的多个组成成分(如荚膜多糖、Ⅳ型菌毛、溶血素和细胞外金属蛋白酶等)作为毒力因子起着重要的致病作用[2-4]。创伤弧菌通过伤口或肠道感染传播,可导致多种水产养殖动物和人体患病,引发人体肠胃炎、脑膜炎、原发性败血症、伤口组织坏死等疾病[5-6]。在所有食源性病原体中,创伤弧菌的病死率最高,且发病迅速,伤口感染的平均潜伏期仅为16 h,败血症的平均潜伏期为26 h[7]。美国疾病控制和预防中心在1964年首次分离出创伤弧菌[8]。据统计,美国超过95%的海产品相关死亡案例由创伤弧菌感染引起[9];我国台湾也报道了多起创伤弧菌感染死亡病例[10];欧盟于2003年要求从我国进口的鱼虾等海产品必须进行创伤弧菌检测。因此,有效的检测技术在创伤弧菌感染临床检验及食品安全保障方面非常重要。本文将介绍创伤弧菌的传统与现代检测技术,为创伤弧菌的有效防控及患者的诊断治疗提供科学依据。
1 传统病原学检测技术
基于常规病原学诊断方法,食品和药物管理局细菌分析手册(FDA-BAM)标准法中详细规定了食品中创伤弧菌的检验程序。基本步骤包括样本的制备、选择性富集培养、选择性分离培养、纯培养、细菌形态观察、生化检测等,其中选择性培养基的分离鉴定是关键环节。目前,常用的创伤弧菌培养法主要有基于选择性培养基的直接培养法、增菌培养法和显色培养法,此3种培养方法的比较如表1所示。适用于创伤弧菌的选择性培养基有许多种,主要包括VVMc培养基和mCPC琼脂培养基等[11]。基于选择性培养基的直接培养法检测结果阳性率低,对目标菌株的最低检出量相对较高。当采集样本中含有杂菌时,杂菌可进一步抑制创伤弧菌的增长,较难培养获取纯菌株,使目标菌株的菌落数量低于最低检出量,从而造成漏检。增菌培养法可有效提高目标菌株检测的灵敏度。我国首个创伤弧菌食品安全国家标准(GB 4789.44-2020)《食品微生物学检验创伤弧菌检验》即是将增菌培养法和聚合酶链式反应(PCR)检测相结合,用于水产品中的创伤弧菌检测,有效提高了检测效率[12]。且加入适当的抗生素可有效抑制大部分革兰氏阳性细菌,提高增菌效果[13]。此外,显色培养法可根据菌落颜色直接鉴定菌种,避免了对菌落大小形态类似的菌株做进一步分离培养鉴定的复杂操作程序,极大提升了目标菌株的检测效率[14]。

表1 创伤弧菌3种培养方法的比较Table 1 Comparison of three culture methods of V.vulnif icus
2 免疫学检测技术
免疫学检测方法基于抗原抗体的特异性反应实现对目标菌株的识别响应。目前,细菌抗体的抗原靶点包括细菌表面的脂多糖(LPS)、荚膜多糖以及外毒素等。由于以整个目标菌体作为检测对象,其准确性取决于抗原抗体的特异性结合能力。反应过程中的非特异性吸附会带来假阳性结果。相比于病原学检测方法,免疫学方法可将检测时间缩短至数小时,操作更加简便,尤其是与层析技术相结合可通过肉眼直接观察病原菌的检测结果,无需专门的分析设备,实用性强而被广泛应用。但免疫学方法仍需在实验室内进行目标菌株的增殖培养,无法实现食品样本的现场检测;其抗体难获取,易失活,且存在较明显的非特异性反应,目前该方法还在进一步的改进研究中。
2.1 酶联免疫吸附测定法
酶联免疫吸附技术(ELISA)将酶催化下的底物显色反应与酶标记的抗原抗体反应相结合,从而实现目标物的特异性灵敏检测,主要包括直接ELISA、间接ELISA、双抗体夹心ELISA及竞争ELISA等。ELISA技术对创伤弧菌的检测应用由来已久,早在1997年Biosca等[15]便开发了一种基于兔体内抗LPS的多克隆抗体的间接ELISA检测方法,成功用于鳗鲡鱼感染的创伤弧菌生物型2的检测,检出限为104个细胞/孔~105个细胞/孔,并用于检测非可培养状态的细胞。张家敏等[16]成功制备出创伤弧菌溶细胞素鼠源性单克隆抗体,可用于检测自然表达的创伤弧菌溶细胞素。刘秀萍等[17]开发了一种双抗体夹心ELISA法,用于食物样品中拟态弧菌、副溶血弧菌和创伤弧菌毒素的快速、同时、灵敏检测。古小莉等[18]建立了一种创伤弧菌快速检测的斑点ELISA技术,可直接肉眼判定检测结果,方便经济,便于在基层实验室推广应用。
2.2 免疫层析法
免疫层析法(IC)是在硝酸纤维素膜上固定特异性抗体,将待测样品浸入到该膜的一端,之后样品会在毛细管的作用下沿着硝酸纤维素膜向前移动,当移动到有抗体存在的区域时,抗体会特异性结合样品中对应的抗原。该区域可通过胶体金或酶染色来显色,从而实现待测物的特异性诊断。严智敏等[19]制备出一种用于创伤弧菌快速检测的免疫层析试纸条,可在20~30 min内获得检测结果,检出限为2×106CFU/mL,且对奇异变形杆菌和鲍曼不动杆菌等12株非目标菌无交叉反应。这种基于反应信号放大的快速诊断方法具有可视化、成本低廉、操作简便、稳定性好等优点,可满足基层单位及现场检测需求,无需专业人员即可定期进行检测,有助于对病原体感染进行快速筛查,但该技术也存在不能精确定量、检出限较高的问题。
3 分子生物学检测技术
分子生物学检测技术以DNA或RNA作为靶标序列,能够实现目标菌株的快速自动化检测,具有特异性强、可重复性好等特点。目前,应用于创伤弧菌的分子生物学检测技术主要有PCR及其衍生技术、环介导等温扩增(LAMP)和重组酶聚合酶扩增(RPA)技术(表2)。

表2 创伤弧菌的分子生物学检测方法比较Table 2 Comparison of molecular biological detection methods of V.vulni ficus
3.1 基于聚合酶链式反应的检测技术
PCR及其衍生技术已广泛应用于各种细菌检测。与其他常规方法相比,基于PCR的方法显示出更好的特异性、更高的灵敏度、更短的分析时间和更高的准确性[20-22]。应用于创伤弧菌检测的PCR技术主要有常规PCR、多重PCR(mPCR)、最大可能数PCR(MNP-PCR)和实时PCR(RT-PCR)等。如图1所示,Yin等[23]基于vvh A基因、胶原酶基因和t oxR基因开发了一种多次触点聚合酶链式反应(MTPCR)方法,成功用于临床样本及环境中创伤弧菌、副溶血弧菌和溶藻弧菌的同时快速检测。该方法对创伤弧菌的灵敏度可达104CFU/mL,对副溶血弧菌和溶藻弧菌的灵敏度均为103CFU/mL,特异性为100%。Tsai等[24]基于r poS、toxR、mecA、gcat、dnas eB和G B6个物种特异性基因的新组合构建mPCR法,同时检测创伤弧菌、嗜水气单胞菌、耐甲氧西林金黄色葡萄球菌、A组链球菌和B组链球菌,结果表明该方法的准确率为87.5%。Baker-Austin等[25]利用靶向致病性创伤弧菌的pi lF基因开发的RT-PCR检测法可在47株创伤弧菌分离株中成功检测致病菌株,准确率达97.9%。Bonny等[26]将多重PCR与MNP技术相结合,建立了同时检测创伤弧菌、霍乱弧菌和副溶血弧菌的多重MNP-PCR技术,其检测结果与单重MNP-PCR无显著性差异。

图1 MT-PCR测定阳性临床和环境样品的部分结果[23]Fig.1 Partial results of positive clinical and environmental samples by MT-PCR assay[23]
3.2 核酸等温扩增检测技术
核酸等温扩增是近年发展起来的新技术。该技术无需精良的设备,酶和DNA可在恒温下进行反应,从而实现目标DNA片段的扩增。相比于PCR技术,核酸等温扩增技术具有反应温度更易控制、仪器设备简单和加热耗能少等优点,故成为替代PCR的潜在技术。核酸等温扩增技术主要有LAMP、链置换扩增(SDA)、RPA和聚合酶螺旋反应(PSR)等。其中,用于创伤弧菌检测的核酸等温扩增技术主要有LAMP和RPA技术。
LAMP是目前应用最广泛的核酸等温扩增技术,可快速检测多种微生物[27-28]。Ren等[29]建立了快速检测创伤弧菌的LAMP技术,灵敏度是常规PCR的10倍。研究者还将LAMP与其他检测技术相结合,极大提高了该方法的灵敏度。Han等[30]使用实时荧光LAMP技术和LAMP实时浊度法两种方法定量检测生蚝中的创伤弧菌。在对38个目标菌株和42个非目标菌株的检测实验中,两种方法均无假阳性或假阴性结果,在生蚝加标样本中的检测灵敏度可达PCR技术的1 000倍。此外,Surasilp等[31]将横向流动试纸法(LFD)与LAMP技术相结合,可精准检测创伤弧菌污染的食物样本,纯培养物中的检出限为每次反应2.8 CFU。
RPA技术的整个体系主要包括重组酶T4 UvsX、单链结合蛋白和链置换DNA聚合酶等[32]。2006年Piepenburg等[33]首次使用参与细胞内DNA合成、重组和修复的蛋白质开发了RPA技术,目前由TwistDX公司商业化(www.twistdx.co.uk)。相比于PCR,RPA不依赖温控设备,无需热变性,在常温下即可完成扩增反应,适用于现场便携式快速核酸检测。可用于RPA产物检测的技术主要有侧向流动试纸条法(LFS)、凝胶电泳和实时荧光定量检测。Yang等[34]利用实时RPA建立了一种靶向创伤弧菌菌体外金属蛋白酶(EMPV)基因的快速检测方法。该方法的特异性良好,39℃下可在2~14 min内完成检测,检出限为每次反应17个基因拷贝或1 CFU。在临床样本检测中,实时RPA的结果与生物测试和实时荧光定量PCR(qPCR)完全一致。需要注意的是,该方法可以抵抗食物基质的干扰,快速简单,具有广泛应用于食品安全控制中创伤弧菌检测的可能性。如图2所示,该课题组[35]进一步将具备可视信号的侧向流动试纸条与RPA技术组合,开发了靶向创伤弧菌E M P V基因的RPA-LFS检测法,其检出限比实时RPA更低,可达到每次反应2个拷贝或0.1 CFU,富集4 h后可达1 CFU/10 g株菌加标食物样品。Wang等[36]以霍乱弧菌的lolB基因和创伤弧菌的E M PV基因作为检测标志物,建立了基于RPA-LFS的生物传感器,用于同时双靶标检测霍乱弧菌和创伤弧菌。该方法具有较好的特异性,检出限为每次反应10个基因拷贝,且临床样品验证结果与RT-PCR反应结果一致。该方法检测过程简单快速,37℃下反应30 min后,在5 min内即可实现试纸条带上的可视化检测。

图2 RPA-LFS方法对创伤弧菌的检出限[35]Fig.2 Detection limit of RPA-LFS for V.vulnif ic us[35]
4 新型检测技术
4.1 生物芯片技术
生物芯片技术利用微缩法将一组识别配体如DNA、蛋白质、抗体等[37]固定在固体基质的特定位置上,用于检测核酸、蛋白质和多糖等生物成分。该技术具有高效准确、高通量等优点,在生物医学领域表现出巨大的商业应用潜力。目前,应用于创伤弧菌检测的生物芯片技术有DNA微阵列芯片和微流控芯片。
微阵列的原型是为检测蜡状芽孢杆菌[38]和产肠毒素的大肠杆菌[39]而创建。研究者们也将这一技术应用于创伤弧菌的检测中。González等[40]结合多重PCR开发了一种基因特异性DNA微阵列,可同时检测5种海洋鱼类病原菌(创伤弧菌、鳗利斯顿氏菌、美人鱼发光杆菌杀鱼亚种、杀鲑气单胞菌和副溶血弧菌)。Panicker等[41]用DNA微阵列技术偶联多重PCR,用于同时检测贝类中的副溶血弧菌、创伤弧菌和霍乱弧菌。对于无富集的纯培养物,该方法的检测灵敏度为102~103CFU/mL,特异性为100%。如图3所示,经过5 h的样品富集,其检测灵敏度可达每克牡蛎组织匀浆中1 CFU,菌体的富集培养提高了该检测技术的灵敏度。DNA微阵列的优势是能够获取病原体的详细基因组信息,包括相关的种属鉴定、分类型、毒力因子和抗生素抗性[37],但也存在可重复性较差等缺点。

图3 富集5 h后,DNA微阵列技术对牡蛎组织匀浆中副溶血弧菌、创伤弧菌和霍乱弧菌检测的灵敏度[41]Fig.3 Sensitivity of detection for V.v ul nifi cus,V.parahae mol yt ic us and V.chole rae in seeded oyster tissue homogenates following 5 h of enrichment[41]
以微流控芯片技术为基础的微全分析系统实现了生物样本处理和检测的一体化,不仅能将同一实验的多个基本步骤集成到单个微小芯片上经一步反应完成,也能将多种实验操作集成在一个实验中完成[42],在致病菌检测应用中具有集成化程度高、小型化、高效简便和节约试剂等特点。Jin等[43]报道了一种基于LAMP技术的微流控芯片,可用于检测包括创伤弧菌在内的10种水源性致病菌。该方法能够同时完成2个标本的22个遗传分析,在纯化细菌中的检测范围为每次反应7.92×10-3~9.54×10-1pg。如图4所示,Zhou等[44]建立了一种基于实时荧光LAMP技术的双样本微流控芯片,可在30 min内同时检测创伤弧菌、副溶血弧菌和肾坏死病毒等多种细菌和病毒。该方法对细菌基因组DNA的检出限为100~10-1pg/μL;病毒重组质粒DNA的检出限可达10-4~10-5pg/μL。且与常规微生物检测方法相比,其临床指标的敏感性和特异性分别为93.52%和85.53%,适用于水产养殖中多种病原体的现场检测和常规监测。

图4 双面样品微流控芯片和等温芯片检测系统[44]Fig.4 Duplex sample microfluidic chip and isothermal chip detection system[44]
4.2 生物传感技术
生物传感器由识别元件、转换器和信号检测分析元件组成,通过对电化学、光学、温度和压电等不同类型信号的识别实现小型化和自动化的传感检测。该方法所需靶标的量低至nL及以下,可同步完成多种靶标分析。此种微量检测不仅缩短了分析时间,还降低了试剂成本。生物传感器已成为病原体直接检测的有用工具,而微纳技术的兴起也进一步促进了生物传感器的应用和发展[45]。
目前,生传感器已成功应用于创伤弧菌的快速检测。如图5所示,Fan等[46]构建了一种创伤弧菌体外检测的脱氧核酶(DNAzyme)荧光传感器。3'末端修饰羧基荧光素(FAM)且5'末端修饰猝灭剂的DNAzyme可与创伤弧菌胞外粗提物(CEM)反应从而被激活,反应激活后的DNAzyme切割底物而产生荧光信号。该DNAzyme传感体系首先将普鲁兰多糖、海藻糖及DNAzyme混合添加到每个孔板中,经空气干燥后将待测样本加入到测试区使其相互反应,DNAzyme切割荧光底物产生的荧光信号经蓝光凝胶成像系统检测,检出限为2.2×103CFU/mL,检测时间为5~10 min。另外,创伤弧菌核酸适配体传感器可以极大地提高临床检验和食品安全监控部门的工作效率,具有巨大的应用潜力。Yan等[47]结合不对称PCR和指数富集的配体系统进化技术(SELEX)筛选出针对创伤弧菌的新型DNA适配体。研究结果表明,该DNA适配体对创伤弧菌具有较高的特异性与亲和性,Kd为(26.8±5.3)nmol/L,检测范围为8~2.0×108CFU/mL。该研究为创伤弧菌核酸适配体传感器的进一步开发奠定了基础。
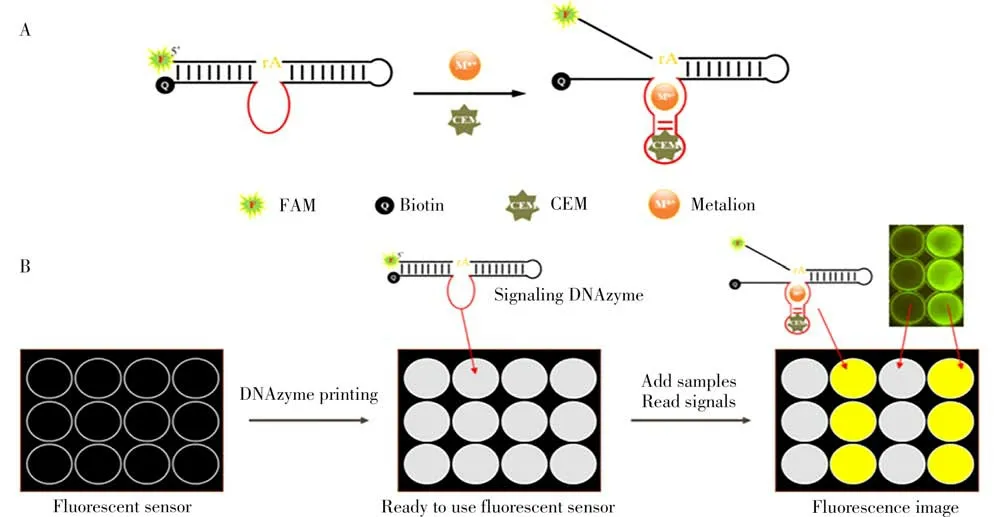
图5 脱氧核酶(DNAzyme)荧光传感器用于创伤弧菌的体外检测[46]Fig.5 DNAzyme fluorescence sensor for detection of V.vulnif ic us i n vitr o[46]
5 总结与展望
近些年,随着全球气候变暖,创伤弧菌致病案例频发,其检测方法也在不断发展。目前,常规的平板培养和生化鉴定方法仍是创伤弧菌检测的标准方法,但该方法耗时较长,无法满足高通量快速检测需求。相比于传统的检测方法,免疫学及分子生物学检测法在一定程度上缩短了检测时间,但其所涉及的富集程序有待进一步优化。因此,开发更好的细菌富集方法应是未来研究的重要方向之一。
值得注意的是,由于死细胞和活细胞中均存在DNA,PCR技术难以区分活细胞和非活细胞,通常会导致假阳性。且由于rRNA稳定性强,细胞死亡后其降解速率较慢,以rRNA作为靶标检测目标菌株也会产生假阳性结果。微流控芯片技术推动了菌体样本处理和检测的一体化发展,具备高通量优势,但较高的开发成本以及复杂先进的操作平台使其难以普及,更无法应用于基层实验室的细菌检测中。而生物传感器的优势在于其对微生物毒素和细菌的敏感性更高,只需少量样品,检测时间通常少于30 min,且纳米材料的引入降低了该方法的检出限,拓宽了检测范围,实验操作更加简便,还能实现现场、无标记的检测。但在传感过程中纳米材料的结构及性能变化仍有待探索。生物传感器也在朝着小型化、高通量系统和更高的集成度发展,从而能够开发出手持式设备,以更简单的支持系统、更快的响应时间和更低的成本对样品进行现场分析。总体而言,各种检测方法都存在优缺点,实际应用中应综合考虑选取适当的检测技术,且多技术交叉联合应用也已成为当下提高病原菌检测准确性的发展方向。
- 分析测试学报的其它文章
- Research Progress of Hemicyanine Dye for Molecular Imaging
- 碱性磷酸酶的体外检测和体内成像研究进展
- Recent Progress in Nanoscale MOFs for Biological Imaging of Tumors and Tumor Markers
- I-Motif-based Nanosystems for Biomedical Applications:p H Imaging,Drugs Controlled Release and Tumor Theranostics
- A Low-cost,Automated Nucleic Acid Extraction System Converted from the Open-Source Rep Rap 3D Printer
- Research Progress on Analytical Methods for Deciphering Adenosine-to-inosine RNA Editing

