微纳米图案化表面对细胞行为的影响
顾寅伟,李 艳,凌晶晶,顾 宁
(东南大学 生物科学与医学工程学院,生物电子学国家重点实验室,江苏省生物材料与器件重点实验室,江苏 南京 210096)
细胞与材料间的相互作用研究,尤其是材料对细胞行为的调控,对于基础生物学、组织工程和再生医学等相关领域至关重要。1911年,Harrison发现蜘蛛网上生长的细胞会沿着网中的纤维方向生长,并将这种现象称为物理导向[1]。1945年,Weiss证实了该现象,将其命名为“接触引导”[2]。随着微纳米加工技术的迅速发展,研究者在不同基材上制备出了形貌、尺寸各异的图案,并研究了这些图案对成纤维细胞、成骨细胞、上皮细胞、干细胞、神经细胞等多种细胞行为的影响。在过去的几十年内,材料调节细胞行为的研究层出不穷,但如何创造一个最佳的细胞外环境,始终是一项极具挑战性的工作。控制微纳米尺度上材料表面与细胞的相互作用,在实现细胞调控这一研究方向上有着巨大的发展前景。
1 细胞形态变化原理
细胞的机械特性主要由细胞骨架决定。细胞骨架是真核细胞中由微管、微丝以及中间纤维构成的蛋白纤维网架体系,在细胞形态、粘附、分裂、运动以及信号传导中都起着重要作用。
细胞外基质(ECM)是由蛋白质和多聚糖组成的复杂网架结构,为细胞及组织提供结构支撑。在人体内,细胞活动与细胞外基质密切相关,没有细胞外基质,细胞无法正常完成包括分裂在内的多种行为[3]。细胞受细胞外基质影响的机制有以下3种:整合素与配体间的相互作用、表面化学信号、基底的拓扑结构效应[4]。
整合素是ECM蛋白的粘附性受体,在非活性状态下,它们在细胞膜内自由扩散。当细胞在ECM中遇到一个可作用的结合位点时,多种整合素发生构象变化,通过物理聚集将大量细胞质蛋白吸引到粘附部位,以增大粘附点、提高粘附强度、加强生化信号活性。这些较大的整合素、细胞质蛋白聚集通常称为焦点粘连。整合素介导的细胞粘连将细胞骨架与ECM连接起来,并在两者之间提供动态的双向联系[5]。如此一来,力诱导的蛋白质构象变化将会被转化为生物化学信号,从而激活细胞内多种信号通路,最终调节细胞活动。
2 表面图案化方法及其意义
至今为止,表面图案化技术已较为成熟,根据制备原理,主要分为以下两种类型:(1)自上而下的制备途径。该类方法从材料本体着手,通过外部调控使图案的尺寸由宏观进入微观,形成具有特定性能或形状的微纳米结构,主要包括光刻技术[6]、软刻蚀技术[7]、纳米压印(NIL)[8]等;(2)自下而上的制备途径。通过原子、分子或分子聚合物间的非共价键力,得到尺寸逐渐增大的微纳米结构材料,该类方法包括自组装[9]、共价键固定[10]、静电逐层沉积[11]等技术。本课题组研究了一种利用交流磁场诱导磁性纳米颗粒的准一维组装技术,该方法将直径约10~11 nm的超顺磁性四氧化三铁纳米颗粒暴露于垂直的交变磁场下,利用磁偶极相互作用,使纳米粒子在磁场作用下形成纤维结构,随着磁场强度的增加,其构象发生从非晶形聚合物到纤维状结构的显著转变[12]。相似地,运用交变磁场还可以完成辣根过氧化物酶(HRP)的准一维自组装,同时可以几乎完全保留其催化活性[13]。另外,本课题组还开发了一种旋转磁场组装盘状磁性水凝胶复合材料的制备方法,三维有序排列的磁性纳米铁颗粒可以增强材料的磁热性能以及机械强度[14]。与化学修饰或物理蚀刻方法相比,该组装方法具有操作简单、成本低廉的优点。
人体内的ECM是一种复杂的三维网格架构,为细胞提供复杂的化学、物理微环境,锚固提供底物,并作为组织支撑,指导细胞的生长迁移。缺损组织的修复需要ECM替代支架的参与。细胞与材料表面的结合包括细胞附着、细胞铺展、肌动蛋白细胞骨架的变化以及局部粘连的形成。当由体外被接种到人造材料表面时,细胞会从圆形转变为盘状形态,细胞铺展的初始阶段类似于液滴在可湿性表面上的扁平化过程[15]。随后,细胞内的肌动蛋白微丝发生重组,细胞和底物之间形成局部黏连,细胞骨架结构的内部收缩控制进一步的细胞铺展行为,如层状延伸和细胞运动。
图案化技术可以在细胞培养基底上产生各种形状、大小的表面形貌,全面了解细胞粘附、铺展在不同图案表面上的具体过程及后续功能,对于生物材料的设计极其重要。
3 表面图案化对细胞行为的影响
在化学图案化中,特异性细胞感应机制起主要作用,而形貌表面图案化对细胞行为的调节,依赖于材料表面的结构与尺寸。一般而言,微纳米图案可分为各向异性和各向同性两种。各向异性图案指脊和槽形图案,沟槽、条纹图案可以使细胞在微纳米尺度上与形貌方向对齐,形成接触引导反应,对细胞的影响以细胞导向、形貌、骨架改变为主。而各向同性图案指随机或均匀分布的图案,如岛、坑、桩等,一般不会诱导细胞定向,但能够在微纳米尺度上影响细胞群体化行为,诸如细胞粘附程度、细胞铺展面积、增殖率、分化程度、上调或下调细胞信号传导等。
3.1 各向异性微纳米图案
各种尺寸的凹槽形貌构成了各向异性图案最经典的例子,用于研究体外“接触引导”现象。所谓“接触引导”是指细胞在微纳米级各向异性图案表面生长时,会出现的调节自身取向并沿着图案方向生长的现象。该现象除了可以用于高度材料引导取向的细胞组织的再生,例如肌腱、神经、骨的修复,还能够引起许多其他细胞生物学效应。Gerecht等[16]发现使用松胞素D破坏细胞骨架的细胞在图案化表面上表现出较差的取向性,表明细胞骨架在接触引导现象中起着不可或缺的作用。
接触引导发生程度的影响因素包括沟槽图案的脊宽、深度,所选细胞的种类,材料的类别以及实验条件等。大多数细胞通过沿着图案主轴的对齐和伸长来响应平行排列的凹槽和脊,而平坦表面的细胞通常表现出随机取向和更圆润的形态。Charest等[17]使用深度相同、脊宽不同的纳米沟槽图案对成肌细胞进行培养,结果表明细胞发生接触引导的程度在一定范围内与脊宽成反比,同时,脊宽还存在一个最适尺寸,可以使接触引导的发生程度最大化。超过临界尺寸时,细胞对凹槽图案的响应将逐渐消失,细胞行为趋于在平坦表面上观察到的行为。相对地,也有相关研究[18]报道了沟槽的最小尺寸阈值,在该阈值下同样不再观察到细胞排列变化。对于不同细胞类型,存在不同的最佳形貌尺寸范围。除了沟槽的宽度和深度之外,还有研究表明凹槽的纵横比也会对细胞行为产生影响。Crouch[19]、Wong[20]等的研究分别发现人类间充质干细胞和人类真皮成纤维细胞的细胞对齐、伸长程度,在一定范围内会随沟槽纵横比单调增加。另外,Holle等[21]还发现胰腺癌细胞中的角蛋白细胞骨架能够增强细胞对沟槽深度的形态响应,但没有影响对宽度的响应。综上所述,与接触引导相关的细胞形态变化与沟槽的脊宽、深度关系最为密切,但并不仅仅受上述两种因素的影响,其最终效果取决于多种条件的协同作用。
除细胞形态变化外,细胞在沟槽图案上的迁移运动也是研究的重点之一。在沟槽图案化表面上培养时,许多细胞类型(如成纤维细胞、上皮细胞、内皮细胞、成骨细胞、免疫细胞或神经元)显示出平行于沟槽的定向迁移,这与在光滑平面上观察到的细胞随机运动截然不同,并且细胞运动强度取决于沟槽尺寸。表1归纳整理了部分研究中沟槽图案的尺寸因素对细胞形态、运动的影响。
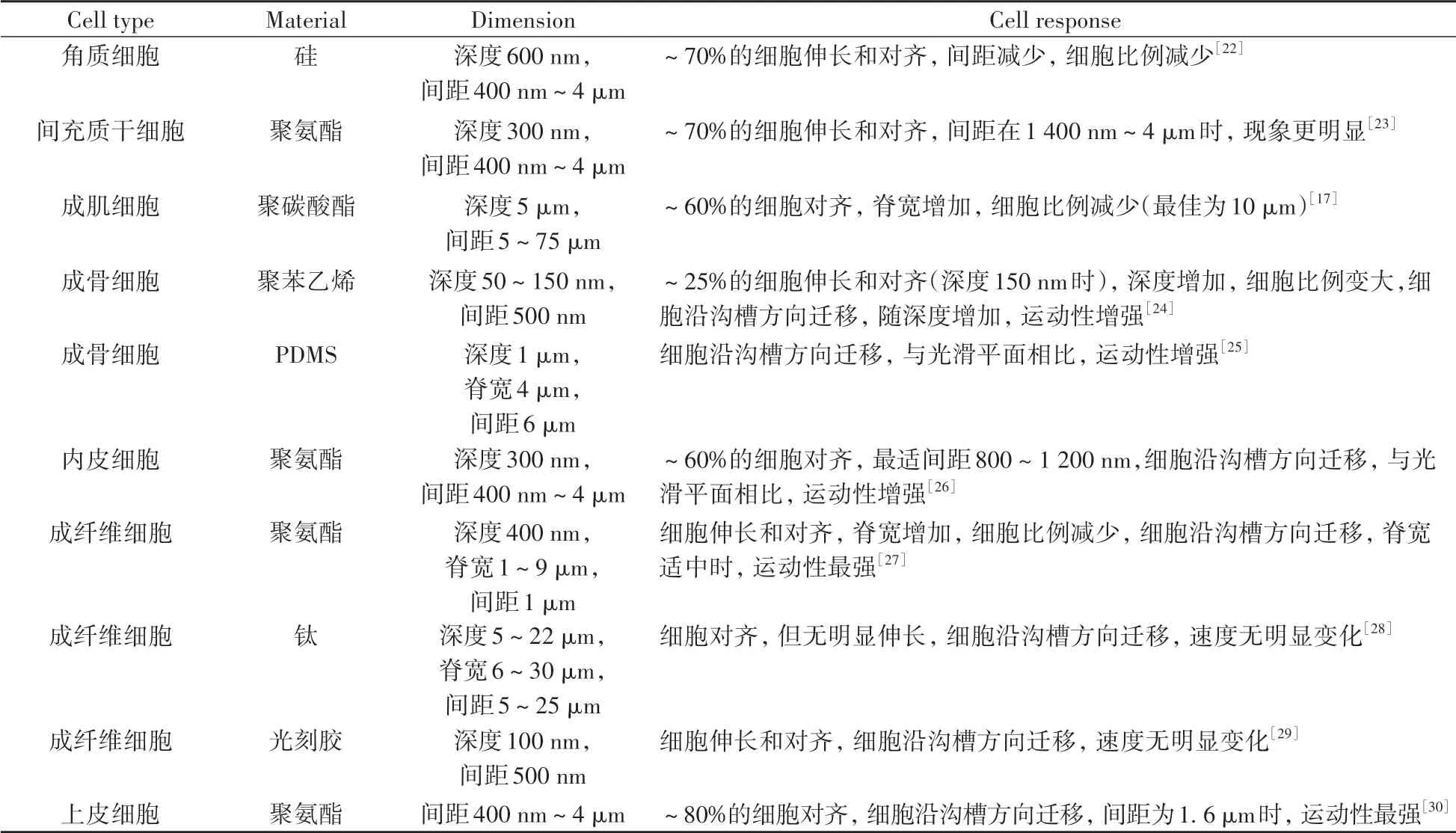
表1 微纳米沟槽对细胞行为的影响Table 1 The effect of micro/nano grooves on cell behavior
另外,由于近年来制备技术的发展以及研究者们对多数沟槽图案存在锋利边缘的不合理性产生争议,越来越多的学者开始转向研究弯曲/波浪形表面的微纳米沟槽图案。Linke等[31]在波长(峰间距离)为1.7~6.3μm的波浪形表面上培养成肌细胞,发现细胞向图案方向生长,并随着波长的增加显示出更明显的取向。Song等[32]研究发现T细胞会优先定位于波浪形沟槽图案的凹面区域,并沿着沟槽方向迁移,当沟槽波长从20μm增加到160μm时,T细胞的方向性和迁移速度均趋于消失;Cheng等[33]在血管内皮细胞的培养实验中也发现了类似现象,并观察到细胞在波长150μm的沟槽上仍能表现出一定的接触引导现象。
各向异性的微纳米图案对细胞基因表达影响的研究相对比较少见。Gwon等[34]使用聚己内酯(PCL)材料设计的一种间距、高度均为5μm的放射状沟槽图案表面的骨修复移植支架,可以显著促进其上培养细胞的取向延伸、增殖和成骨分化(图1)。本课题组将静磁场组装和凝胶化相结合制备了一种各向异性磁性水凝胶材料,可以提升所培养细胞的活力和多能性[35]。
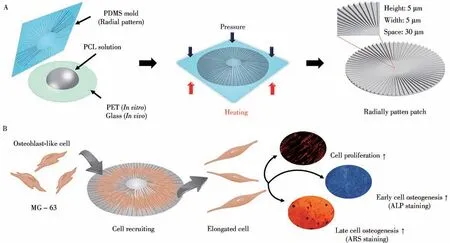
图1 放射状沟槽图案支架用于修复骨缺损[34]Fig.1 The radial groove pattern scaffold is used to repair bone defects[34]
3.2 各向同性微纳米图案
在再生医学领域中,多数支架都会采用各向同性孔洞结构,以增强细胞浸润,促进新组织生长。在随机图案化基底上培养时,理论上细胞将不会出现接触引导等有取向性的现象。与在凹槽上观察到的细长形态相反,当各向同性图案表面的特征尺寸在微米范围内时,细胞会表现出分支形态。细胞的形变、粘附程度与图案类型及尺寸有着直接关联。Zhou[36]在聚二甲基硅氧烷(PDMS)微纳米孔图案上培养Hela细胞,发现微纳米孔直径在1~12μm之间时,细胞膜较容易发生变形,变形程度与孔深度成正比,并且细胞粘附性显著上升。Lim等[37]的研究发现,与85 nm的岛状结构及平面聚苯乙烯(PS)基底相比,在高度为11 nm的岛状结构上培养成骨细胞时,细胞的粘附性以及碱性磷酸酶(ALP)活性都有一定提升。
各向同性图案表面也会对细胞运动产生影响。Nasrollahi等[38]通过在氧化铝膜内部制备相同间距直径分别为40、80 nm的孔状图案,观察到成纤维细胞在较大孔上的迁移速度更快。Jeon等[39]使用具有不同密度纳米孔图案的材料培养成纤维细胞,观察到细胞向高密度区域迁移,表明高纳米孔密度可增强细胞运动。
细胞粘附配位体的尺度及空间分布能够影响细胞功能的实现。Arnold等[40]利用不同间距的环状RGD(由精氨酸、甘氨酸和天冬氨酸组成)多肽包覆金纳米圆点图案进行实验,发现配位体间距超过73 nm时会显著降低成骨细胞粘附、延展和焦点粘连的形成,而较小的空间间距则有助于整联蛋白的聚集和活化。Huang等[41]在有序/无序RGD环肽纳米图案上培养成骨细胞,发现当配体间距大于70 nm时,细胞在有序RGD纳米图案上不会发生粘附,而在无序图案上仍会出现。Oh等[42]研究发现直径约30 nm的TiO2纳米管能够提升表面培养人骨髓间充质干细胞的粘附性,但对分化无明显影响,而直径约70~100 nm的纳米管会促进细胞向成骨方向分化。Chen等[43]在PDMS基底上制备了直径1.83μm、间距4μm的均匀微米柱图案,结果表明间充质干细胞在较硬的基底上倾向于向成骨方向分化,而在较软的基底倾向于向成脂肪方向分化。
表2展示了几种各向同性图案对细胞行为的调控作用。由于各向同性图案存在形状、尺寸、分布等多种可调节因素,故难以横向比较。从目前研究可以得出的结论是,较小的纳米形貌尺度(约10 nm高或深)对细胞基因表达功能的影响更显著,当尺度增大至约100 nm时,这种影响将变弱甚至消失。
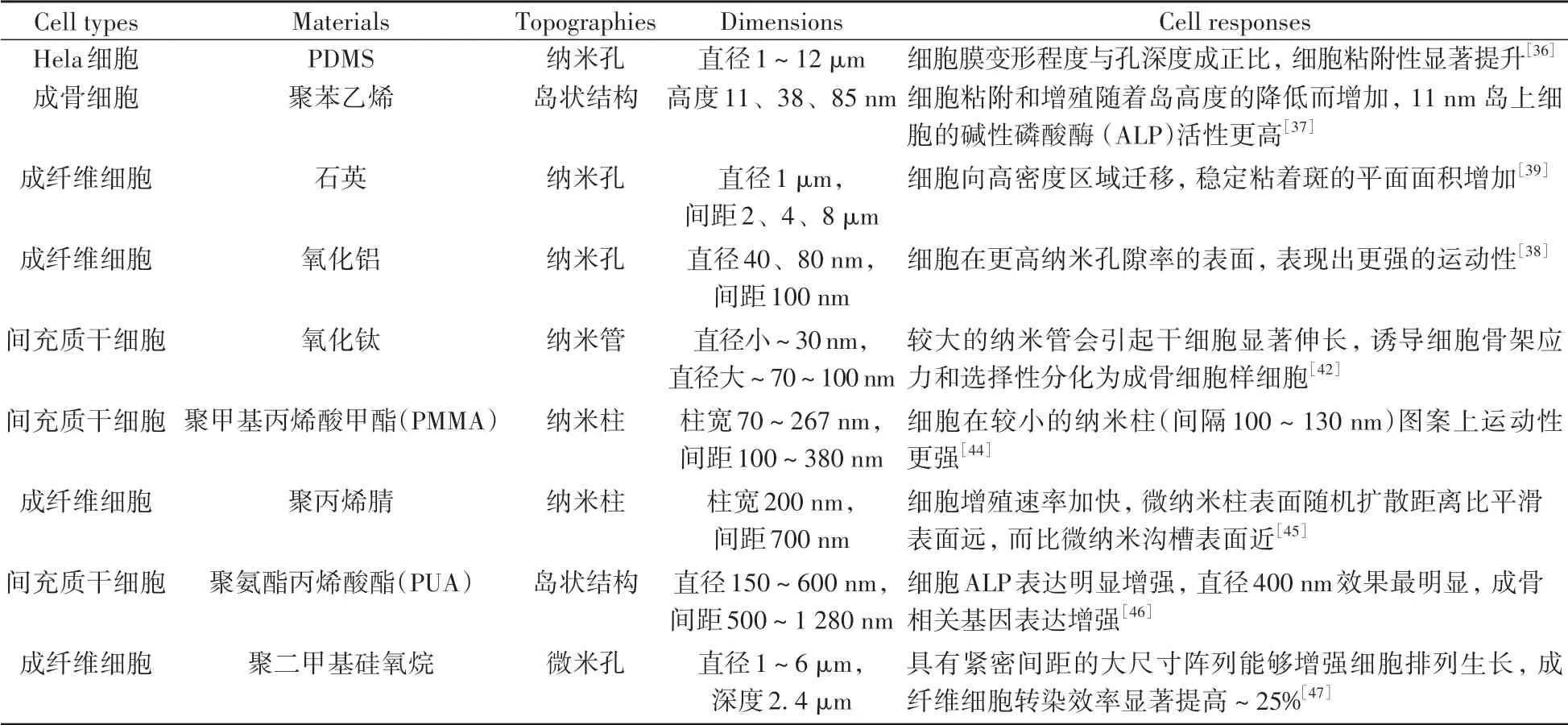
表2 各向同性的图案化表面对细胞行为的影响Table 2 The effect of isotropic patterned surface on cell behavior
3.3 复杂微纳米图案
至今为止,材料表面图案对细胞行为影响的研究已经取得了不少成果,然而大部分实验仍基于简单表面图案进行。但单一尺度的结构并不符合自然界中多数细胞的生长环境,细胞依附的表面通常为不同尺度、多级结构的复合状态。随着材料表面修饰技术的快速发展,研究者们开始将目光转向混合、复杂图案对细胞产生的多重影响。与单一结构相比,微纳多级结构可以发挥协同生物效应,多尺度精确调控细胞的生物学行为。
混合、复杂图案结构能在一定程度上更好地模仿细胞外基质中的复杂形貌结构,有利于仿生生物材料的设计和应用。Guo等[48]通过水肽喷墨打印和位点特异性生物矿化相结合的方法,制备了一种具有微米沟槽和纳米二氧化硅复合多级结构表面的水凝胶材料,该微纳复合结构系统能够在诱导人间充质干细胞沿沟槽方向生长、排列的同时,促进细胞的成骨分化。Oyunbaatar等[49]发现与常规光滑的微柱阵列相比,在多级蘑菇型PDMS微柱阵列上培养的心肌细胞肌动蛋白聚合更为显著,收缩力增强约20%。
细胞与细胞外基质相互作用的一项重要机制是整合素与细胞外基质结合位点的相互作用。因而,可以通过表面化学修饰的方法控制细胞与材料的结合位点。目前常用的自组装方法是在无机材料表面形成一层有序的有机分子膜,再根据需要在有机分子层上修饰相应的化学官能团,从而实现细胞功能的调控。使用较多的有机分子有疏水烃基硫醇、细胞外基质蛋白、RGD[50]等。本课题组采用层层自组装方法(LBL)制备的γ-Fe2O3/PLA复合多层结构材料,可以通过磁效应促进小鼠骨髓细胞的生长以及成骨分化(图2)[51]。另外还制备出一种磁性水凝胶,可以有效模仿ECM,用作新型多细胞球体培养平台,且在一定范围内调节凝胶内磁性纳米颗粒浓度可控制细胞粘附程度及细胞间的相互作用[52]。
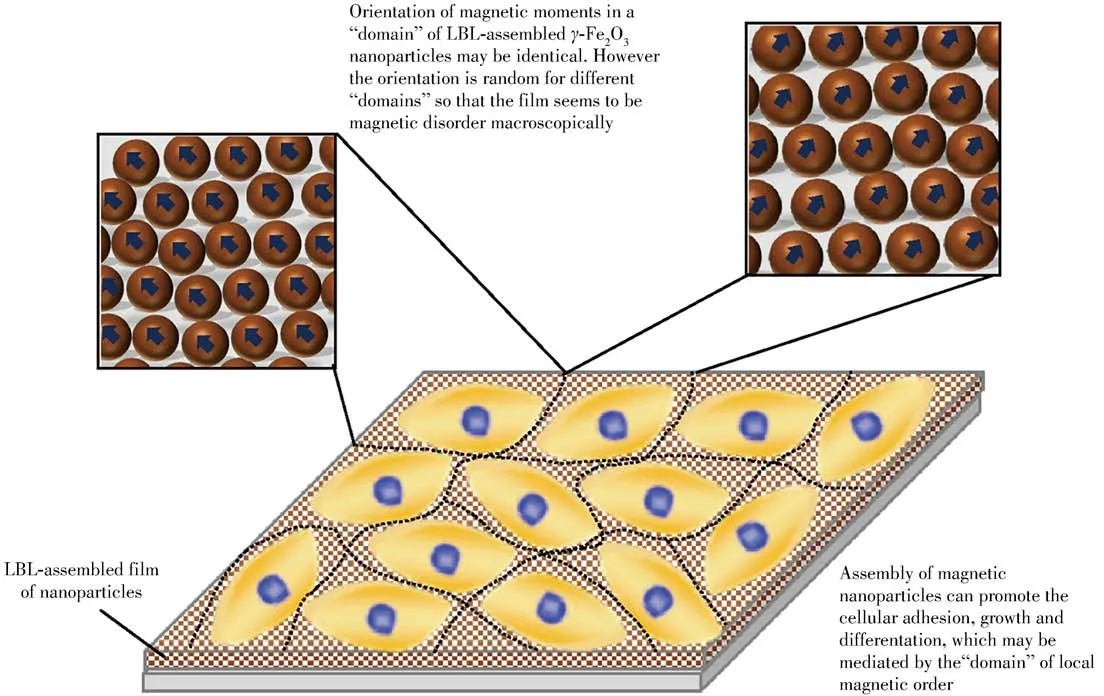
图2 磁性纳米颗粒组装薄膜对细胞作用机制的示意图[51]Fig.2 Schematic showing of the mechanism for effect of the assembled film of magnetic nanoparticles on the cells[51]
4 总结与展望
微纳米表面图案化技术一直是研究材料与细胞相互作用的重要方法之一,通过使用不同几何拓扑结构的图案,调节并研究不同细胞的行为和功能,可以探知具体作用原理。随着微纳米图案化技术的发展,后续的研究重心主要有以下几个方面:(1)图案化与外部作用力相结合,如电场、磁场,以通过这些复合作用更有效地控制细胞生理行为;(2)智能材料的运用,如利用温敏材料形成微纳米表面图案,使材料能够对外界变化做出响应,更精确地调控细胞;(3)体内环境下表面图案化对细胞调控的可行性。近年来越来越多的研究关注于三维结构对细胞的影响,这些研究对组织工程与再生医学领域所使用材料的设计及应用都将具有重大指导意义。
- 分析测试学报的其它文章
- Research Progress of Hemicyanine Dye for Molecular Imaging
- 碱性磷酸酶的体外检测和体内成像研究进展
- Recent Progress in Nanoscale MOFs for Biological Imaging of Tumors and Tumor Markers
- I-Motif-based Nanosystems for Biomedical Applications:p H Imaging,Drugs Controlled Release and Tumor Theranostics
- A Low-cost,Automated Nucleic Acid Extraction System Converted from the Open-Source Rep Rap 3D Printer
- Research Progress on Analytical Methods for Deciphering Adenosine-to-inosine RNA Editing

