miR-328-5p通过调节自噬影响乳腺癌细胞对紫杉醇化疗敏感性的机制
李建梅,孙静宜,马英桥,赵 月,李仕武
化疗是乳腺癌临床治疗中不可缺少的重要治疗手段之一,而紫杉醇(Taxol)是治疗乳腺癌的常用一线化疗药物,在控制病情、延长患者生存时间方面具有较好效果[1-2]。但根据临床对乳腺癌患者的随访追踪调查,使用Taxol期间因发生耐药性而限制了该药物的应用,这使得其有效率仅为30%~70%,且效果不长久,一般只能持续6~10个月,同时增加了患者复发、转移的风险,故在目前临床抗肿瘤药物有限的条件下,提高乳腺癌对Taxol的敏感性尤为重要[3-4]。随着对微小RNAs(miRNAs)研究的不断深入,miRNAs通过靶向其下游基因调节肿瘤多药耐药成为研究热点。曾有研究显示,miR-328在乳腺癌组织中低表达,且miR-328的过表达抑制了乳腺癌细胞增殖、耐药性和细胞周期进展[5]。既往有文献显示,整合素家族中整合素α5(ITGA5)可诱导细胞自噬发生[6]。还有研究证实,miR-33a-5p可通过抑制自噬,进而提高乳腺癌细胞对放疗的敏感性[7]。本文旨在分析miR-328-5p与ITGA5的关系及对乳腺癌Taxol敏感性的影响,进一步探讨miR-328-5p调节乳腺癌化疗耐药的具体机制。
1 材料与方法
1.1主要试剂与仪器 胎牛血清及RPMI-1640培养基均购自美国Gibco公司,CCK-8试剂盒购自上海碧云天生物技术有限公司,Lipofectamine TM 2000转染试剂盒购自美国Invitrogen公司,Matri-gel基质胶及细胞培养基均购自美国BD公司,miR-328-5p和miR-NC(批号:121547)均购自上海美轩生物科技有限公司,兔抗人ITGA5多克隆抗体购自博奥派克生物有限公司、兔抗人ITGA5单克隆抗体购自美国Abcam公司,siRNA阴性对照、siRNA干扰试剂盒均购自上海生工生物工程有限公司。PCR仪(Applied Biosystems ABI7500)、化学发光仪(Promega 30IOC)、凝胶成像系统(Bio-rad ChemiDoc XRS)、流式细胞仪及透射电镜(Thermo fisher Spectra S/TEM)均购自美国,荧光显微镜(Olympus BX53)、光学显微镜(Olympus CX33)及相差显微镜(Olympus CKX53)均购自日本。
1.2方法
1.2.1细胞培养:乳腺癌MCF-7细胞购自美国ATCC细胞库。MCF-7细胞于含体积分数为10%胎牛血清的RPMI-1640培养基中进行培养,过程中加入青霉素-链霉素,然后置于37 ℃、体积分数为5% CO2的培养箱中进行恒温培养。根据细胞的生长速度及状态,每2~3天更换培养基,待细胞长至对数生长期时,用0.25%的胰酶消化,然后进行传代,或扩大培养,或进行试验。最后用胰酶消化处于对数生长期的MCF-7细胞,1000 r/min离心10 min,弃上清液,向沉淀中加入细胞冻存液(含10%甲基亚砜的培养基),混悬细胞后将其转移至细胞冻存管中,用封口膜封闭冻存管口,依次于4 ℃保存2 h,-20 ℃保存2 h,然后置于-80 ℃的低温冰箱中过夜,次日将细胞冻存管转移至液氮罐中长期保存。
1.2.2细胞转染:选取生长状态良好的乳腺癌MCF-7细胞,利用脂质体转染技术分别使用miR-328-5p mimics和si-ITGA5转染MCF-7细胞,用于后续实验。
1.2.3实验分组及处理:①miR-328-5p过表达时MCF-7细胞对Taxol敏感性:miR-NC组(转染阴性对照)、miR-328-5p组(转染miR-328-5p mimics)、miR-NC+Taxol组(转染阴性对照后加入50 nmol/L的Taxol培养MCF-7细胞24 h)及miR-328-5p+Taxol组(转染miR-328-5p mimics后加入50 nmol/L的Taxol培养MCF-7细胞24 h)。②干扰ITGA5后MCF-7细胞对Taxol敏感性:si-NC组(转染阴性对照)、si-ITGA5组(转染si-ITGA5)、si-NC+Taxol组(转染阴性对照后分别加入5、50、100 nmol/L的Taxol培养MCF-7细胞24 h)和si-ITGA5+Taxol组(转染si-ITGA5后分别加入5、50、100 nmol/L的Taxol培养MCF-7细胞24 h)。
1.2.4miR-328-5p、ITGA5 mRNA表达检测:采用qRT-PCR检测miR-328-5p、ITGA5 mRNA相对表达水平[8],使用RNA提取试剂盒从各组细胞中提取RNA,按照逆转录试剂盒Prime Script RT Reagent Kit和SYBR Prime Script miRNA RT-PCR Kit 试剂盒进行逆转录和qRT-PCR。通过计算机系统自动分析各个样本Ct值,采用2-ΔΔCt计算miR-328-5p、ITGA5 mRNA的相对表达量。
1.2.5细胞增殖:采用CCK-8实验检测细胞增殖情况[9],取各组对数生长期的MCF-7细胞胰酶消化后用牛鲍计数板计数。以每孔3000个细胞将不同浓度Taxol(5、50、100 nmol/L)处理的MCF-7细胞分别铺于96孔板中,培养48 h,加入10 μl CCK-8试剂,室温孵育4 h,使用酶标仪测定450 nm处OD值并计算MCF-7细胞增殖抑制率,增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%。
1.2.6细胞凋亡:采用Annexin-FITC/PI双染法检测各组MCF-7细胞凋亡情况[10],细胞经转染处理后,胰酶消化收集细胞,PBS洗涤,加入5 μl Annexin V-FITC和5 μl PI试剂室温避光孵育30 min后,190 μl结合缓冲液洗涤,1000 r/min离心5 min,使用PBS重悬细胞上机应用流式细胞术检测。记录汞激发波长488 nm处红色荧光。计数1000个细胞,计算细胞凋亡率,凋亡率=早期凋亡率+晚期凋亡率。
1.2.7ITGA5、微管相关蛋白1轻链3B(LC3B)及p62蛋白相对含量:采用Western Blot方法[11]测定ITGA5、LC3B及p62蛋白相对含量,使用蛋白提取试剂盒提取细胞总蛋白,通过BCA法测定蛋白浓度,根据目的蛋白和内参灰度值之比分析转染miR-328-5p及干扰ITGA5表达前后ITGA5、LC3B及p62蛋白的相对含量。
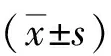
2 结果
2.1miR-328-5p转染效率 qRT-PCR检测结果显示,经转染后,miR-NC组和miR-328-5p组中miR-328-5p的相对表达量分别为1.08±0.02、127.64±3.07。转染miR-328-5p mimics后MCF-7细胞中miR-328-5p相对表达量显著提高,约为miR-NC组的118倍,比较差异具有统计学意义(P<0.01)。
2.2miR-328-5p对乳腺癌MCF-7细胞自噬水平的影响 miR-328-5p组、miR-NC+Taxol组LC3B-Ⅱ/LC3B-Ⅰ值显著低于miR-NC组,p62蛋白含量显著高于miR-NC组,差异有统计学意义(P<0.05);miR-328-5p+Taxol组LC3B-Ⅱ/LC3B-Ⅰ值均低于miR-NC+Taxol组和miR-328-5p组,p62蛋白含量均高于miR-NC+Taxol组和miR-328-5p组,差异有统计学意义(P<0.05)。见表1。
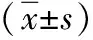
表1 miR-328-5p对乳腺癌MCF-7细胞自噬水平的影响
2.3miR-328-5p对乳腺癌MCF-7细胞ITGA5 mRNA及蛋白表达的影响 miR-328-5p组、miR-NC+Taxol组ITGA5 mRNA及蛋白表达均低于miR-NC组,差异有统计学意义(P<0.05);miR-328-5p+Taxol组ITGA5 mRNA及蛋白表达显著低于miR-NC+Taxol组和miR-328-5p组,差异有统计学意义(P<0.05)。见表2。
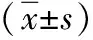
表2 miR-328-5p对乳腺癌MCF-7细胞ITGA5 mRNA及蛋白表达的影响
2.4干扰ITGA5后乳腺癌MCF-7细胞ITGA5 mRNA及蛋白表达情况 qRT-PCR分析显示,si-ITGA5组ITGA5 mRNA及蛋白表达水平分别为0.38±0.11及0.24±0.06,si-NC组分别为1.19±0.33及0.64±0.11。si-ITGA5组ITGA5 mRNA及蛋白表达水平显著低于si-NC组,差异有统计学意义(P<0.05)。
2.5干扰ITGA5后Taxol对MCF-7细胞自噬的影响 si-ITGA5组、si-NC+Taxol组(50 nmol/L)LC3B-Ⅱ/LC3B-Ⅰ值显著低于si-NC组,而p62蛋白含量显著高于si-NC组,差异有统计学意义(P<0.05)。si-ITGA5+Taxol组(50 nmol/L)LC3B-Ⅱ/LC3B-Ⅰ值均低于si-ITGA5组和si-NC+Taxol组,p62蛋白含量均高于si-ITGA5组和si-NC+Taxol组,差异有统计学意义(P<0.05)。见表3。
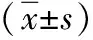
表3 干扰ITGA5后Taxol对乳腺癌MCF-7细胞自噬水平的影响
2.6干扰ITGA5后不同浓度Taxol对乳腺癌MCF-7细胞增殖、凋亡的影响 不同Taxol浓度时,si-ITGA5+Taxol组乳腺癌MCF-7细胞增殖抑制率及凋亡率均显著高于si-NC+Taxol组,差异统计学意义(P<0.05)。Taxol浓度50 nmol/L、100 nmol/L时,si-NC+Taxol组、si-ITGA5+Taxol组乳腺癌MCF-7细胞增殖抑制率及凋亡率均显著高于Taxol浓度5 nmol/L时,且Taxol浓度100 nmol/L时两组上述指标显著高于50 nmol/L时,差异有统计学意义(P<0.05)。见表4。
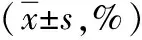
表4 干扰ITGA5后不同浓度Taxol对乳腺癌MCF-7细胞增殖、凋亡的影响
3 讨论
乳腺癌是女性最常见的恶性肿瘤,在女性癌症所致死亡中居首位[12-13]。流行病学数据显示,2018年全世界有210万左右新诊断乳腺癌病例,约占女性肿瘤病例的25%[14]。蒽环类药物、紫杉烷类药物和DNA损伤剂(环磷酰胺、氟尿嘧啶或铂类化合物)是临床上治疗乳腺癌的主要化疗药物。大量临床试验证明,Taxol是一种能抑制微管聚合从而抑制有丝分裂的天然药物,能显著提高乳腺癌患者的存活率,已成为乳腺癌辅助化疗的一线药物,然而近年来临床亦有不少文献报道患者在接受紫杉醇治疗后出现药物耐受,最终导致治疗失败[15-18]。
细胞自噬属于Ⅱ型程序性细胞死亡,属于机体抵御不良环境的一种自我保护机制,是通过隔离膜包裹细胞质和(或)细胞器形成自噬体,然后与溶酶体融合形成自噬溶酶体并在其中发生降解的过程,对维持细胞稳定有着较好的作用。随着生物学研究的不断深入,有研究提出,在肿瘤发生、进展过程中,细胞自噬起着关键作用,还可参与肿瘤化疗药物细胞毒性的发挥[19]。本组结果显示,转染miR-328-5p后,miR-328-5p组LC3B-Ⅱ/LC3B-Ⅰ值显著低于miR-NC组,而p62蛋白含量显著高于miR-NC组,且miR-328-5p+Taxol组上述指标较miR-NC+Taxol组更低或更高。由此提示,miR-328-5p的过度表达可抑制乳腺癌MCF-7细胞自噬作用。LC3B是与细胞自噬活性密切相关的基因,曾有文献证实,LC3B-Ⅰ的低表达与非小细胞肺癌的发生、进展密切相关[20]。本文进一步研究发现,经干扰ITGA5后发现,MCF-7细胞内ITGA5 mRNA及蛋白表达显著降低,且si-ITGA5组LC3B-Ⅱ/LC3B-Ⅰ值显著低于si-NC组,而p62蛋白含量显著高于si-ITGA5组,因此ITGA5表达与细胞的自噬也有着一定联系。ITGA5是整合素家族的重要成员,可与ITGβ1结合形成二聚体,是基质重要成分纤维连接蛋白的受体。近年来,ITGA5可通过调节细胞自噬和凋亡增加癌细胞对化疗药物敏感性的观点被不少学者提出[21],但尚未明确,仅有报道证实,ITGA5可诱导自噬作用发生[22]。本文进一步分析miR-328-5p与ITGA5的关系发现,经转染miR-328-5p后,乳腺癌MCF-7细胞内ITGA5 mRNA及蛋白表达含量显著降低。且在先前研究基础上,本文将干扰ITGA5与Taxol联合处理乳腺癌MCF-7细胞发现,不同Taxol浓度时,si-ITGA5+Taxol组细胞增殖抑制率及凋亡率均显著高于si-NC+Taxol组,且随着Taxol浓度升高细胞增殖抑制率及凋亡率均呈上升趋势。提示干扰ITGA5后乳腺癌MCF-7细胞对Taxol的敏感性增强。因此,干扰ITGA5的表达可通过抑制细胞的自噬作用和诱导细胞凋亡,从而提高MCF-7细胞对Taxol的敏感性。
miR-328-5p可增强乳腺癌MCF-7细胞对化疗药物Taxol的敏感性,作用机制可能与miR-328-5p通过抑制ITGA5表达,从而抑制细胞自噬相关。

