室管膜下瘤的临床特征和预后
李韵霏,高献争,韩静,杜倩,李晟磊
(郑州大学第一附属医院 病理科,河南 郑州 450052)
室管膜下瘤是一种罕见的良性神经系统肿瘤,可发生于整个中枢神经系统,生长相对缓慢,世界卫生组织(World Health Organization,WHO)分级为Ⅰ级。室管膜下瘤约占中枢神经系统肿瘤的0.51%[1],既往多为个案报道。室管膜下瘤与其他低级别中枢神经系统肿瘤,如室管膜瘤、中枢神经细胞瘤等均比较少见,形态学具有一定的相似性,因此病理诊断中存在误诊现象。本研究收集了26例室管膜下瘤患者的临床资料,观察分析其临床及影像学表现,总结其病理组织学、免疫组化、治疗及预后特征,以期提高病理诊断医生对该病的认识。
1 资料与方法
1.1 病例资料 收集郑州大学第一附属医院病理科2012年1月1日至2021年9月30日共26例室管膜下瘤的手术切除标本。在病例筛选过程中,病例均经2名以上有经验的病理诊断医生重新阅片确诊。收集患者的临床影像学资料、病理组织学及免疫组化改变,并通过电话随访,自确诊之日起至患者死亡或2021年10月5日,随访时间为5~114个月,随访内容包括治疗和生存情况。
1.2 方法 所有病例均由体积分数为10%的中性甲醛溶液固定,常规经脱水、包埋、苏木精-伊红(hematoxylin-eosin,HE)染色,并进行相关免疫组化标记检测。免疫组化检测时,采用罗氏Benchmark Ultra全自动免疫组织化学机器进行染色,并由罗氏自动免疫组化染色机进行染色。不同的病例由于其诊断时间、诊断医生的差异,诊断所用抗体的数量和种类稍有差异。本研究在诊断过程中共用了17种抗体,主要抗体见表1。二抗试剂盒均购自北京中杉金桥生物技术有限公司,按试剂盒说明进行操作。
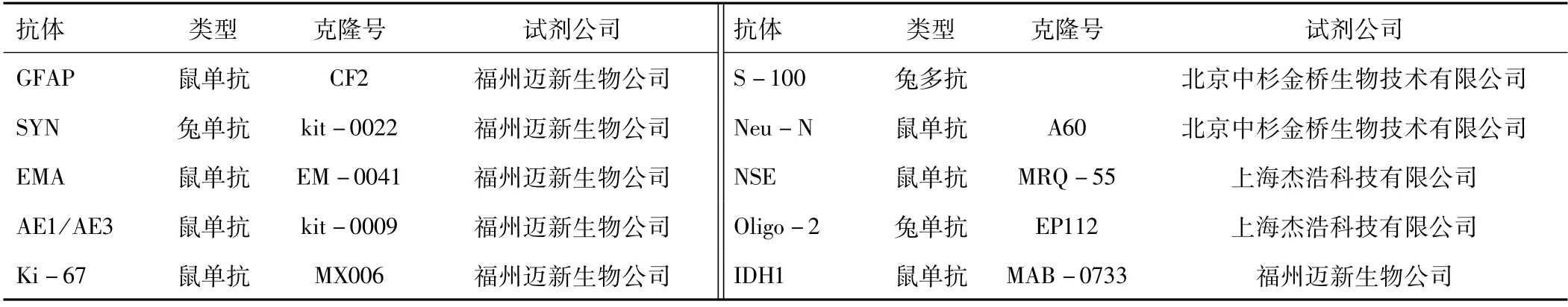
表1 主要抗体类型及其他情况
2 结果
2.1 临床资料
2.1.1 一般资料 26例患者中男15例,女11例,男女之比约为1.3∶1;发病年龄为27~66岁,中位年龄44岁。
2.1.2 肿瘤位置和大小 肿瘤主要位于颅内24例(92.3%),位于颈髓2例。在24例颅内肿瘤中,位于脑室22例(84.6%),包括左侧脑室11例,右侧脑室8例,双侧脑室同时累及3例;位于脑实质2例(左颞叶和右顶叶各1例)。22例颅内肿瘤肿块体积中等大小,最大径为2.1~8.1 cm,平均3.4 cm。颈髓内为长条形肿块,长径分别为6.1 cm和8.0 cm。
2.1.3 磁共振成像(magnetic resonance imaging,MRI) 肿瘤的MRI图像呈团块状影,16例界限清(61.5%,16/26),余10例界限欠清。其中,16例获得详细的MRI表现,余10例仅见外院MRI结果,无详细的MRI记录。这16例患者的MRI多为长T1长T2信号(75.0%,12/16),1例为长T1信号影,1例为等T1混杂短T2信号影,1例等长T1混杂长短T2信号影,1例呈等长T1稍长T2信号。增强扫描示7例轻度点状或点片状强化,3例明显不均匀强化,6例均无强化(见图1A~C)。

图1 室管膜下瘤的MRI表现
2.1.4 临床症状、病程和术中情况 患者的主要临床表现为头痛(65.4%,17/26),头晕(30.4%,7/23),少数病例表现为视物不清或视力下降(13.6%,3/22),少数病例伴有恶心呕吐(13.6%,3/22),1例仅表现为一过性晕厥,1例伴有嗜睡。3例患者仅在体检时发现占位,均无任何临床症状。2例颈髓内占位患者中1例表现为双手麻木无力,1例表现为间断性右侧肢体疼痛。发病病程长短不一,最短的仅3 h,最长的为10余年。术中见肿块多为实性(88.5%,23/26),3例为囊实性,14例可见与周围脑室壁粘连,3例伴有局部钙化。
2.2 病理学特点 26例均为手术切除肿瘤标本。标本大体灰白、灰红色,切面灰白,质地较软或中等。其中21例送检时均为破碎组织,余5例中3例似有包膜。显微镜下低倍多呈分叶状,高倍主要表现为丰富胶质纤维基质背景中见簇状分布的细胞核,部分呈束状流水状排列,无明显细胞膜界限,多数簇状细胞间或周围微囊形成,细胞核小至中等大小,圆形或卵圆形,形态一致,几乎不见核分裂(图2)。少数病例核增大(11.5%,3/26);1例局部出现少许出血坏死伴核分裂增多(每10个高倍视野下见2个),但核分裂均为非病理性核分裂。部分病例肿瘤组织内可见局灶间小血管增生,血管壁增厚伴水肿及玻璃样变(23.0%,6/26);2例肿瘤组织局灶见Rosenthal纤维和嗜酸性颗粒小体;3例伴局灶出血机化;1例肿瘤内大囊形成;2例患者局灶呈室管膜瘤形态学改变(即局部围绕血管呈放射状生长/假菊性团),且其中1例可见奇异核细胞和多核细胞,但核分裂罕见;2例患者合并血管畸形及乳头状血管内皮增生。
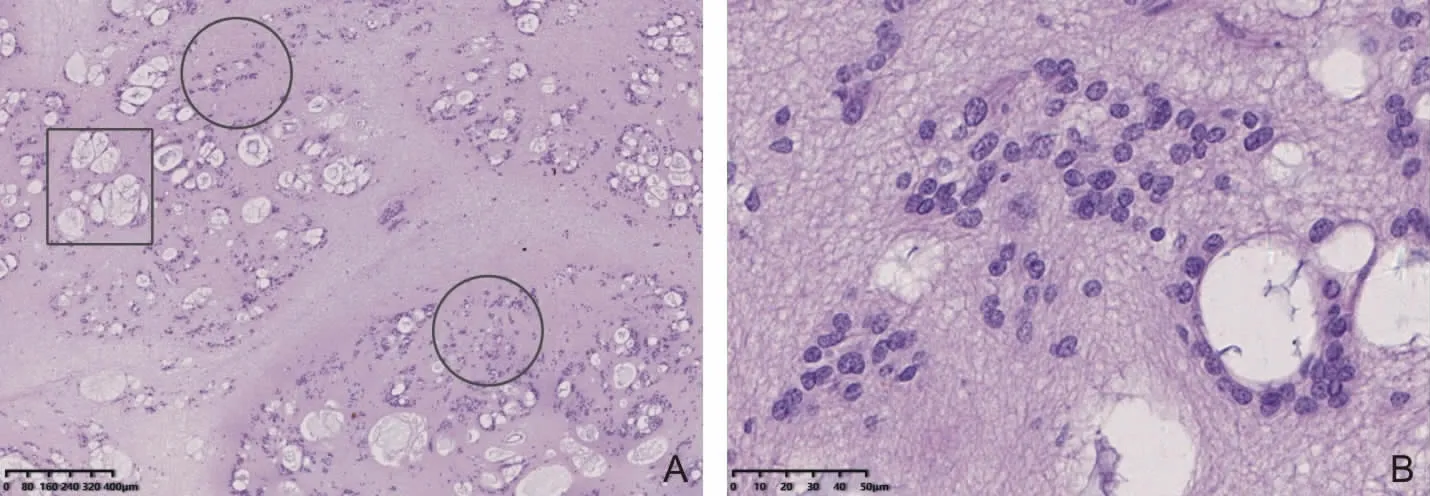
图2 室管膜下瘤病理组织学特点
2.3 免疫组化特点 20例患者进行了免疫组化检测,余6例未行免疫组化直接诊断,所有病例未进行分子检测。肿瘤细胞表达S-100(100.0%,20/20)(图3A)、GFAP(100.0%,20/20)(图3B),部分表达NSE(66.7%,2/3);肿瘤细胞不表达EMA(0/19),但其中2例可见小灶EMA核旁点状阳性,而1例为混合性室管膜瘤(WHO分级Ⅱ级)/室管膜下瘤;肿瘤组织不表达Oligo-2,但多数背景可见散在个别Oligo-2的表达(70.0%,14/20)(图3C),不表达Syn(0/16)、Neu-N(0/14)、IDH1(0/6)和AE1/AE3(0/5);肿瘤细胞Ki-67增殖指数较低,15例均<1%(图3D),3例患者稍升高,但均<5%。

图3 室管膜下瘤免疫组化特点
2.4 治疗 所有病例经MRI诊断后,临床神经外科医生均选择手术全部切除肿瘤组织。最终24例病理诊断为室管膜下瘤,WHO分级Ⅰ级;2例诊断为混合性室管膜瘤/室管膜下瘤,WHO分级Ⅱ级。
2.5 随访 随访时间为5~114个月,平均53个月。26例患者中8例失访,18例获得随访结果,其中1例因脑疝于确诊4个月后死亡,其余17例均存活,但1例术后4个月复发,患者自觉症状不明显,未再要求进一步治疗。
3 讨论
室管膜下瘤是室管膜肿瘤的一个亚类,相当于WHO分级Ⅰ级[2],常见于中老年人,少见于儿童[3]。颅内室管膜下瘤仅占所有颅内肿瘤的0.07%~0.7%[4]。室管膜下瘤发生于颅内时,好发于第四脑室和侧脑室[5],在脊髓处则好发于颈髓和颈-胸段脊髓[6]。室管膜下瘤的发病机制目前仍不明确。有研究提出室管膜下瘤来源于室管膜胶质前体细胞、室管膜下板的星形胶质细胞或混合性星形细胞与室管膜细胞[7]。
本研究显示,室管膜下瘤的发病年龄为27~66岁,中位年龄44岁,男性多于女性,与既往研究结果[8-9]一致。本研究收集病例中,84.6%(22例)的肿瘤位于侧脑室,剩余病例(4例)分别位于脑实质和脊髓,未见发生在第三或第四脑室的病例。侧脑室是最常见的位置,这与既往研究结果[9-11]较一致。室管膜下瘤患者的早期症状不明显,通常经影像学或尸检偶然发现[12],所以该病的自然病程仍然不明确。Maiuri等[13]认为40%的室管膜下瘤存在不稳定的休眠期,最终才会表现出症状。本研究发现室管膜下瘤的主要表现为头痛、头晕,少数患者存在视物不清或恶心呕吐,此时做头颅MRI检查,肿物占位效应已比较明显,结合发病部位、年龄、边界及MRI信号特点,借助影像学易于做出低级别胶质瘤的诊断,部分会考虑到室管膜下瘤的诊断,但难以与中枢神经细胞瘤和室管膜瘤鉴别。尤其针对脑实质和脊髓内的病变,影像学诊断和鉴别诊断更加困难。本组室管膜下瘤的MRI均表现为实性团块状影,增强扫描多无强化或伴轻度强化[14]。这些特点可能有助于与室管膜瘤、室管膜下巨细胞星形细胞瘤、毛细胞型星形细胞瘤鉴别。
室管膜下瘤具有相对特异性的组织病理学特征,长期从事神经病理学专业的诊断医生易于做出明确诊断,针对典型病例甚至不需要免疫组化的协助可以直接诊断。本研究病例中组织病理学绝大多数为单纯室管膜下瘤(92.3%),有1例为混合性室管膜瘤-室管膜下瘤,WHO分级为Ⅱ级(7.7%),与Kweh等[15]统计结果一致。但由于室管膜下瘤罕见,综合医院病理医生往往经验不足,可能会误诊为其他类型的低级别胶质瘤,尤其是位于脑实质、脊髓等不常见部位的病变,需要与以下疾病鉴别。(1)室管膜瘤与室管膜下瘤有较多相似之处,容易导致二者混淆,如常发生在脑室和颈胸段脊髓,也表现为头痛、眩晕、视觉障碍等,MRI显示边界清楚,显微镜下细胞形态单一,几乎不见核分裂等,但是前者好发于儿童和年轻人,MRI常出现中度至明显的强化,典型的组织学改变是形成真假菊形团,即瘤细胞围成中空的腔或放射状围绕血管,间质为富于GFAP蛋白的胶质纤维无核区,免疫组化瘤细胞大部分EMA阳性,可与室管膜下瘤鉴别。但有时二者可以合并发生[7],应注意避免漏诊。(2)中枢神经细胞瘤常发生在侧脑室或第三脑室,临床表现为头痛、头晕等颅内压升高的症状,MRI显示边界清楚,瘤细胞圆形一致,核分裂罕见等与室管膜下瘤相似,但中枢神经细胞瘤好发于年轻人,镜下见胞质空亮,排列紧密,呈少突胶质瘤样的蜂巢状,可见不规则菊形团,间质毛细血管呈分枝状,可有灶性坏死及砂粒体,免疫组化示肿瘤细胞Syn及Neu-N弥漫强阳性,GFAP及S-100仅部分阳性,可与室管膜瘤鉴别。(3)室管膜下巨细胞星形细胞瘤常发生于侧脑室壁,表现为头痛、呕吐等颅内高压的症状,MRI显示边界清楚,但好发于20岁以下青少年,MRI呈现明显强化,瘤细胞包括巨细胞和小胶质细胞,常伴有TSC1/2基因突变,易与室管膜下瘤鉴别。(4)毛细胞型星形细胞瘤是一种界限较清、缓慢生长的WHO分级为Ⅰ级的胶质瘤,但其常发生于儿童和年轻人,影像常为大囊及囊内附壁小结节改变,镜下由含Rosenthal纤维的密集双极梭形细胞和含微囊、嗜酸性颗粒小体/透明滴的疏松多极细胞构成,此为重要诊断及鉴别诊断特征。当室管膜下瘤局部出现Rosenthal纤维和酸性颗粒小体时,需要注意与毛细胞型星形细胞瘤鉴别。
室管膜下瘤的分子遗传改变尚不清楚。Fischer等[16]研究发现,33%(2/6)的散发性室管膜下瘤样本中存在TRPS1突变及其遗传性(主要是功能)丧失。Kong等[17]研究显示,拓扑异构酶抑制剂(WP744)和p-STAT3/HIF-1α抑制剂(WP1066)对室管膜下瘤细胞的增殖有抑制作用。对500例室管膜肿瘤(包括室管膜下瘤)进行DNA甲基化图谱分析,显示肿瘤分子生物学在不同的解剖部位是异质的,并鉴定出9个分子亚组,提出将其作为下个WHO中枢神经系统肿瘤的分类基础[18]。该研究显示后颅窝和脊髓的室管膜下瘤常发生6号染色体完全或部分丢失,而幕上室管膜下瘤则完全无此改变[18]。
室管膜下瘤的预后良好,5 a总生存率为89.2%[15]。本研究中病例的肿瘤细胞Ki-67增殖指数低,58%的病例增殖指数<1%,有3例虽稍升高,但均<5%,这与该肿瘤的缓慢生长模式相符。手术切除可以治愈室管膜下瘤[9],但不完全切除可能复发。在本研究中,有1例患者术后并发脑疝4个月后死亡,1例患者术后4个月复查发现肿瘤复发。此例复发患者的组织学表现为局部伴有出血坏死和非病理性核分裂增多,这很好地解释了该患者复发的可能原因。室管膜下瘤的复发率很低,但即使在完全切除后也可能复发[19],尤其在有出血坏死等继发改变和Ki-67增殖指数较高的患者中。
综上所述,室管膜下瘤为罕见的低级别中枢神经系统肿瘤,具有典型的影像学和组织病理学特点,手术切除后预后良好,复发率较低。需注意和其他低级别胶质瘤鉴别,其分子病理学改变仍有待进一步研究。

