滤泡辅助性T细胞在自身免疫病中作用的研究进展
卫欣迪,钮晓音
1.上海交通大学医学院上海市免疫学研究所,上海 200025;2.上海交通大学口腔医学院,上海 200125
滤泡辅助性T 细胞(follicular helper T cell,Tfh细胞)属于CD4+T 细胞亚群,可促进B 细胞的成熟与分化及抗体的产生,并支持生发中心(germinal center,GC)的形成[1]。目前研究认为,Tfh 细胞在系统性红斑狼疮、类风湿性关节炎、原发性干燥综合征、系统性硬化病、重症肌无力、炎症性肠病等多种自身免疫病的发病机制中发挥着重要作用。本文对Tfh 细胞及其在自身免疫病中作用的研究进展作一综述,旨在进一步揭示Tfh 细胞在自身免疫病发病机制中的作用,为疾病的治疗提供新的线索。
1 Tfh细胞的生物学特性
Tfh 细胞最初在扁桃体淋巴滤泡内的GC 中被发现[2],主要来源于CD4+初始T细胞,具有支持GC形成、决定GC 中的B 细胞分化为记忆B 细胞(memory B cell,Bm细胞)或浆细胞,以及促进抗体产生的功能[3]。Tfh 细胞的特征性功能分子包括表面分子、转录因子、细胞因子(图1)。
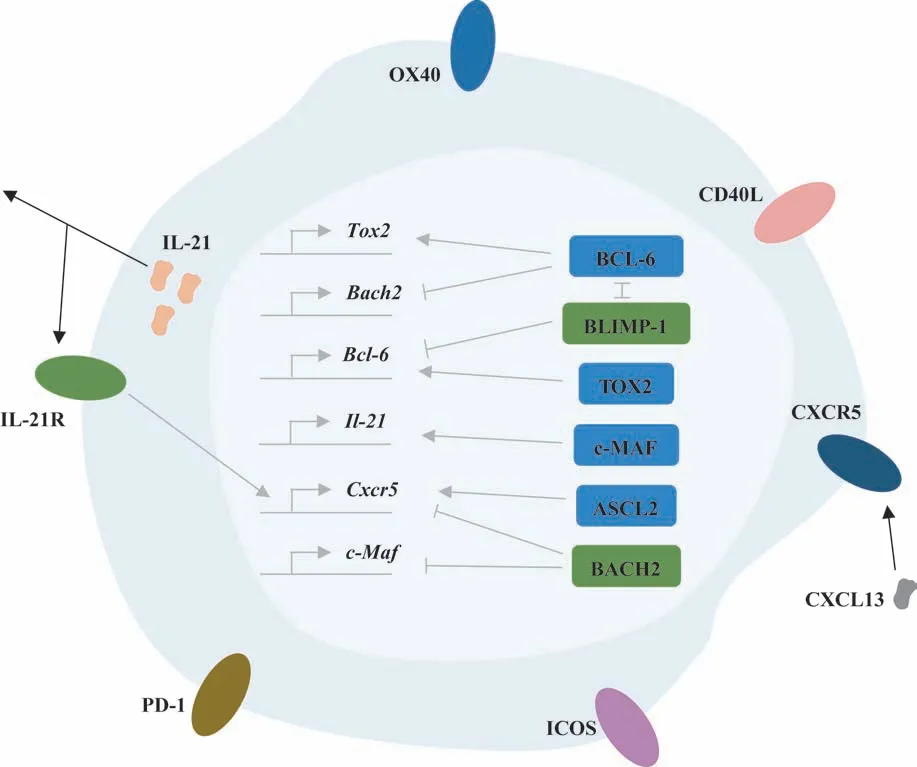
图1 Tfh细胞及其主要功能分子Fig 1 Tfh cell and its main functional molecules
1.1 表面分子
Tfh细胞的表面分子包括:C-X-C趋化因子受体5(C-X-C motif chemokine receptor type 5,CXCR5)、可诱导共刺激分子(inducible co-stimulator,ICOS)、CD40 配体(CD40 ligand,CD40L)、肿瘤坏死因子受体超家族成员4 (tumor necrosis factor receptor superfamily member 4,OX40)、程序性死亡受体-1(programmed cell death protein 1,PD-1)等。
CXCR5在Tfh细胞表面高表达。在C-X-C趋化因子 配 体 13 (chemokine C-X-C motif ligand 13,CXCL13)的作用下,CXCR5 介导Tfh 细胞迁移至淋巴滤泡的T 细胞-B 细胞交界处并与B 细胞相互作用[4]。
ICOS 表达水平的上调为Tfh 细胞分化的重要检查点。ICOS 配体(ICOS ligand,ICOSL)主要表达于抗原提呈细胞表面[5]。ICOS/ICOSL 通过磷脂酰肌醇3 激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(phosphatidylinositol 3 kinase/protein kinase B/mammalian target of rapamycin, PI3K/AKT/mTOR)信号通路转导活化信号[6],促进Tfh 细胞分化、迁移至淋巴滤泡,并参与GC 的形成[5]。WAN 等[7]研究发现,细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)通路可抑制锌指蛋白831 (zinc finger protein 831, ZFP831) 的 表 达,ZFP831 可通过上调B 细胞淋巴瘤分子6 (B cell lymphoma 6,BCL-6) 和转录因子7 (transcription factor 7,TCF7)的表达来促进Tfh 细胞分化。ICOS对抑制Tfh 细胞分化的ERK 通路无激活效应。
Tfh 细胞表面的CD40L 可与B 细胞表面的CD40作用,促进B 细胞的增殖、分化及抗体类别转换[5]。较强的CD40/CD40L作用可促进B细胞表面ICOSL的表达,从而进一步促进Tfh、B 细胞间的相互活化,产生高亲和力的B 细胞并使之分化为更长寿的浆细胞[8]。一般认为,CD40L 与CD40 相互作用可启动B细胞的活化,而后CD40L 被辅助性T 细胞内吞;但GARDELL 等[9]研究发现,当CD40L 与CD40 作用时,CD40L 将脱离辅助性T 细胞并转移至B 细胞表面,为B细胞的活化提供持续刺激。
OX40 与OX40 配体(OX40 ligand,OX40L)的相互作用是Tfh 细胞的又一重要共刺激信号[10]。OX40/OX40L 主要通过核因子κB(nuclear factor κB,NF-κB) 及PI3K/AKT 通 路 转 导 活 化 信 号,上 调CXCR5、BCL-6、白 细 胞 介 素-21 (interleukin-21,IL-21)、CXCL13 的表达水平,促进Tfh 细胞的分化与成熟,并增强GC反应[11]。
PD-1 通过与程序性死亡配体-1 (programmed cell death protein ligand 1,PD-L1)结合以抑制ICOS活化信号,从而抑制Tfh细胞的增殖。PD-1缺陷可引起Tfh 细胞数量的异常增多,导致过度的B 细胞增殖及抗体产生[12]。
1.2 转录因子
转录因子包括BCL-6、胸腺细胞选择相关HMG盒 蛋 白2 (thymocyte selection-associated HMG box protein 2,TOX2)、BTB 和CNC 同源物2(BTB and CNC homolog 2,BACH2)、achaete-scute 复合物同系物2(achaete-scute complex homologue 2,ASCL2)。
BCL-6 与促进CD4+T 细胞向Th1、Th2、Th17 等亚群分化的转录因子相拮抗[1],是Tfh细胞分化所必需的转录因子,可促进B 细胞活化及GC 形成[5]。BCL-6 可被B 淋巴细胞诱导成熟蛋白1 (B lymphocyte induced maturation protein1, BLIMP-1)拮抗;BLIMP-1 还可抑制BCL-6 的表达,阻止CD4+T细胞向Tfh细胞分化[1]。
TOX2 可增加Tfh 细胞相关基因的染色质可及性并促进Tfh 细胞成熟。BCL-6 可上调TOX2 的表达,而TOX2 表达的上调则可进一步促进BCL-6 的表达。TOX2 的表达还受信号转导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)的调节。在STAT3缺陷的CD4+T细胞中,TOX2的表达水平下调[13]。
ASCL2 可促进T 细胞表达CXCR5,降低C-C 趋化因子受体7(C-C chemokine receptor 7,CCR7)的表达,但却不影响BCL-6 的表达水平[14]。ASCL2 可能通过诱导NF-κB 抑制蛋白(inhibitor of NF-κB,IκB)家族成员IκBδ,即IκBNS的表达,促进CXCR5的表达[15]。体内上调ASCL2 的表达水平可加速T 细胞向淋巴滤泡迁移,并促进Tfh 细胞的发育[14]。在CD4+T 细胞内特异性敲除Ascl2基因或阻断ASCL2 的功能,会导致Tfh 细胞发育异常,并影响GC 的正常反应[16]。
BACH2 是负向调控Tfh 细胞的转录因子,可直接抑制Cxcr5和肌腱膜纤维肉瘤原癌基因转录因子(c-musculoaponeurotic-fibrosarcoma,c-Maf) 基 因 的转录。BACH2 通过抑制致病性Tfh 细胞的增殖从而减轻自身免疫反应。BCL-6 可直接与Bach2基因启动子区域结合以抑制Bach2的转录[17]。
1.3 细胞因子
IL-21 是Tfh 细胞分泌的重要细胞因子,c-MAF可促进其表达[18]。IL-21 主要通过与B 细胞表面的IL-21 受 体(IL-21 receptor,IL-21R) 结 合 以 激 活Janus激酶(Janus kinase,JAK)-STAT信号通路,从而活化B 细胞,促进B 细胞增殖、亲和力成熟及分化为浆母细胞[19]。Tfh 细胞表面同样表达IL-21R,可能通过自分泌作用促进Tfh 细胞高水平表达CXCR5并向GC趋化[5,20]。
1.4 Tfh细胞的分类
依据Tfh细胞的定位,可将其分为GC中的Tfh细胞与外周血中的循环Tfh 细胞(circulating Tfh cell,cTfh 细胞)2 类,通常Tfh 细胞主要指GC 中的Tfh细胞。
cTfh细胞是外周血中的一群支持B细胞分化与抗体类别转换的Tfh细胞。除定位与GC中的Tfh细胞不同外,cTfh 细胞还不表达BCL-6。根据cTfh 细胞表面CXCR3、CCR6 的表达情况,可将cTfh 细胞分为cTfh1、cTfh2、cTfh17 细 胞3 种 亚 型[21]。cTfh2、cTfh17 细胞可分泌IL-21、诱导初始B 细胞分化为浆细胞并分泌免疫球蛋白(immunoglobulin,Ig),同时促进抗体类别转换;cTfh1 细胞不能诱导初始B 细胞分泌Ig,但ICOS+PD-1++cTfh1 细胞可通过分泌IL-21诱导Bm 细胞分化为浆细胞[22]。目前对于cTfh 细胞是起源于GC 中的Tfh 细胞,还是Tfh 细胞的前体细胞,尚存在争议,有待进一步研究。
此外,滤泡调节性T 细胞(follicular regulatory T cell,Tfr细胞)也是许多自身免疫病中存在的一类重要细胞。其具有双重特性,既表达Tfh 细胞的特征性分子CXCR5、BCL-6、PD-1、ICOS,又表达调节性T 细胞(regulatory T cell,Treg 细胞)的特征性转录因子叉头/翼状螺旋转录因子3 (forkhead/winged helix family transcription factor 3,FOXP3)。Tfr 细胞主要来源于胸腺Treg 细胞,在脾脏、淋巴结等淋巴组织与外周血中均存在,可抑制B细胞分化与抗体亲和力成熟,并在GC 中发挥抑制B 细胞和Tfh 细胞的作用[23]。
2 Tfh 细胞在不同类型自身免疫病中的作用
2.1 Tfh细胞与系统性红斑狼疮
系统性红斑狼疮是一种以免疫耐受的丧失与高亲和力自身抗体的产生为主要特征的慢性全身性自身免疫病。具有免疫原性的自身DNA 通过维甲酸受体相关孤儿核受体γt(retinoic acid receptor-related orphan nuclear receptor γt,RORγt)可激活非ICOS依赖性的IL-17+Tfh 细胞。在人源化小鼠模型中敲低RORγt和阻断IL-17,可抑制Tfh细胞的功能,改善IgG 反应和狼疮性肾炎[24]。转录因子腺病毒E4 启动子结合蛋白(adenovirus E4 promoter-binding protein,E4BP4)的功能缺陷与系统性红斑狼疮疾病活动性密切相关。E4BP4通过直接与Bcl-6基因的启动子区域结合,招募组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1)、组蛋白甲基转移酶zeste 增强子同源物2(enhancer of zeste homolog 2,EZH2),抑制BCL-6 的转录,进而抑制Tfh 细胞分化。在系统性红斑狼疮中,E4BP4 的功能受损,致使Tfh细胞过度增殖分化[25]。系统性红斑狼疮患者异常产生的Ⅰ型干扰素(interferon,IFN)通过激活STAT4促进Tfh细胞分泌IL-21与IFNγ,导致B 细 胞 功 能 亢 进[26]。 长 链 非 编 码RNA (long noncoding RNA,lncRNA)AC007278.2在系统性红斑狼疮中通过作用于CCR7基因的启动子区域下调Tfh细胞中CCR7的表达,促进Tfh细胞分化[27]。
许多系统性红斑狼疮患者同时患有高催乳素血症,且其催乳素水平与疾病活动性呈正相关[28]。在狼疮鼠中,催乳素可作用于表达长亚型催乳素受体的Tfh细胞,通过STAT3 促进Tfh 细胞活化信号的转导;催乳素还可提高Tfh 细胞OX40 及IL-21 的表达水平,导致Tfh细胞数量增加和功能亢进[29]。
Tfh 细胞的激酶同源域相互作用蛋白激酶1(homeodomain interacting protein kinase 1,HIPK1)基因与畸形样激酶1 (misshapen-like kinase 1,MINK1)基因的单核苷酸多态性与系统性红斑狼疮的发病相关。用HIPK1、MINK1 抑制剂处理Tfh 细胞,可抑制其分泌IL-21 的能力[30]。EZH2 在Tfh 细胞中的高水平表达可促进系统性红斑狼疮的发病,抑制EZH2可减少Tfh细胞数量,从而抑制GC形成和抗体产生[31]。
2.2 Tfh细胞与类风湿性关节炎
类风湿性关节炎是一种以关节囊和滑膜的慢性炎症为主要特征的自身免疫病,可导致软骨损伤、骨侵蚀、关节破坏与畸形。类风湿性关节炎患者的滑膜组织中Tfh 细胞数量多于骨关节炎患者[32],外周血中cTfh细胞比例显著高于正常人[33]。
类风湿性关节炎中Tfh 细胞通过OX40 降低自身抗体的唾液酸化水平。阻断OX40 可减少Tfh 细胞数量、恢复自身抗体的唾液酸化水平,从而抑制关节炎的发展[34]。相较于正常人,类风湿性关节炎患者Tfh细胞中BCL-6 的表达水平升高,而BLIMP-1 的表达水平降低[35]。患者CD4+T 细胞中磷酸化的STAT3 水平急剧升高、血浆中IL-6 水平升高,且两者分别与Tfh 细胞比例呈正相关。异常水平的IL-6、STAT3 使患者Tfh 细胞的IL-6/STAT3 信号轴过度激活,从而导致Tfh 细胞的异常活化[36]。除此之外,类风湿性关节炎患者血清IL-21 水平高于正常人,且其与疾病活动性、血清自身抗体水平呈正相关[37]。患者滑膜组织中的Bm 细胞高表达IL-21R[38],IL-21/IL-21R 可促进B细胞的活化、增殖与分化[3]。
2.3 Tfh细胞与原发性干燥综合征
原发性干燥综合征是一种主要累及唾液腺、泪腺等外分泌腺的慢性自身免疫病。患者外分泌腺的分泌功能丧失,出现口干、眼干等症状。患者的活化cTfh细胞比例显著增加,且存在cTfh/Tfr 细胞比值的升高。异常水平的Tfh 细胞通过Tfh-B 细胞轴促进原发性干燥综合征的发生[39]。
患者Tfh 细胞中存在ASCL2 的过度表达[16]。阿巴西普、抗ICOSL 单抗可通过下调ICOS 水平或阻断ICOS/ICOSL 信号以抑制Tfh 细胞的活化,改善原发性干燥综合征患者的症状[40-41],提示Tfh 细胞ICOS表达水平的异常升高可能促进疾病发生。DNA 结合抑制因子3(inhibitor of DNA binding 3,ID3)可抑制CXCR5 表达,而转录因子配对盒蛋白3(paired box protein 3,PAX3)可通过与Id3基因启动子结合启动其转录。原发性干燥综合征患者中Tfh 细胞存在ID3、PAX3 的表达异常下调,异常升高的IL-21 可通过抑制PAX3、ID3的表达促进疾病的发生[42]。
2.4 Tfh细胞与系统性硬化病
系统性硬化病是一种以皮肤纤维化、微血管病变和自身抗体产生为特征的自身免疫病。患者皮损中存在Tfh细胞浸润;同时,患者cTfh细胞数量增加,其数量与疾病严重程度呈正相关,尤其与微血管病变和器官受累高度相关[43-44]。系统性硬化病中还存在Tfh细胞的亚群失衡。患者血清中Tfh1、Tfh17 细胞的水平升高,且Tfh1 细胞的比例与自身抗体滴度、IL-21浓度呈正相关[43]。
Tfh 细胞可能通过IL-21 和基质金属蛋白酶12(matrix metalloproteinase 12,MMP12) 依赖性机制促进皮肤纤维化[45]。系统性硬化病患者Tfh 细胞分泌IL-21 的能力增强并高表达BCL-6;其诱导B 细胞分化并分泌IgG、IgM 的能力亦高于正常人。用JAK1/2 抑制剂鲁索利替尼处理系统性硬化病患者的cTfh 细胞,可显著降低其分泌IL-21 以及诱导浆母细胞分化的能力[19]。
2.5 Tfh细胞与重症肌无力
重症肌无力是一种由自身抗体介导的、以神经肌接头功能障碍为特征的自身免疫病,患者出现骨骼肌无力等症状。重症肌无力患者高表达ICOS 的cTfh 细胞的数量增加,且患者cTfh 细胞的比例与疾病严重程度呈正相关[46]。
IL-37 可通过与Tfh 细胞表面的单免疫球蛋白白介素-1 受体相关蛋白(single immunoglobulins IL-1-related receptor,SIGIRR)作用抑制STAT3 信号,从而抑制Tfh 细胞的增殖分化。重症肌无力患者Tfh 细胞IL-37mRNA 以及外周血中IL-37 的水平均低于正常人[47]。
正常情况下,Tfh 细胞受到自然杀伤细胞(natural killer cell,NK 细胞)的负向免疫调节。而在重症肌无力中,NK 细胞对Tfh 细胞的杀伤功能受损,促进Tfh细胞增殖分化的功能增强[48]。
2.6 Tfh细胞与炎症性肠病
炎症性肠病以肠道炎症为特点,主要包括克罗恩病和溃疡性结肠炎。炎症性肠病患者外周血中BCL-6与IL-21mRNA 的水平显著高于正常人;患者肠道组织GC 中,Tfh 细胞数量明显增加,Tfr 细胞数量减少。BCL-6 与IL-21 通过调节肠道组织GC 中Tfh/Tfr细胞的比例促进炎症性肠病的发生发展[49]。干扰素调节因子8(interferon regulatory factor 8,IRF8)通过抑制IRF4 对Il-21基因启动子区域的DNA 结合活性,抑制Tfh 细胞的分化;IRF8 还可抑制Tfh 细胞表面CD40L的表达。Irf8基因缺陷将促进CD4+T细胞向Tfh细胞分化,并加重小鼠的结肠炎症状[50]。乌司奴单抗是一种针对IL-12/IL-23 p40 的单克隆抗体[51],可抑制Tfh 细胞的分化、降低克罗恩病患者体内GC的活性,从而起到治疗克罗恩病的效果[52],提示IL-12、IL-23 或通过促进Tfh 细胞的分化促进炎症性肠病的发生。
正常情况下,Tfh 细胞介导的GC 反应受到Tfr 细胞的负向免疫调节[23],而细胞毒性T 淋巴细胞相关蛋白4 (cytotoxic T lymphocyte-associated protein 4,CTLA-4) 与Tfr 细胞的分化密切相关。在小鼠CD4+T 细胞中,CTLA-4 的缺陷会使Tfr 细胞分化受限,导致Tfh细胞水平相对提高和GC反应增强,使自身抗体在肠上皮细胞中积累,最终导致肠道损伤[53]。
2.7 Tfh细胞与其他自身免疫病
特发性视神经炎与视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)均以累及视神经的炎症为特征。患者cTfh 细胞比例显著高于正常人[54]。NMOSD 患者cTfh 细胞的比例及血清中CXCL13 的水平均与急性NMOSD 的严重程度呈正相关[55],提示Tfh 细胞或在疾病的进展中发挥重要作用。
原发性抗磷脂抗体综合征是一种累及多器官的自身免疫病。患者循环Tfr 细胞水平显著降低,而Tfh/Tfr 细胞比值升高;同时,患者血清自身抗体水平与Tfh细胞水平呈正相关[56]。
多发性硬化(multiple sclerosis,MS)是一种以中枢神经系统炎症和神经元脱髓鞘为特征的神经炎性疾病。在MS 的动物模型——实验性自身免疫性脑脊髓 炎(experimental autoimmune encephalomyelitis,EAE)小鼠的中枢神经系统中存在大量Tfh 细胞浸润,且Tfh 细胞比例增加[57]。MS 患者血液及脑脊液中具有较高的Tfh/Tfr 细胞比例,且其异常的IgG 水平与Tfh/Tfr细胞比值呈正相关[58]。
天疱疮是一种以皮肤、黏膜出现水疱和糜烂为特征的自身免疫病。天疱疮患者外周血中Tfh17 细胞水平升高。这群细胞主要通过诱导B细胞产生桥粒芯蛋白特异性自身抗体促进疾病的发生[59]。
3 总结与展望
Tfh 细胞是一种对B 细胞的成熟与抗体的产生至关重要的辅助性T细胞亚群,参与各类自身免疫病的发病及疾病进展。对Tfh 细胞的功能及其作用机制的深入研究不仅有助于我们进一步揭示某些自身免疫病的发病机制,也有助于探索其临床应用前景,实现相关研究的临床转化。靶向Tfh 细胞或为多种自身免疫病的潜在治疗方法,具有重要的意义。

