血根碱通过上调m6A 甲基转移酶14 对胃癌细胞增殖和侵袭的抑制作用
陈 鸣,张 靖
上海交通大学医学院附属第六人民医院消化科,上海 200233
胃癌是常见的恶性肿瘤,虽然全球胃癌的发生率和死亡率在下降[1],但是胃癌在我国仍位于恶性肿瘤死因的第3 位[2]。研究表明,除手术及放化疗外,传统中医药在抑制肿瘤转移和复发、改善患者预后等方面也具有一定的作用。血根碱(sanguinarine,SAG)提取自中药博落回(Macleaya cordata)及白屈菜(Chelidonium majus)等罂粟科植物。它是一种苯并菲啶类生物碱,具有广谱的生物学活性,包括抗氧化、抗炎、抗增殖与促凋亡等[3]。此外,SAG 可通过诱导细胞凋亡、抑制细胞增殖、抗血管形成及转移等发挥抗肿瘤作用[4]:其可通过失活胞内磷脂酰肌醇3 激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB 或AKT)信号通路抑制急性淋巴细胞白血病发展和诱导细胞凋亡[5],还可通过抑制SHH(sonic hedgehog)/GLI(gliotactin)/NANOG(Nanog homeobox)通路抗胰腺癌干细胞特性[6]。我们的前期研究[7-8]亦发现,SAG 可抑制胃癌的生长和侵袭。
N6-甲基腺嘌呤(N6-methyladenosine,m6A)甲基化是真核生物中最常见的RNA 修饰方式,对mRNA 的转运、剪切、稳定和翻译具有重要作用[9-11]。m6A 甲基化修饰具有可逆性和动态性,由甲基转移酶[如甲基转移酶3/14(methyltransferase 3/14,METTL3/14)、WT1 相关蛋白(WT1 associated protein,WTAP)等]起始,去甲基化酶[如肥胖相关 蛋 白(fat mass and obesity-associated protein,FTO)、 烷 基 化 修 复 同 源 物5 (alkylation repair homolog 5,ALKBH5)等]还原及识别子[YTH 结构 域 家 族 蛋 白1/2/3 (YTH domain family 1/2/3,YTHDF1/2/3) 和 YTHDC1/2 (YTH domain containing 1/2)] 共同调控完成[12]。研究表明,METTL14通过m6A 甲基化修饰抑制造血干/祖细胞分化和促进白血病发生[13],以及通过上调与PMP-22相关的P53 效应因子(P53 effector related to PMP-22,PERP)mRNA 的m6A 甲基化水平促进胰腺癌生长和转移[14]。但同时也有多项研究发现METTL14对部分肿瘤表现出抑制作用。YANG等[15]发现METTL14可以通过下调癌基因长链非编码RNAXIST(X inactive specific transcript)抑制结直肠癌的增殖和转移;另有研究[16]发现,其通过调节PI3K/AKT/mTOR(哺乳动物雷帕霉素靶蛋白, mammalian target of rapamycin)信号通路抑制胃癌的增殖、侵袭和迁移。本研究通过观察SAG 对METTL14表达及胃癌生长、侵袭的影响,初步探索SAG 抗胃癌的分子机制,为胃癌的治疗提供新的策略。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂和仪器 SAG(纯度≥99%)购自上海源业生物科技有限公司,噻唑蓝(MTT)购自江苏凯基生物技术股份有限公司,TRIzol试剂购自美国Invitrogen 公 司, METTL14 的 小 干 扰RNA (si-METTL14)慢病毒载体及其空载对照si-NC慢病毒载体购自上海吉凯生物科技有限公司,反转录试剂盒和SYBR Green Master Mixture 试剂盒购自日本TaKaRa公司,Transwell 试剂盒购自美国BD 公司,抗METTL14 抗体[CL4254](货号ab220031)购自美国Abcam 公司, 抗甘油醛-3- 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(货号AB-P-R 001)购自杭州贤至生物技术有限公司。PCR 引物由上海吉玛制药技术有限公司合成。
实时荧光定量PCR 仪(型号MA-6000)购自美国Kray Technologies 公司,酶标分析仪(型号BS-1101)购自美国Bio-Rad 公司。紫外可见分光光度仪(型号V-5100)购自上海元析仪器有限公司。
1.1.2 胃癌细胞系 人胃癌细胞系MGC-803、AGS均购自中国科学院细胞库。
1.2 实验方法
1.2.1 SAG 处理细胞 用不同浓度SAG(0、10、20 μmol/L)处理胃癌细胞(MGC-803、AGS)48 h后,进行后续实验。
1.2.2 定量PCR TRIzol 提取细胞总RNA,并反转录为cDNA,使用SYBR Green Master Mixture 试剂盒进行cDNA 扩增。METTL14上、下游引物序列分别为5′-GAACACAGAGCTTAAATCCCCA-3′和5′-TGTCAGCTAAACCTACATCCCTG-3′。以人β 肌动蛋白(β-actin)为内参对照,上、下游引物序列分别为5′-GTGGCCGAGGACTTTGATTG-3′和5′-CCTGTAACAACGCATCTCATATT-3′。扩增条件:93 ℃2 min预变性;然后按93 ℃1 min,55 ℃1 min,72 ℃1 min,共40 个循环;最后72 ℃7 min 延伸。每个样品重复3次。
1.2.3 Western blotting 将约5×107个细胞培养过夜后,裂解细胞,提取蛋白,4 ℃14 170×g离心15 min,上样20 μL进行电泳;电转至PVDF膜后封闭。先后滴加METTL14一抗、辣根过氧化物酶标记二抗。化学发光底物加于PVDF膜上,凝胶成像系统照像。GAPDH蛋白二次杂交。70 ℃水浴洗膜30 min 后用同法以GAPDH 作为内参对照,用紫外可见分光光度仪测量METTL14与GAPDH每个杂交图像峰面积值,两者峰面积值的比值代表METTL14蛋白的相对表达量。
1.2.4 慢病毒转染 在250 mL 细胞培养瓶中接种约1×105个细胞,培养过夜后等待细胞贴壁,按胃癌细胞的慢病毒感染复数(multiplicity of infection,MOI)值100,加入si-METTL14或si-NC 慢病毒载体感染胃癌细胞,48 h后换用含嘌呤霉素的培养液进行抗性筛选7 d,然后以10 μmol/L SAG 或PBS 处理48 h。根据加入的慢病毒载体和处理的药物将细胞分为si-METTL14+SAG组、si-NC+SAG组和si-NC+PBS组。
1.2.5 MTT 增殖实验 通过MTT 增殖实验检测si-METTL14+SAG 组、si-NC+SAG 组和si-NC+PBS 组细胞的增殖水平,具体实验方法参考文献[17]。实验重复3次。
1.2.6 克隆形成实验 SAG 作用1 周,取si-METTL14+SAG 组、si-NC+SAG 组和si-NC+PBS 组处于对数生长期的细胞,胰酶消化并制备单细胞悬液,以每孔约1 000 个细胞接种于6 孔板,置于培养箱中培养,隔天换液。观察细胞增殖情况,当6 孔板中出现肉眼可见的克隆时,终止培养。弃去上清液,PBS漂洗2 次。每孔加入4%多聚甲醛2 mL 固定细胞15 min。弃去固定液,加适量的结晶紫染液染色15 min,PBS 漂洗2 次,晾干后拍照并计数。实验重复3次。
1.2.7 Transwell侵袭实验 通过Transwell侵袭实验检测si-METTL14+SAG组、si-NC+SAG组和si-NC+PBS组细胞的侵袭能力,具体实验方法参考文献[17]。实验重复3次。
1.3 统计学分析
2 结果
2.1 SAG对胃癌细胞中METTL14表达的影响
利用不同浓度SAG(0、10、20 μmol/L)处理胃癌细胞(MGC-803、AGS) 48 h 后,定量PCR 和Western blotting 结果显示,与对照组(0 μmol/L)比较,SAG 明显上调METTL14的表达水平(均P<0.05),且呈一定浓度依赖性,仅AGS 细胞中20 μmol/L SAG 在蛋白水平未表现出明显的上调作用(图1)。
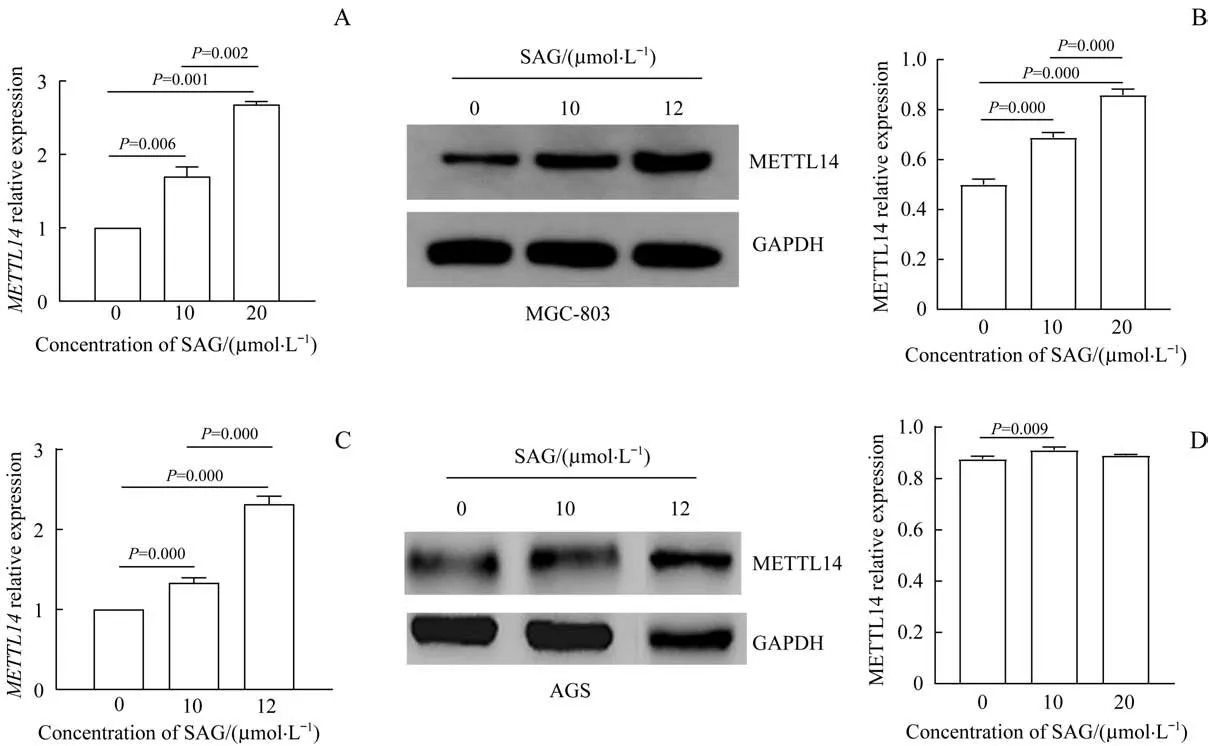
图1 不同浓度SAG对胃癌细胞中METTL14表达的影响Fig 1 Effect of different concentrations of SAG on METTL14 expression in gastric cancer cells
2.2 敲减METTL14 对SAG 抑制胃癌细胞增殖的影响
si-METTL14载体或si-NC载体转染胃癌细胞(MGC-803、AGS) 后,定 量PCR 和Western blotting 检 测METTL14mRNA和蛋白的表达水平(图2A、B),发现si-METTL14载体显著抑制了METTL14的表达(均P<0.01)。
MTT 增殖实验结果显示,si-NC+SAG 组胃癌细胞(MGC-803、AGS)增殖水平与si-NC+PBS 组比较被显著抑制(均P=0.000),而si-METTL14+SAG组SAG 的抑制作用被部分逆转,细胞增殖水平高于si-NC+SAG 组,低于si-NC+PBS 组,差异均有统计学意义(均P<0.05,图2C)。
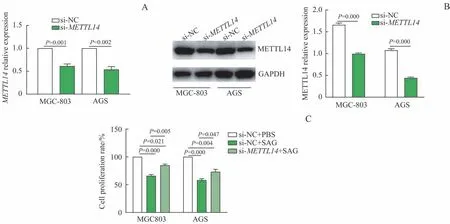
图2 敲减METTL14对SAG抗胃癌细胞增殖作用的影响Fig 2 Effect of knocking down METTL14 on the anti-proliferation activity of SAG in gastric cancer cells
2.3 敲减METTL14 对SAG 抑制胃癌细胞克隆形成的影响
克隆形成实验结果显示,与si-NC+PBS 组比较,si-NC+SAG 组胃癌细胞克隆形成能力被显著抑制(均P<0.01);而与si-NC+SAG 组比较,si-METTL14+SAG 组SAG 的抑制作用被部分逆转,细胞克隆数显著增加(均P<0.05,图3)。
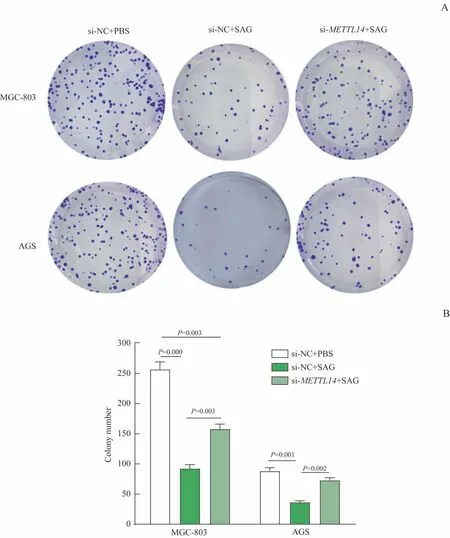
图3 敲减METTL14对SAG抗胃癌细胞克隆形成的影响Fig 3 Effect of knocking down METTL14 on the anti-colony formation capability of SAG in gastric cancer cells
2.4 敲减METTL14 对SAG 抑制胃癌细胞侵袭能力的影响
Transwell 侵袭实验显示,与si-NC+PBS 组比较,si-NC+SAG 组胃癌细胞的侵袭能力被显著抑制( 均P<0.01); 而 与si-NC+SAG 组 比 较, si-METTL14+SAG 组SAG 的抑制作用被部分逆转,穿过基底胶(Matrigel) 的细胞数显著增多(均P<0.05,图4)。
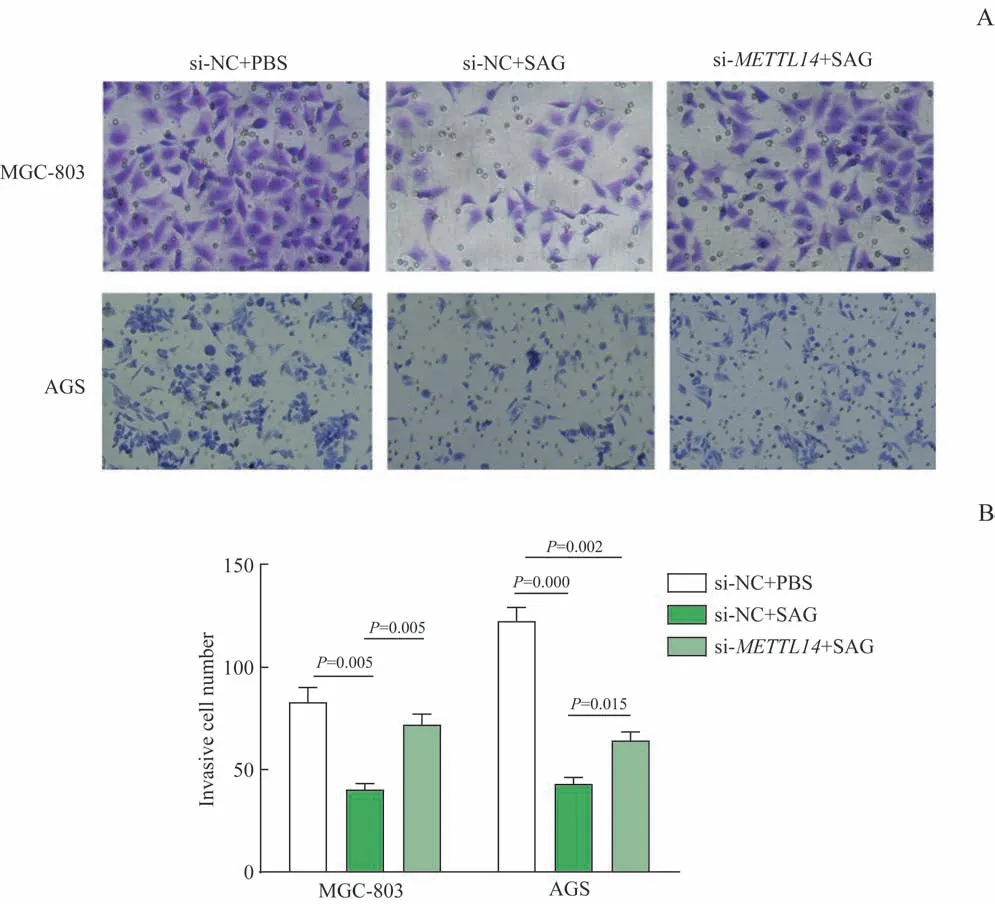
图4 敲减METTL14对SAG抗胃癌细胞侵袭潜能的影响Fig 4 Effect of knocking down METTL14 on the anti-invasion potential of SAG in gastric cancer cells
3 讨论
肿瘤侵袭转移是胃癌患者预后不良的主要原因之一。m6A甲基化修饰异常与胃癌预后及侵袭转移密切相关。METTL3 和METTL14 都是m6A 甲基转移酶的主要构成部分,但两者对胃癌却显现出相反的作用。METTL3 可介导肝癌衍生生长因子(hepatomaderived growth factor,HDGF)的m6A 甲基化修饰或通 过 METTL3/ZMYM1 (zinc finger MYM-type containing 1)/E-cadherin(上皮钙黏素)信号促进胃癌的上皮间质转化 (epithelial-mesenchymal transition,EMT)、血管生成和转移,而且是胃癌的一个潜在的预后生物标志物和治疗靶点[18-19]。m6A去甲基化酶FTO 通过抑制β1 整合素(integrin subunit β1,ITGB1)的m6A 甲基化修饰促进胃癌转移[20],且高表达FTO 和ALKBH1 与胃癌不良预后密切相关,是胃癌患者预后的潜在标志物[21]。我们前期研究[12]发现,识别子YTHDF1 以m6A 依赖的方式介导去泛素 化 酶14 (ubiquitin-specific proteases 14,USP14)的翻译,促进胃癌的发生和转移[22]。这些研究阐述了m6A甲基化修饰与胃癌之间的关系。
我们前期研究[7]还发现,SAG 通过调节双特异性 磷 酸 酶4 (dual specificity protein phosphatase 4,DUSP4)/细胞外信号调节激酶(extracellular signal regulated kinase,ERK)通路抑制胃癌细胞生长和侵袭。ZHU 等[23]人发现SAG 通过WNT/β-catenin 信号通路抑制与EMT 相关结肠癌的迁移和转移。另有研究[24]揭示了SAG通过上调胰岛素样生长因子结合蛋白-3 (insulin like growth factor binding protein-3,IGFBP-3)的表达促进肝癌细胞的凋亡。SAG 在多种消化系统肿瘤中均显示出良好的抗癌潜力,但是其具体作用机制仍有待进一步阐明。
本研究结果显示,不同浓度SAG对2种胃癌细胞株中的METTL14表达具有上调作用,且浓度越高,上调作用越明显;同时SAG 可以抑制胃癌细胞的增殖活性、克隆形成及侵袭潜能,但是敲减METTL14对SAG 的这些效果具有部分逆转作用;由此推测,SAG 可能通过上调METTL14抑制胃癌细胞的生长和侵袭。后续本课题组将进一步分析METTL14在人体胃癌及癌旁组织标本中的表达水平,以及METTL14的表达量与胃癌侵袭转移、病理分级、临床分期及预后的关系。

