Pcsk9 基因干扰对高脂诱导的大鼠非酒精性脂肪性肝病合并动脉粥样硬化的影响
张晓文,王 祎,张 婵,张 迪,贠 航,黄 笛
1.商洛学院健康管理学院护理系,商洛 726000;2.陕西“四主体一联合”秦岭健康食品配料及核桃产业技术校企联合研究中心,商洛 726000
近年来,慢性疾病已成为人类健康的重大威胁。其中,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)和动脉粥样硬化(atherosclerosis,AS)引起的心血管疾病在慢性疾病中所占比例相当大[1]。NAFLD是最为常见的肝脏疾病,在一般人群中发病率为20%~30%,而在肥胖人群或糖尿病患者中发病率高达70%~90%[2]。某些NAFLD患者可能会进展为肝硬化和肝细胞癌[3]。而且,有研究[4]提出脂肪肝与AS及冠心病关系密切。NAFLD患者具有较高的心血管疾病的患病风险和病死率,且NAFLD患者发生心血管疾病而导致死亡的概率远远高于肝脏其他并发症[5]。因此,对于NAFLD的预防与控制显得尤为重要。
前蛋白转化酶枯草溶菌素9 (proprotein convertase subtilisin kexin 9,Pcsk9)基因,编码一种前蛋白转化酶,名为神经细胞凋亡调节转化酶1(neural apoptosis-regulated convertase 1,NARC-1)[6]。该蛋白可介导低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)降解,升高血浆中低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的水平,Pcsk9基因突变会导致异常胆固醇血症[7]。先前报道[8]显示,使用Pcsk9抑制剂除了对心血管疾病有良好作用外,还可改善NAFLD,并降低LDL-C 水平。然而,关于Pcsk9如何影响NAFLD 及其调控机制的报道较少。本研究采用基因干扰技术,在高脂诱导的NAFLD 合并AS 大鼠中,考察Pcsk9对大鼠肝脏和主动脉组织损伤,以及对胰岛素、血脂及炎症因子水平的影响。
1 材料和方法
1.1 实验材料
1.1.1 实验动物及细胞 40只SPF级,8周龄的雄性SD 大鼠,购自西安交通大学实验动物中心,体质量为160~200 g,生产许可证号为SCXK(陕)2020-001,并饲养于该实验动物中心。使用许可证号为SYXK(陕)2020-005。实验动物伦理审批编号为No.20200521。
人肾上皮细胞系293T 细胞(武汉普诺赛生物科技有限公司),用于包装重组慢病毒干扰质粒。
1.1.2 主要试剂和仪器Pcsk9-短发夹RNA(short hairpin RNA, shRNA) 和 shRNA- 阴 性 对 照(negative control,NC)重组慢病毒质粒,慢病毒包装质粒pGag/Pol、pRev、pVSV-G(上海吉玛基因公司);RNA purification system(德国Qiagen 公司);Superscript RNase H-逆反录酶(美国Invitrogen 公司);随机六聚体(美国Sigma-Aldrich 公司);ABI Prism 7000 系统(美国Applied Biosystems 公司);TUNEL细胞凋亡检测试剂盒(显色法)(上海碧云天生物技术有限公司);白细胞介素-1β(interleukin-1β,IL-1β)、IL-6 及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS);ELISA 试剂盒(美国R&D Systems 公司);10% SDS 聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDS-PAGE)、聚偏二氟乙烯(polyvinylidenefluoride, PVDF)膜、羊抗兔IgG-辣根过氧化物酶(horseradish peroxidase,HRP)、ECL 化学发光检测试剂盒(北京索莱宝科技有限公司);PCSK9 抗体(#13366)、Toll 样受体4(Toll-like receptor 4,TLR4)抗体(#14358)、P65 抗体(#8242)、p-P65 抗体(#3033)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)抗体(#11948)及GAPDH 抗体(#97166)(稀释度均为1∶1 000,美国CST 公司);p-TLR4 抗体(#PA5-105713,稀释度1∶500~1∶2 000,美国Thermo Fisher公司)。
全自动生化仪(美国Beehman公司);γ放射免疫计数器(型号GC-2012,科大创新股份有限公司中佳分公司);ABI Prism 7000系统(美国Applied Biosystems公司);E100光学显微镜(日本Nikon公司);Multiskan Sky多功能酶标仪(美国Thermo Fisher公司)。
1.2 实验方法
1.2.1 重组慢病毒干扰质粒的包装和滴度测定 将构建好的重组慢病毒质粒与慢病毒包装质粒pGag/Pol、pRev、pVSV-G 按照2∶1∶1∶1 的比例加入混匀,共同转染293T 细胞。转染24 h 后,通过荧光显微镜观察荧光强度,与标准滴度的慢病毒载体对照组比较确定大鼠Pcsk9基因的shRNA慢病毒载体病毒滴度。1.2.2 造模与分组 40 只大鼠随机分为对照组、模型(high fat)组、shRNA-NC 干扰模型(high fat+shRNA-NC)组及Pcsk9-shRNA 干扰模型(high fat+Pcsk9-shRNA)组,每组10只。对照组继续给予普通饲料,其余组给予高脂饲料(0.3%胆固醇以及20%脂肪)构建NAFLD 大鼠模型;自由摄食,连续喂养14 周。实验期间,shRNA-NC 干扰模型组和Pcsk9-shRNA 干扰模型组分别通过腹腔注射慢病毒载体shRNA-NC 和Pcsk9-shRNA,每10 d 注射剂量为每只大鼠1×108TU/mL。
1.2.3 实时荧光定量聚合酶链反应 采用RNA purification system 提取总RNA,随后用Superscript RNase H-反转录酶和随机六聚体将1 μg 总RNA 反转录成cDNA。使用SYBR Green Master Mix (美国Thermo Fisher公司)进行实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RTqPCR)。检测基因的引物如下:Pcsk9基因,正向引物5'-GCTGAGCTGCTCCAGTTTCT-3',反向引物5'-AATGGCGTAGACACCCTCAC-3';Gapdh,正 向 引物5'-TGCACCACCAACTGCTTAGC-3',反向引物5'-GGCATGGACTGTGGTCATGAG-3'。所有结果均以Gapdh为基准进行归一化,用2-ΔΔCt计算。
1.2.4 实验指标检测 计算Lee's 肥胖指数:Lee's 指数=体质量(g)1/3×10/体长(cm)。采用放射免疫法测定空腹血清胰岛素。全自动生化分析仪检测大鼠血脂指标: 高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、总胆 固 醇 (total cholesterol, TC) 和 三 酰 甘 油(triacylglycerol,TAG)。
1.2.5 苏木精-伊红染色 末次喂食后,处死大鼠,解剖,分别将大鼠肝脏和主动脉组织置于4%多聚甲醛缓冲液中固定后置4 ℃冰箱备用。经乙醇脱水、二甲苯透明后,石蜡包埋、切片,厚度5 μm。组织切片经二甲苯脱蜡,依次经过由高至低浓度梯度乙醇进行水化。接着,用苏木精染色2 min,1%盐酸乙醇分化10 s,稀氨水返蓝20 s,伊红染色3 min。再依次经过由低至高浓度梯度乙醇脱水,各5 min。二甲苯透明后用中性树脂封片。光学显微镜观察染色结果并拍照记录。
1.2.6 TUNEL 细胞凋亡检测 根据制造商的说明书进行操作。阳性着色细胞呈棕黄色,位于细胞核,为固缩状,高倍镜下呈现碎点或碎块样。每张切片随机观察10个高倍视野,每个视野计数200个细胞,统计阳性细胞数量,计算细胞凋亡率。细胞凋亡率=凋亡细胞个数/所有细胞个数×100%。
1.2.7 酶联免疫吸附试验检测炎症因子 经大鼠腹主动脉采血,于4 ℃自然凝固30 min,4 ℃、1 500×g离心10 min,分装血清并保存于-80 ℃。使用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒分别检测IL-1β、IL-6 及iNOS 的表达水平。根据说明书进行操作,在Multiskan Sky 多功能酶标仪450 nm处检测吸光度。
1.2.8 蛋白质印迹法 用10%SDS-PAGE分离肝脏和主动脉组织中的蛋白,并转移到PVDF 膜上。5%脱脂牛奶封闭后,蛋白质与第一抗体(一抗)在4 ℃下孵育过夜。主要抗体如下:PCSK9、TLR4、p-TLR4、P65、p-P65、TNF-α 及GAPDH 的抗体。PBS洗涤,羊抗兔IgG-HRP 二抗孵育2 h,增强化学发光(enhanced chemiluminescence,ECL)显色,分析蛋白质表达水平。
1.3 统计学分析
使用统计软件SPSS18.0 进行分析。符合正态分布的定量资料采用±s 表示,多组间以单因素方差分析(One-Way ANOVA)进行比较,组间两两比较采用LSD法。P<0.05表示差异具有统计学意义。
2 结果
2.1 大鼠Pcsk9基因干扰效率、肥胖指数和胰岛素水平的检测
Pcsk9-shRNA干扰模型大鼠,使Pcsk9基因沉默。RT-qPCR 和蛋白质印迹法分别检测大鼠肝脏组织中Pcsk9的mRNA 和蛋白水平以验证干扰效率。如图1所示,与对照组比较,模型组Pcsk9mRNA 和蛋白表达显著上调(均P=0.000);与模型组比较,high fat+Pcsk9-shRNA 组Pcsk9的mRNA 和蛋白表达显著下调(均P=0.000),干扰效率约76%。由此可见,成功敲减了大鼠的Pcsk9基因。表1 的检测结果显示,与对照组比较,模型组的肥胖指数和胰岛素水平显著升高(均P=0.000);与模型组比较,high fat+Pcsk9-shRNA 组肥胖指数和胰岛素水平显著下降(P=0.007,P=0.000)。
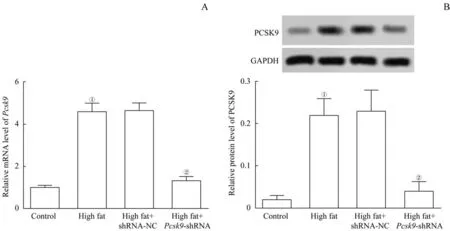
图1 4组Pcsk9基因干扰的效率检测Fig 1 Efficiency detection of Pcsk9 gene interference in 4 groups

表1 4组肥胖指数和胰岛素水平比较Tab 1 Obesity index and insulin levels in 4 groups
2.2 大鼠肝脏损伤情况
苏木精-伊红染色(hematoxylin-eosin staining,HE染色)结果(图2)所示,对照组大鼠肝组织细胞结构正常,肝细胞以中央静脉为中心呈放射状分布;模型组小鼠肝组织中央静脉呈现不规则形状,细胞排列不均匀,结构被破坏,出现明显细胞坏死。与模型组比较,high fat+shRNA-NC 组无明显改变;high fat+Pcsk9-shRNA组大鼠肝组织细胞的坏死情况得到减轻。由此可见,Pcsk9干扰可以改善NAFLD 大鼠的肝损伤情况。
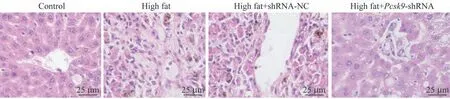
图2 大鼠肝脏H-E染色(×200)Fig 2 H-E staining of rat livers(×200)
2.3 大鼠肝脏细胞的凋亡
如图3所示,与对照组比较,模型组的细胞凋亡率显著升高(P=0.000);与模型组比较,high fat+Pcsk9-shRNA组的细胞凋亡率显著降低(P=0.000)。由此可见,Pcsk9敲减可抑制NAFLD大鼠肝脏细胞凋亡。

图3 TUNEL检测大鼠肝脏细胞凋亡Fig 3 Apoptosis of rat liver cells detected by TUNEL
2.4 大鼠血脂指标的检测
如表2 所示,与对照组比较,模型组的HDL-C含量显著降低(P=0.000),而LDL-C、TC 及TAG 含量显著升高(均P=0.000);与模型组比较,high fat+Pcsk9-shRNA 组 的HDL-C 含 量 显 著 升 高(P=0.000),而LDL-C、TC 及TAG 含量显著降低(均P=0.000)。由此可见,Pcsk9敲减可减轻NAFLD 大鼠血脂指标的异常程度。
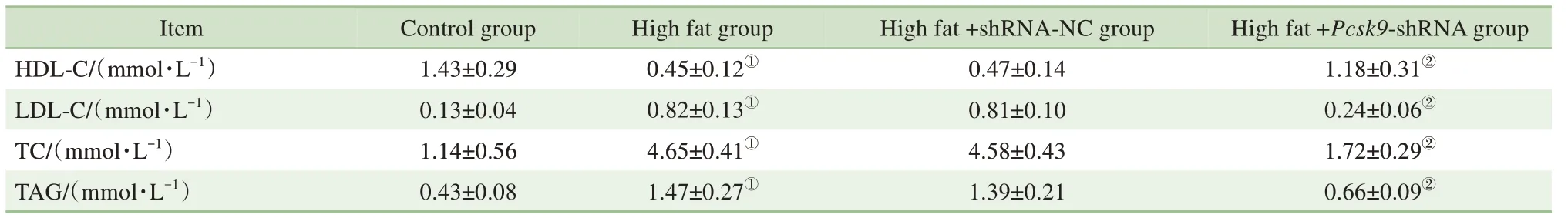
表2 4组大鼠血脂指标比较Tab 2 Blood lipid indicators of rats in 4 groups
2.5 主动脉血管壁形态学变化
显微镜下(图4),对照组主动脉组织结构完整,层次分界清楚,未见斑块。模型组的动脉内管壁内膜增厚,可见明显的泡沫细胞和胆固醇结晶,各层细胞脂质浸润,管腔内壁厚薄不均,有类似粥样或纤维样的斑块。在Pcsk9敲减模型大鼠中,主动脉组织仅有较少斑块形成,泡沫细胞较少,内膜增生程度较轻。由此表明,抑制Pcsk9表达可改善NAFLD大鼠AS的病理损伤。
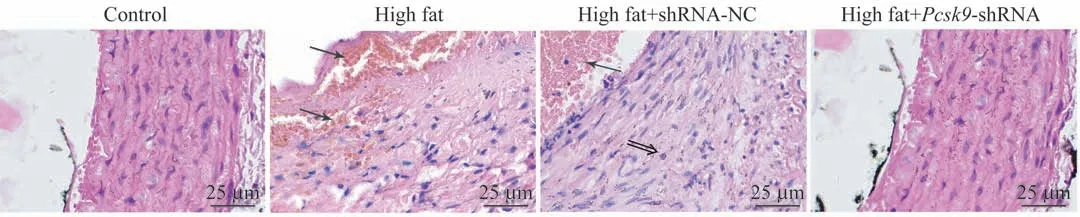
图4 大鼠主动脉血管壁H-E染色(×200)Fig 4 H-E staining of the aortic wall in rats(×200)
2.6 大鼠外周血中炎症因子表达水平
如表3 所示,与对照组比较,模型组的IL-1β、IL-6 及iNOS 表达水平显著升高(均P=0.000);与模型组比较,high fat+Pcsk9-shRNA 组的IL-1β、IL-6及iNOS 表达水平显著降低(均P=0.000)。由此可见,Pcsk9敲减可抑制NAFLD 大鼠外周血中炎症因子的表达。

表3 4组大鼠外周血中炎性因子的表达水平比较Tab 3 Expression levels of inflammatory factors in peripheral blood of rats in 4 groups
2.7 大鼠主动脉TLR4、NF-κB P65、TNF-α 蛋白表达
蛋白印迹法检测了大鼠主动脉组织参与免疫炎症通路相关的蛋白TLR4 及NF-κB P65 的磷酸化和TNF-α 的表达水平。如图5 所示,与对照组比较,模型组的TLR4 及NF-κB P65 的磷酸化水平,TNF-α 的表达均显著上调(均P=0.000);与模型组比较,high fat+Pcsk9-shRNA 组的TLR4 及NF-κB P65 的磷酸化水平,TNF-α 的表达均显著下调(均P=0.000)。由此可见,Pcsk9干扰可抑制TLR4 及NF-κB P65 的活化,TNF-α 的表达,进而减轻NAFLD 大鼠的炎症反应。
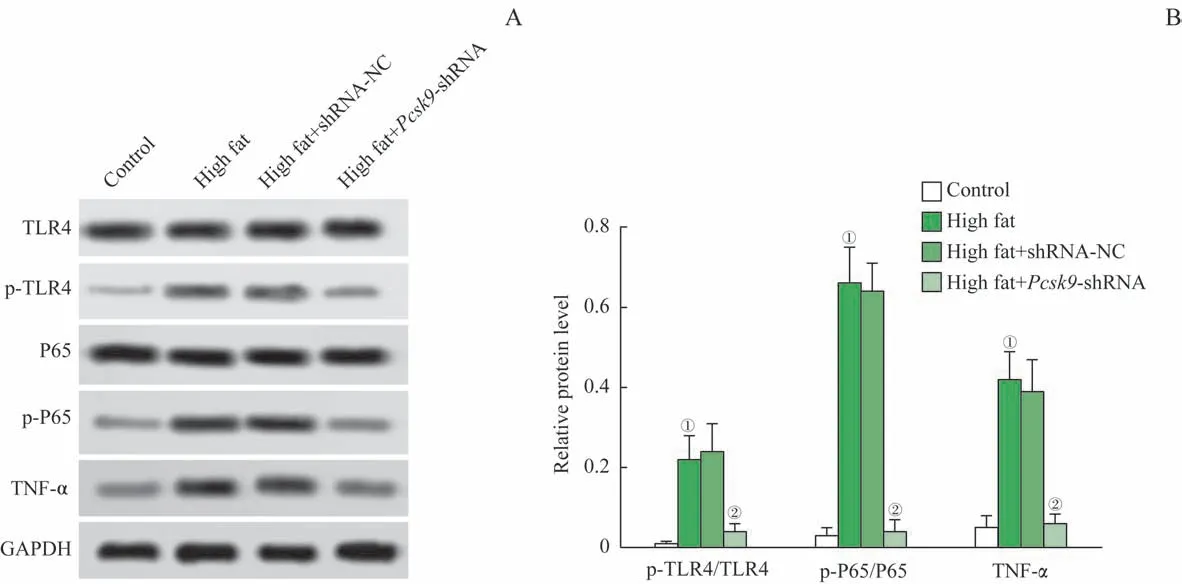
图5 TLR4及NF-κB P65的磷酸化和TNF-α的表达水平Fig 5 Phosphorylation levels of TLR4 and NF-κB P65 and the expression of TNF-α
3 讨论
NAFLD 与诸如胰岛素抵抗、肥胖、血脂异常和高血压等许多代谢性紊乱存在强相关性,因此,也被认为是代谢综合征在肝脏的集中表现[9]。NAFLD 的发病机制尚不明确,可能与遗传、代谢和环境等因素有关。目前对于治疗NAFLD 尚无特效药,主要以适量运动、合理饮食和降血糖为主,并适当给予调脂药物治疗[10]。因此,迫切需要探究治疗NAFLD的相关分子靶点与机制。
目前研究Pcsk9在人类肝脂肪变性中的作用的研究仍然存在争议。DEMERS等[11]研究表明在Pcsk9-/-小鼠中,Pcsk9通过下调CD36 的表达来阻止脂质进入肝脏。已知在肝脏中CD36通过促进TAG 的积累和随后的脂质诱导的内质网应激,促进NAFLD 的进展和更严重的非酒精性脂肪性肝炎。在肥胖或者糖尿病的情况下,Pcsk9的缺失突变可以导致肝脏的脂肪积累。然而也有研究[12]发现在正常饮食条件下,Pcsk9-/-小鼠肝脏中的几种代偿机制可能协同作用抑制肝脏脂肪变性;但在高脂代谢挑战期间,Pcsk9-/-小鼠内质网应激、纤维化、炎症和凋亡标志物的表达以及血浆谷丙转氨酶(glutamic-pyruvic transaminase,GPT)水平显著升高。在本研究中,我们发现干扰Pcsk9表达后NAFLD 大鼠的肥胖指数和胰岛素水平降低,HDL-C 水平升高,LDL-C、TC 和TAG 水平降低。已有研究[13]表明,NAFLD 患者的脂蛋白异常代谢是导致AS 进展的因素。高TAG 明显促进游离脂肪酸(free fatty acid,FFA)水平增高,过多的FFA在肝脏沉积脂肪变性形成NAFLD[14]。长期的高胰岛素血症可加重NAFLD,促进血管内皮功能改变和平滑肌细胞功能增强,以及高凝血、低纤溶状态的形成,加速AS的进展[15]。
在肝细胞脂肪变性进展为脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、纤维化及肝硬化的过程中,炎症反应起着重要的作用[16]。先前研究[17-18]表明多种化合物通过抑制NF-κB 途径和促炎细胞因子的产生保护肝脏免受损伤。我们的研究显示,Psck9敲减可以缓解NAFLD 大鼠肝脏和主动脉组织病理损伤,且抑制肝脏组织细胞凋亡。Psck9干扰还可抑制外周血中IL-1β、IL-6和iNOS的水平,进而缓解NAFLD 大鼠的炎症反应。我们还进一步发现,Psck9敲减可阻碍免疫炎症相关通路蛋白TLR4和NF-κB P65的活化及炎症因子TNF-α的表达,表明Psck9可能部分通过TLR4/NF-κB P65 通路对NAFLD大鼠起到调节作用。
综上所述,干扰Psck9基因可能通过下调TLR4/NF-κB P65磷酸化表达来缓解NAFLD 合并AS大鼠的脂质代谢异常及炎症反应,改善肝脏及主动脉损伤。当然存在另一种可能性,即Pcsk9敲减降低了高脂饮食诱导的血脂异常,从而导致TLR4 和NF-κB P65 磷酸化表达并没有显著升高。

