烟酰胺单核苷酸对衰老小鼠代谢的干预作用
党国栋,洪新宇,蔡美琴#
1.上海交通大学公共卫生学院,上海 200025;2.上海市疾病预防控制中心,上海 200051
当前人口老龄化趋势日益突出,延缓衰老研究已成为生物医学研究的重要组成部分。衰老过程的特征是机体功能完整性的渐进丧失,伴随着代谢功能障碍、DNA 不稳定、慢性炎症、机体损伤等生理变化[1]。烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)是在营养摄入和细胞损伤等环境变化中控制细胞功能和存活的关键信号分子,NAD+水平随年龄增长而逐渐下降,导致细胞和器官功能下降、代谢改变和疾病易感性增加[2]。延缓甚至逆转NAD+水平下降趋势,可改善肌肉功能、运动能力和心脏功能等衰老相关生理代谢参数[3]。
烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)作为NAD+的前体,是目前直接有效的NAD+补充物质[4]。已有研究证实,NMN 可以改善衰老的血管内皮细胞增殖和迁移受损[5],促进衰老间质干细胞成骨增殖,减少脂肪生成[6],提高衰老卵母细胞的受精能力,恢复线粒体功能,抑制活性氧诱导的衰老卵母细胞凋亡[7],改善衰老引起的血管功能障碍[8]以及肾脏损伤[9]。同时NMN 能纠正炎症诱导的胰岛功能障碍[10],改变糖尿病模型小鼠的脂质谱[11],改善脂代谢[12],促进肥胖人群中肌肉胰岛素信号转导和重塑[13]。这些研究结果提示NMN对代谢功能障碍的潜在治疗作用。然而关于NMN 对衰老动物的代谢影响,目前鲜有研究涉及。
本研究拟通过D-半乳糖(D-galactose,D-gal)衰老造模法,建立小鼠衰老模型,从能量代谢、糖耐量、胰岛素敏感性、抗氧化应激能力等方面探索NMN 对衰老小鼠代谢的影响并初步探讨其可能的作用机制,为NMN的实际应用提供科学依据。
1 材料与方法
1.1 实验动物
健康3 月龄C57BL/6N 雄性小鼠,无特定病原体(specific pathogen free,SPF)级,体质量(27±2)g,购自浙江维通利华实验动物技术有限公司。动物生产许可证号SCXK (浙) 2019-0001,使用许可证号SYXK(沪)2018-0031。动物饲养在上海市疾病预防控制中心屏障动物房内,单笼常规饲料喂养,记录饮食量和饮水量。动物照明模拟自然光照,12 h昼夜更替。本研究于2021年2月份通过上海市疾病预防控制中心实验动物伦理审查委员会的审查,所有研究操作均遵守《医学实验动物管理实施细则》的要求。
1.2 试剂和仪器
NMN(纯度99.9%,健安喜公司,中国),D-gal(纯度≥99.0%,Sigma公司,美国),超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(南京建成生物工程研究所,中国),BCA 蛋白定量试剂盒(碧云天生物技术研究所,中国),生物合成人胰岛素注射液(Novo Nordisk公司,丹麦);血糖仪、血糖试纸(OneTouch公司,美国),Denley Dragon Wellscan MK 3 酶标仪(Thermo公司,美国),CLAMS 实验动物能量代谢监测系统(Columbus公司,美国)。
1.3 衰老模型的建立、分组及干预措施
运用随机数字表,将实验动物分为5组:对照组、早衰模型组、衰老模型组、NMN 干预Ⅰ组、NMN干预Ⅱ组。每组14 只小鼠。每组实验动物处理如下:①对照组。颈背部皮下注射生理盐水150 mg/kg,灌胃给予300 mg/kg 蒸馏水,每日各1 次,持续6 周。②早衰模型组。颈背部皮下注射D-gal 150 mg/kg,灌胃给予300 mg/kg 蒸馏水,每日各1 次,持续6 周。③NMN 干预Ⅰ组。颈背部皮下注射D-gal 150 mg/kg,灌胃给予300 mg/kg的NMN,每日各1次,持续6周。④衰老模型组。颈背部皮下注射D-gal 150 mg/kg,灌胃给予300 mg/kg 蒸馏水,每日各1 次,持续12 周。⑤NMN 干预Ⅱ组。颈背部皮下注射D-gal 150 mg/kg,灌胃给予300 mg/kg 的NMN,每日各1 次,持续12 周。每日同一时间段记录饮水量、摄食量,每周称体质量2 次,每周观察和记录小鼠皮毛状态、行为表现等。
1.4 检测方法
对照组、早衰模型组、干预Ⅰ组在造模6 周后,检测脏器指数、能量代谢监测指标、糖耐量、胰岛素敏感性以及抗氧化指标。衰老模型组、干预Ⅱ组在造模12周后检测上述指标。
1.4.1 脏器指数检测 取出小鼠胸腺、脾脏、肝脏、双侧肾脏,称取脏器质量,计算胸腺指数、脾脏指数、肝脏指数、肾脏指数。各脏器指数=脏器质量(mg)/体质量(g)。
1.4.2 能量代谢实验 采用代谢笼,使用CLAMS实验动物能量代谢综合监测系统进行评估。小鼠适应代谢笼12 h后,开始实验。记录动物72 h内氧气消耗量(O2consumption,VO2)、二氧化碳呼出量(CO2exhalation,VCO2);利用红外光电池技术监测动物的活动量(红外光束每被打断1 次,则计数动物活动1 次)。通过评估代谢过程中的氧气-二氧化碳交换量来计算能量消耗(energy expenditure,EE),根据VO2和VCO2计算实验动物所用食物的能量含量,即呼吸商(respiratory exchange ratio,RER)。
1.4.3 葡萄糖耐量实验 小鼠禁食14 h 后,腹腔内注射10%葡萄糖(1 g/kg)。小鼠尾静脉采血,分别于0、15、30、60、90 和120 min 测定小鼠血糖水平,并计算血糖曲线下面积(area under the curve,AUC)。
1.4.4 胰岛素耐量实验 葡萄糖耐量实验结束间隔1 d 后,对小鼠进行胰岛素耐量实验。小鼠禁食4 h后,注射生物合成人胰岛素注射液(0.75 U/kg)。小鼠尾静脉采血,分别在0、15、30、60、90 和120 min测定小鼠血糖水平,并计算血糖AUC。
1.4.5 血清及肝组织中抗氧化指标检测 各组小鼠于末次给予NMN 和生理盐水,禁食12 h 后,眼眶取血,分离血清。之后脱颈椎法处死小鼠,迅速取出肝脏,制备10%的肝组织匀浆,2 327×g离心10 min,取上清液,置于-80 ℃下保存备用。用酶标仪分别测定小鼠血清及肝组织匀浆超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px) 活 性 及 丙 二 醛(malondialdehyde,MDA)含量。测试步骤严格按试剂盒说明书进行。
1.5 统计学分析
采用SPSS 22.0 软件对数据进行统计分析。定量数据以±s表示。选取单因素方差分析方法比较5 组之间体质量、摄食量、能量代谢监测指标、脏器指数、抗氧化指标的差异;选取两变量多因素重复测量方差分析方法比较5 组之间的血糖水平的差异;组间两两比较用最小显著性差异(least-significant difference,LSD) 法。P<0.05 表 示 差 异 有 统 计 学意义。
2 结果
2.1 NMN对衰老小鼠能量代谢的影响
2.1.1 NMN 对各组小鼠体质量及摄食量的影响 实验第1 周(干预前)各组动物体质量间差异无统计学意义(表1),动物毛色油亮有光泽。造模第4周,早衰模型组和衰老模型组小鼠毛色无光泽,活动量减少;造模第6 周,2 个模型组小鼠毛色逐渐发黄,开始掉毛,行动迟缓;造模第12 周,衰老模型组小鼠夹杂白毛,神态萎靡。仅造模第3 周,干预Ⅰ组体质量较对照组显著增加(P=0.018),其他各组与对照组间体质量间差异无统计学意义(均P>0.05)(表1)。各组小鼠整个实验期间摄食量之间的差异无统计学意义(均P>0.05)(表2)。
表1 各组小鼠不同阶段体质量变化(g,±s)Tab 1 Body mass of mice at different stages in each group(g,±s)
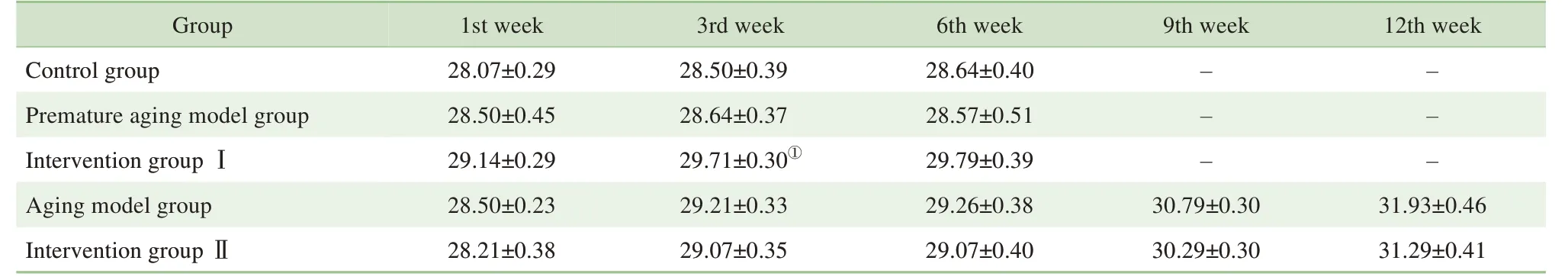
表1 各组小鼠不同阶段体质量变化(g,±s)Tab 1 Body mass of mice at different stages in each group(g,±s)
Note: ①P=0.018,compared with the control group.
Group Control group Premature aging model group Intervention group ⅠAging model group Intervention group Ⅱ9th week 12th week-- --- -1st week 28.07±0.29 28.50±0.45 29.14±0.29 28.50±0.23 28.21±0.38 3rd week 28.50±0.39 28.64±0.37 29.71±0.30①29.21±0.33 29.07±0.35 6th week 28.64±0.40 28.57±0.51 29.79±0.39 29.26±0.38 29.07±0.40 31.93±0.46 31.29±0.41 30.79±0.30 30.29±0.30
表2 各组小鼠不同阶段每日摄食量变化(g,±s)Tab 2 Food intake of mice at different stages in each group(g,±s)
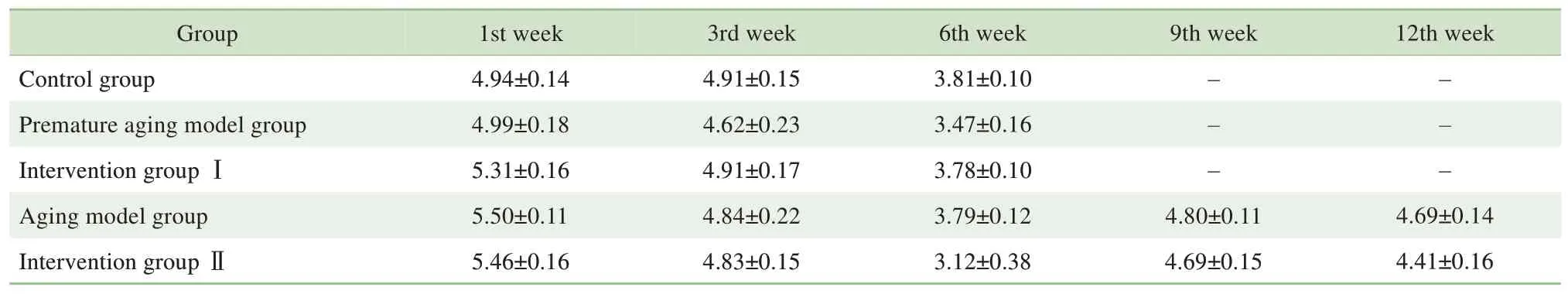
表2 各组小鼠不同阶段每日摄食量变化(g,±s)Tab 2 Food intake of mice at different stages in each group(g,±s)
Group Control group Premature aging model group Intervention group ⅠAging model group Intervention group Ⅱ9th week 12th week-- --- -1st week 4.94±0.14 4.99±0.18 5.31±0.16 5.50±0.11 5.46±0.16 3rd week 4.91±0.15 4.62±0.23 4.91±0.17 4.84±0.22 4.83±0.15 6th week 3.81±0.10 3.47±0.16 3.78±0.10 3.79±0.12 3.12±0.38 4.80±0.11 4.69±0.15 4.69±0.14 4.41±0.16
2.1.2 能量代谢实验结果 给药结束后,将小鼠放进代谢笼,按照要求在适应期结束后开始连续观察72 h。代谢笼实验结果如图1所示。
各组之间白天VO2与VCO2水平差异无统计学意义,仅早衰模型组白天VO2水平较对照组降低(P=0.010)。与对照组相比,早衰模型组与衰老模型组夜晚VO2和VCO2水平均显著下降(VO2:P=0.018,P=0.000。VCO2:P=0.044,P=0.003);相比衰老模型组,干预Ⅱ组夜晚VO2和VCO2升高显著(P=0.045,P=0.030)(图1A、B)。
与对照组相比,衰老模型组和干预Ⅱ组白天和夜晚RER水平升高显著(白天:P=0.000,P=0.002。夜晚:均P=0.000);相比各模型组,干预组的RER 水平的差异没有统计学意义(P>0.05)(图1C)。
白天小鼠活动量,各组之间差异无统计学意义。夜晚小鼠活动量,相比于对照组,早衰模型组、衰老模型组与干预Ⅱ组均显著减少(均P=0.000);与早衰模型组相比,干预Ⅰ组活动量显著增大(P=0.022);与衰老模型组相比,干预Ⅱ组活动量显著增大(P=0.049)(图1D)。
各组EE 检测结果与活动量分析结果相符合。夜晚EE 水平,与对照组相比,早衰模型组和衰老模型组降低明显(P=0.010,P=0.001)。与衰老模型组相比, 干预Ⅱ组EE 水平升高显著(P=0.043)(图1E)。
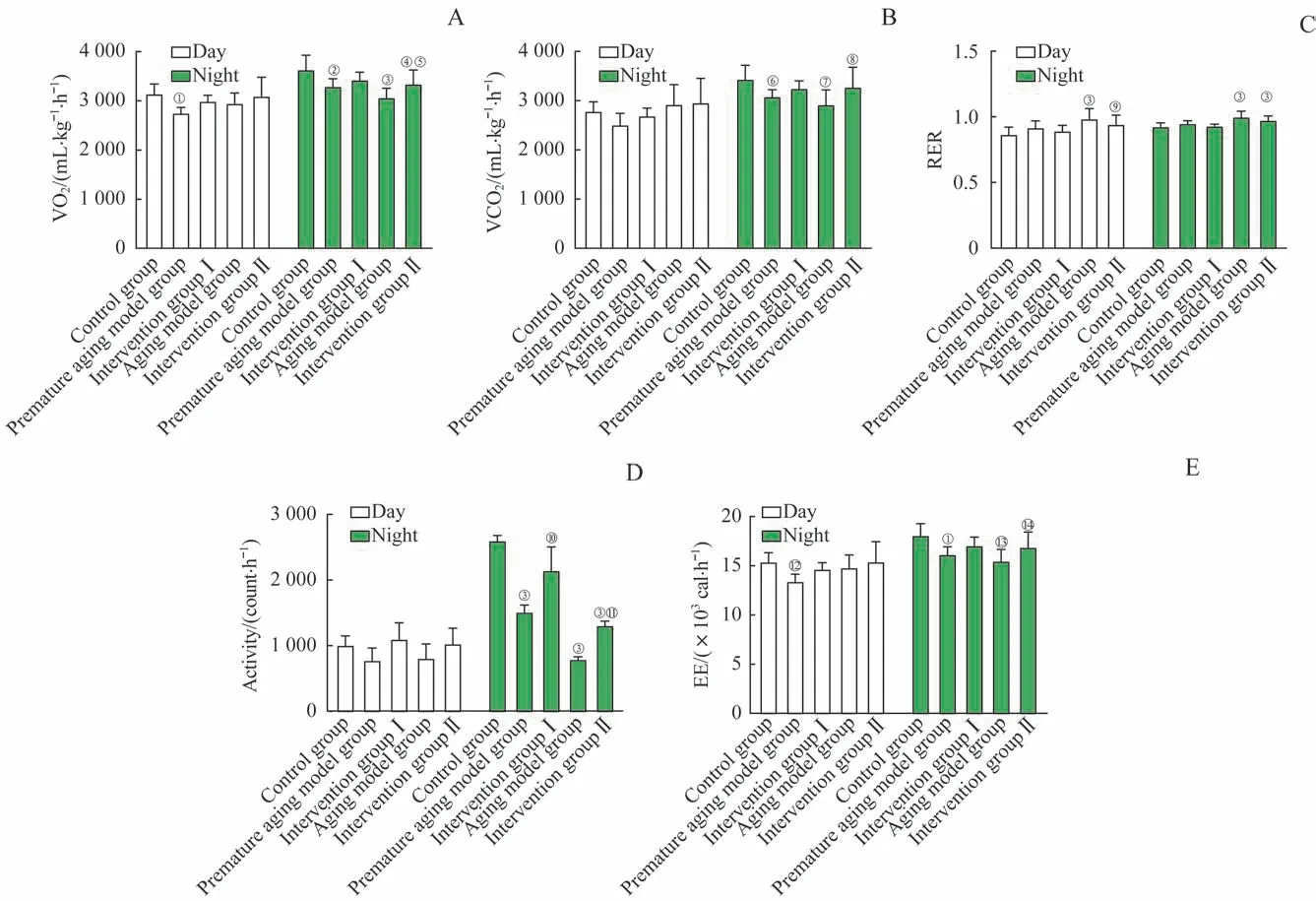
图1 小鼠代谢笼实验结果Fig 1 Results of metabolic cage experiment in mice
2.2 NMN对衰老小鼠脏器指数的影响
小鼠脏器指数结果(表3)显示,相比于对照组,早衰模型组胸腺指数和肾脏指数显著降低(P=0.035,P=0.009),衰老模型组胸腺指数、脾脏指数、肝脏指数、肾脏指数均显著降低(P=0.000,P=0.012,P=0.000,P=0.002)。相比于衰老模型组,干预Ⅱ组的肝脏指数显著提高(P=0.000)。
表3 各组小鼠脏器指数比较(±s)Tab 3 Comparison of the organ indexes in each group(±s)
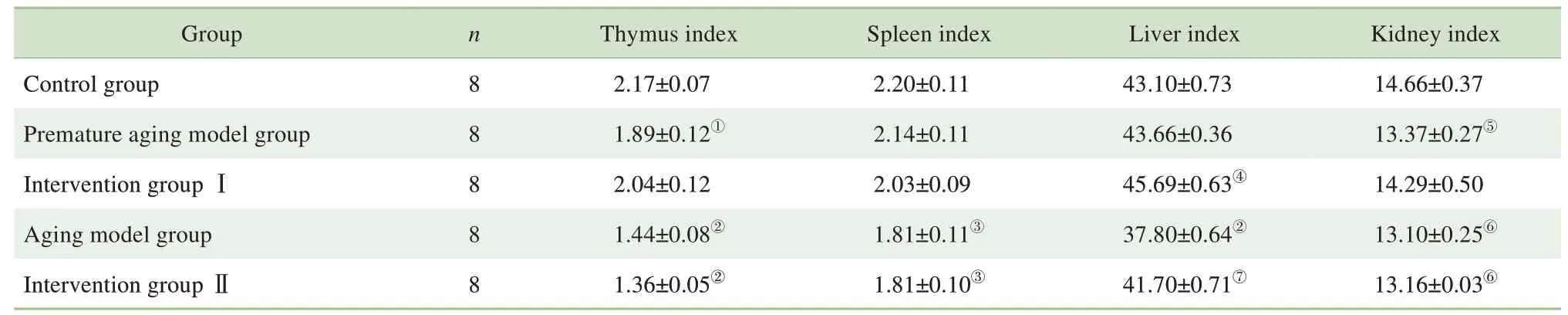
表3 各组小鼠脏器指数比较(±s)Tab 3 Comparison of the organ indexes in each group(±s)
Note: ①P=0.035, ②P=0.000, ③P=0.012, ④P=0.006, ⑤P=0.009, ⑥P=0.002,compared with the control group; ⑦P=0.000,compared with the aging model group.
Kidney index 14.66±0.37 13.37±0.27⑤14.29±0.50 13.10±0.25⑥13.16±0.03⑥Group Control group Premature aging model group Intervention group ⅠAging model group Intervention group Ⅱn 8 8 8 8 8 Thymus index 2.17±0.07 1.89±0.12①2.04±0.12 1.44±0.08②1.36±0.05②Spleen index 2.20±0.11 2.14±0.11 2.03±0.09 1.81±0.11③1.81±0.10③Liver index 43.10±0.73 43.66±0.36 45.69±0.63④37.80±0.64②41.70±0.71⑦
2.3 NMN对衰老小鼠糖耐量的影响
葡萄糖耐量实验结果(图2A)表明,造模6 周时对照组、早衰模型组、干预Ⅰ组小鼠在不同时间点血糖水平差异均无统计学意义。在造模12 周时,相比于对照组,衰老模型组血糖水平明显升高,干预Ⅱ组血糖水平相比衰老模型组有所降低,与对照组相比略有升高,3 组血糖水平差异具有统计学意义(P=0.000)。其中在60 min 时间点,衰老模型组血糖水平较对照组显著升高(P=0.000),干预Ⅱ组相比衰老模型组显著降低(P=0.020)。AUC 分析结果(图2B)显示,衰老模型组和干预Ⅱ组出现糖耐量受损(P=0.020,P=0.030),表明随着造模时间的延长,衰老加剧,导致小鼠的糖耐量受损;干预Ⅱ组AUC 相比于衰老模型组减少了13%(P=0.030),表明糖耐量受损得到改善。
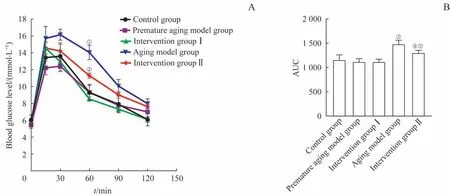
图2 葡萄糖耐量实验结果Fig 2 Results of glucose tolerance test
2.4 NMN对衰老小鼠胰岛素敏感性的影响
胰岛素耐量实验结果(图3A)表明,在比较相对于0 时间点血糖水平百分比的变化时,发现对照组、衰老模型组和干预Ⅱ组3 组之间血糖水平差异有统计学意义(P=0.000)。其中在30 min 和120 min 时间点,衰老模型组血糖水平相比对照组明显升高(均P=0.001),干预Ⅱ组相比衰老模型组显著降低(P=0.046,P=0.025)。同时AUC 的分析结果(图3B)也表明,D-gal 衰老造模导致早衰模型组、衰老模型组和干预Ⅱ组小鼠,胰岛素敏感性降低(P=0.012,P=0.011,P=0.014);干预Ⅱ组相比衰老模型组,胰岛素敏感性提高(P=0.010)。
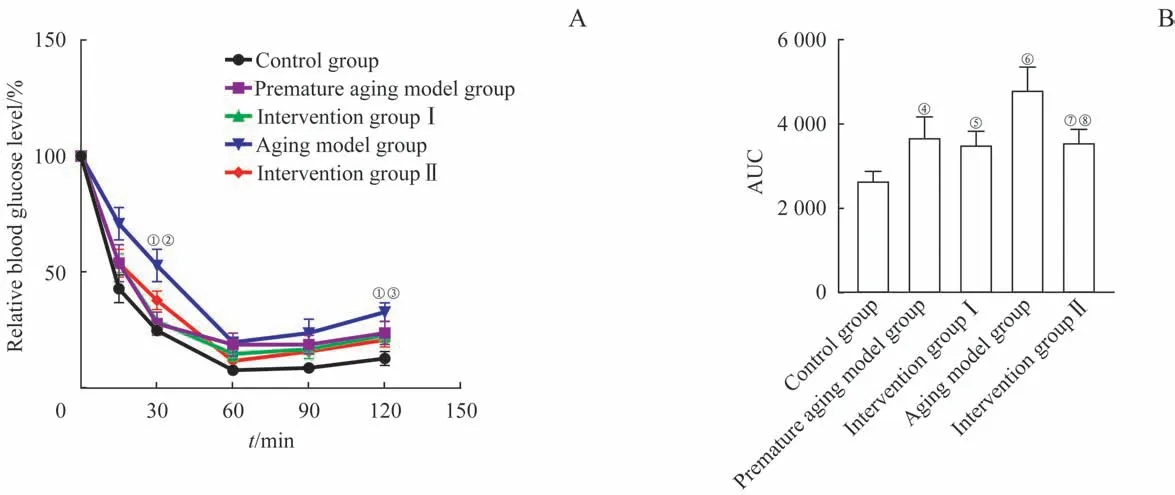
图3 胰岛素耐量实验结果Fig 3 Results of insulin tolerance test
2.5 NMN对衰老小鼠抗氧化水平的影响
2.5.1 各组小鼠血清SOD、GSH-Px 活性及MDA 含量的比较 小鼠血清抗氧化指标检测结果(表4)显示:与对照组相比,早衰模型组和衰老模型组的血清SOD、GSH-Px 活性显著降低(SOD:P=0.002,P=0.001。GSH-Px:P=0.001,P=0.011),MDA 含量显著升高(均P=0.000),说明模型组小鼠抗氧化水平降低,衰老模型制备成功;与早衰模型组相比,干预Ⅰ组血清SOD、GSH-Px 活性升高明显(P=0.026,P=0.006),MDA 含量显著降低(P=0.011);与衰老模型组相比,干预Ⅱ组SOD 活性升高(P=0.046),MDA含量降低(P=0.000)。
2.5.2 各组小鼠肝组织SOD、GSH-Px 活力及MDA含量的比较 小鼠肝脏抗氧化指标分析结果(表4)显示:与对照组相比,早衰模型组SOD 活性显著降低(P=0.032),2 组间MDA 含量、GSH-Px 活性差异无统计学意义;与对照组相比,衰老模型组SOD、GSH-Px 活性显著降低(P=0.029,P=0.001),MDA含量显著升高(P=0.002);与各模型组相比,两干预组肝组织抗氧化水平均有所改善,但仅干预Ⅱ组的MDA含量的降低具有统计学意义(P=0.000)。
表4 各组小鼠血清及肝组织SOD、GSH-Px活性及MDA含量比较(±s)Tab 4 Effects of NMN on the activities of SOD,GSH-Px and MDA content in serum and liver tissue of each group(±s)
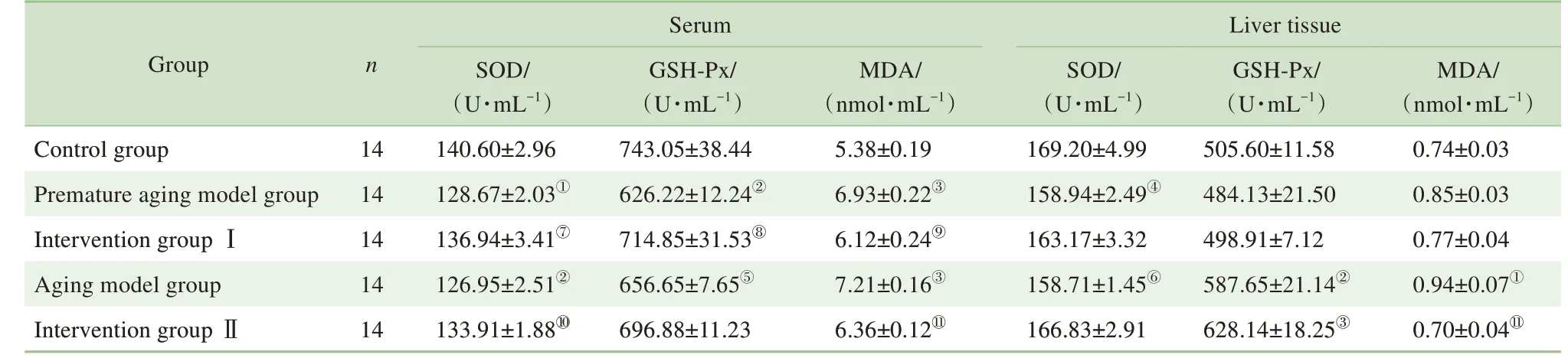
表4 各组小鼠血清及肝组织SOD、GSH-Px活性及MDA含量比较(±s)Tab 4 Effects of NMN on the activities of SOD,GSH-Px and MDA content in serum and liver tissue of each group(±s)
Note: ①P=0.002, ②P=0.001, ③P=0.000 ,④P=0.032, ⑤P=0.011, ⑥P=0.029, compared with the control group; ⑦P=0.026, ⑧P=0.006, ⑨P=0.011, compared with the premature aging model group; ⑩P=0.046, ⑪P=0.000,compared with the aging model group.
Serum Liver tissue Group n MDA/(nmol·mL-1)0.74±0.03 0.85±0.03 0.77±0.04 0.94±0.07①0.70±0.04⑪Control group Premature aging model group Intervention group ⅠAging model group Intervention group Ⅱ14 14 14 14 14 SOD/(U·mL-1)140.60±2.96 128.67±2.03①136.94±3.41⑦126.95±2.51②133.91±1.88⑩GSH-Px/(U·mL-1)743.05±38.44 626.22±12.24②714.85±31.53⑧656.65±7.65⑤696.88±11.23 MDA/(nmol·mL-1)5.38±0.19 6.93±0.22③6.12±0.24⑨7.21±0.16③6.36±0.12⑪SOD/(U·mL-1)169.20±4.99 158.94±2.49④163.17±3.32 158.71±1.45⑥166.83±2.91 GSH-Px/(U·mL-1)505.60±11.58 484.13±21.50 498.91±7.12 587.65±21.14②628.14±18.25③
3 讨论
本研究采用D-gal 亚急性衰老模型。在一定时间内连续注射D-gal,可导致细胞代谢紊乱和功能障碍,引起机体衰老[14]。D-gal诱发的衰老使得小鼠在学习记忆能力、行动能力和心脏功能方面呈逐步下降趋势,与自然衰老过程相似[15]。研究设计了连续给药6周以及连续给药12周2个阶段,试图通过延长造模时间,加剧小鼠衰老程度[16],并通过延长干预时间来观察长期补充NMN 的效果。目前,动物实验中有限的NMN抗衰老研究均采用自然衰老模型[17],聚焦于NMN 的短期干预结果[18],同时在干预结束的短时间内,存在治疗效果消退的情况[19]。本研究采用人工衰老模型小鼠,模拟衰老过程中补充NMN 的预防效果,比较了NMN 对不同衰老程度小鼠的干预结果,结果提示长时间的NMN干预效果更加显著。
衰老研究中常用代谢组学技术[20],通过对生物体内源性代谢物的分析来反映机体的代谢表型和生理变化[21]。不同于代谢组学技术,本研究利用间接测热法这一测定能量代谢的黄金标准[22],通过CLAMS实验动物能量代谢综合监测系统得到小鼠呼吸代谢量、活动量、EE 等代谢指标,其可直观反映小鼠能量代谢水平。结果发现,各组小鼠在白天时大部分能量代谢水平指标之间的差异无统计学意义。NMN 干预对衰老小鼠的能量代谢水平影响主要表现在夜晚小鼠活跃活动期间,其潜在机制可能与NAD+生物合成的昼夜节律性变化相关[23]。UDDIN 等[24]研究已证实,NMN 能够增加肌肉和肝脏组织中的NAD+水平,降低肥胖小鼠的三酰甘油含量,升高柠檬酸合酶活性,促进脂肪分解代谢。本研究发现,延长NMN 的干预时间,可明显提高衰老小鼠能量代谢水平,其机制可能与NMN可能提高小鼠的脂质利用率有关。
随着年龄的增长,肝脏中的NAD+水平降低,衰老过程中更容易出现葡萄糖不耐受和胰岛素抵抗[25]。本研究发现,造模6 周时小鼠血糖水平干预组与模型组之间差异无统计学意义。随着造模及干预时间的延长,造模12 周时模型组小鼠,衰老程度加剧,糖耐量受损加重,胰岛素敏感性降低,而干预组小鼠的糖耐量受损较轻、胰岛素敏感性较模型组有所改善。YOSHINO 等[11]研究证实,NMN 可改善高脂饮食诱导的2 型糖尿病小鼠的葡萄糖不耐受性。而关于NMN 对糖尿病前期的血糖受损干预效果,目前鲜有研究。本研究证实了NMN 可以有效干预衰老小鼠的血糖调节功能,改善其糖耐量和胰岛素敏感性。
氧化损伤发生在衰老的过程中,抗氧化酶SOD和GSH-Px 对机体的氧化与抗氧化平衡起着至关重要的作用[26]。机体内脂代谢过程中的MDA可间接反映脂质过氧化程度,是评价氧化应激水平的重要指标[27]。本研究结果发现,衰老小鼠氧化应激水平增高,抗氧化水平降低,造成氧化损伤;给予NMN 干预可部分提高小鼠血清和肝组织中的抗氧化水平,改善衰老造成的氧化损伤。研究[28]表明,依赖于NAD+的去乙酰化酶沉默信息调节因子1 (silent information regulator 1,SIRT1)在代谢和氧化应激中起着重要作用,其活性的增加可提高机体的抗氧化能力。NAD+水平的高低影响SIRT1 的活性,提高细胞内NAD+水平可有效激活SIRT1 和线粒体代谢[29]。NMN 作为NAD+生物合成的中间产物,其干预作用是否是通过增加NAD+水平、激活SIRT1 及其相关通路、提高机体的抗氧化能力、改善氧化应激,从而促进代谢活力、提升代谢水平,还需要进一步深入研究探讨。
综上所述,本研究证实给予衰老小鼠一定剂量的NMN,连续进行6周及12周的干预,其在能量代谢、糖耐量、胰岛素敏感性等方面有一定的改善,表明NMN 能一定程度改善衰老小鼠代谢水平。其作用机制可能与提高机体的抗氧化能力有关。同时本研究比较了NMN 对不同衰老程度小鼠的干预效果,发现NMN 干预时间越长,对衰老小鼠代谢能力的改善愈发显著。对于NMN 改善衰老小鼠代谢的机制,后续尚需通过检测相关蛋白通路等方式进行进一步研究。
致谢 本次实验所用的NMN纯品原料由GNC健安喜提供,特此感谢。
——早衰

