lncRNA IGF2-AS调控IGF2对骨髓间充质干细胞心肌样分化的影响
钟晓鸣,刘洪洋,张蕾,姚新亮,鲁雪莉,许瑾瑾,程冠昌
基于细胞的心肌修复和再生疗法是目前治疗心力衰竭和缺血性心脏病的一种有潜力的疗法[1]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一种骨髓来源的非造血干细胞,具有自我更新和多能分化的潜力,可以分化为心肌细胞来修复受损的心肌,从而改善心脏功能,这种基于细胞的疗法对于心肌修复和再生具有重要意义[2]。使用5-氮杂胞嘧啶(5-azacytidine,5-AZA)在体外将BMSCs 诱导为心肌细胞是一种较为传统的方法,但5-AZA 会引起细胞损伤[3]。因此,寻找一种安全的诱导BMSCs 向心肌细胞分化的方法至关重要。有文献报道,长链非编码RNA 胰岛素样生长因子2反义转录物(long non-coding RNA insulin-like growth factor 2 antisense transcript,lncRNA IGF2-AS)可促进牛成肌细胞分化[4],IGF2-AS 能以表观遗传DNA甲基转移酶1依赖性的方式调控有义同源基因胰岛素样生长因子2(IGF2)的表达[5]。但lncRNA IGF2-AS 对BMSCs 心肌样分化的影响以及能否通过调控IGF2影响BMSCs心肌样分化尚鲜见报道。因此,本研究主要探究lncRNA IGF2-AS 对BMSCs 心肌样分化的影响并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 3 周龄体质量 20~30 g 的 6 只 SPF 级雄性SD 大鼠购自广州赛业百沐生物科技有限公司,生产许可证号SCXK(粤)2020-0055。所有动物实验均得到本院动物伦理委员会的批准,并遵循3R原则。
1.1.2 主要试剂与仪器 pLVX-IRES-Zs Green1 载体、si-IGF2-AS、si-IGF2 及 si-IGF2-AS 和 si-IGF2 的阴性对照 si-NC 均购自广州莱德尔生物科技有限公司;pLVX-IRES-Zs Green1-IGF2-AS 质粒由广州基迪奥生物科技有限公司合成;胎牛血清(FBS)、低糖DMEM培养基、LipofectamineTM2000转染试剂盒均购自上海西格生物科技有限公司;5-AZA购自湖北汉达飞生物科技有限公司;TRIzol试剂、逆转录试剂盒、荧光定量PCR(qRT-PCR)试剂盒均购自北京全式金生物技术有限公司;Pierce™ Magnetic RNA-Protein Pull-Down Kit 购自上海创赛科技有限公司;MTT试剂盒、RNA免疫沉淀(RIP)试剂盒购自广州赛诚生物科技有限公司;大鼠CD29-PE、CD90-PE-CyTM7、CD45-FITC 抗体购自美国 BD 公司;IGF2、间隙连接蛋白43(Cx43)、心肌肌钙蛋白T(cTnT)、心肌肌钙蛋白I(cTnI)、β-actin 兔多克隆抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自广州复能基因有限公司;ECL化学发光试剂盒、BCA试剂盒均购自郑州金图生物科技有限公司;CO2培养箱购自上海旦鼎国际贸易有限公司。
1.2 实验方法
1.2.1 BMSCs的分离与培养 参考文献[6]进行BMSCs的分离与培养。将大鼠脱颈处死后置于75%乙醇中浸泡10 min,在超净台中分离四肢长骨,用磷酸盐缓冲液(PBS)洗3次,剪掉骨骺端露出骨髓腔,利用无血清培养基将骨髓冲至15 mL离心管中,离心,弃上清液,利用含有10%FBS的低糖DMEM培养基悬浮细胞后接种于细胞培养瓶中,在37 ℃、5%CO2培养箱中进行常规传代培养,传代至第3代时用于后续实验,并利用倒置显微镜观察原代细胞、第3代细胞的形态。
1.2.2 BMSCs 表面抗原的鉴定 取第3 代生长状态良好的BMSCs,用0.25%胰蛋白酶消化后用PBS洗涤3次,在常温下以1 000 r/min 离心10 min,弃上清液,加入PBS 重悬细胞,并调整细胞浓度为1×107个/mL,分为6个试管,每管加入100µL细胞悬液,并分别加入CD29-PE、CD90-PE-CyTM7、CD45-FITC及其对应的同型对照抗体,4 ℃下避光孵育20 min,在常温下以1 000 r/min 离心10 min,弃上清液,加入500 µL PBS重悬细胞,利用流式细胞仪检测BMSCs 表面抗原CD29、CD90、CD45的表达。
1.2.3 细胞分组 利用瞬时转染技术进行转染,并将第3代生长良好的BMSCs 分为对照组(未做任何处理)、空载体组(转染pLVX-IRES-Zs Green1 载体)、lncRNA IGF2-AS 组(转染pLVX-IRES-Zs Green1-IGF2-AS)、5-AZA组(8µmol/L 5-AZA 处理)、si-NC 组(转染si-NC)、si-IGF2-AS 组(转染si-IGF2-AS)、si-IGF2 组(转染si-IGF2)、lncRNA IGF2-AS+si-NC 组(pLVX-IRES-Zs Green1-IGF2-AS 与 si-NC 共转染)、lncRNA IGF2-AS+si-IGF2 组(pLVX-IRES-Zs Green1-IGF2-AS与si-IGF2共转染)。转染48 h后,用于后续实验。
1.2.4 qRT-PCR 检 测 IGF2-AS mRNA 表达 使用 TRIzol 试剂从各组细胞中分离总RNA,使用逆转录试剂盒合成cDNA。所有反应均在20µL 反应体系中进行,PCR 反应条件:95 ℃10 min;95 ℃ 10 s,58 ℃ 20 s,72 ℃15 s,40 个循环。以GAPDH 为内参,利用 2-ΔΔCt法分析 IGF2-AS 的相对表达量。IGF2-AS 引物序列:上游5'-CCCCTGACCAAGAGACCAAC-3',下游 5'-TGAAATGGTACGACAGCGGC-3'。GAPDH 引物序列:上游5'-CACTGAGGACCAGGTTGTCT-3',下游5'-TGTCGTACCAGGAAATGAGC-3'。
1.2.5 MTT 法检测细胞活力 收集各组细胞并调整细胞浓度为6×107/L,分别取100 µL 加入到96 孔板中,置于37 ℃、5%CO2培养箱中培养24 h,弃上清液,加入80µL低糖DMEM培养液,再加入20µL MTT溶液继续孵育4 h,弃上清液,每孔加入150µL 二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。利用酶标仪测量490 nm处的光密度(OD)。
1.2.6 Western blot检测蛋白表达 利用预冷的RIPA裂解缓冲液提取各组细胞中的蛋白质,使用BCA试剂盒评估蛋白质浓度。通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总蛋白(30µg)。分离的蛋白质被转移到聚偏二氟乙烯(PVDF)膜上。将膜在室温下用5%脱脂奶粉封闭2 h 后,加入一抗IGF2(1∶2 000)、Cx43(1∶2 000)、cTnT(1∶1 000)、cTnI(1∶1 000)、β-actin(1∶1 500),在4 ℃下孵育过夜。次日,用TBST洗膜3次,再加入HRP偶联的羊抗兔二抗(1∶1 000),于室温下孵育1 h,通过ECL化学发光试剂盒检测蛋白质水平,以β-actin为内参,使用Image J软件量化蛋白质条带。
1.2.7 RNA 下拉检测 利用Pierce™Magnetic RNA-Protein Pull-Down Kit 进行RNA 下拉检测。将生物素化的NC 和IGF2-AS分别转染到BMSCs中。48 h后,将细胞裂解液与链酶亲和素标记的磁珠混合形成蛋白质-生物/RNA-磁珠复合物,用高盐洗脱得到蛋白质-生物/RNA 复合物,分别命名为bio-NC组、bio-IGF2-AS组,以Input作为阳性对照。最后,通过Western blot检测IGF2在蛋白质-生物/RNA混合物中的相对表达。
1.2.8 RNA 结合蛋白免疫沉淀(RIP)法检测 IGF2-AS 与IGF2蛋白结合 利用RIP试剂盒进行RIP分析。在RIP裂解缓冲液中裂解细胞,利用蛋白A/G磁珠对IGF2抗体进行免疫沉淀,用磁铁固定与复合物结合的磁珠并洗掉未结合的材料,提取RNA进行qRT-PCR分析IGF2-AS的相对表达量,免疫球蛋白G(IgG)作对照参考。
1.3 统计学方法 采用SPSS 22.0软件进行数据分析。计量资料以均数±标准差()表示,多组间均数比较采用单因素方差分析,多重比较行SNK-q检验,2 组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs 形态学观察及表面抗原鉴定 原代细胞在培养初期呈悬浮状,大多数呈圆形,培养48 h后开始贴壁生长;第3 代细胞呈长梭形,排列不整齐,相邻细胞间紧密连接,呈成纤维细胞样,见图1。流式细胞术鉴定结果显示,第3代BMSCs高表达CD29(98.21%)、CD90(92.54%),低表达CD45(3.67%),见图2。

Fig. 1 Morphology of BMSCs observed by inverted microscope(×400)图1 倒置显微镜观察BMSCs形态(×400)

Fig. 2 Detection of surface antigens CD29,CD90 and CD45 of BMSCs by flow cytometry图2 流式细胞仪检测BMSCs表面抗原CD29、CD90、CD45
2.2 过表达IGF2-AS对BMSCs中IGF2-AS表达、心肌样分化及细胞活力的影响 与对照组、空载体组相 比 ,lncRNA IGF2-AS 组 、5-AZA 组 BMSCs 中IGF2-AS mRNA 表达,Cx43、cTnT、cTnI 蛋白表达显著升高(P<0.05);与lncRNA IGF2-AS 组相比,5-AZA 组 BMSCs 中 IGF2-AS mRNA 表达,Cx43、cTnT、cTnI蛋白表达显著降低(P<0.05)。与对照组相比,空载体组、lncRNA IGF2-AS 组、5-AZA 组细胞活力(OD 值)显著降低,且5-AZA 组细胞活力明显低于lncRNA IGF2-AS组,见图3、表1。
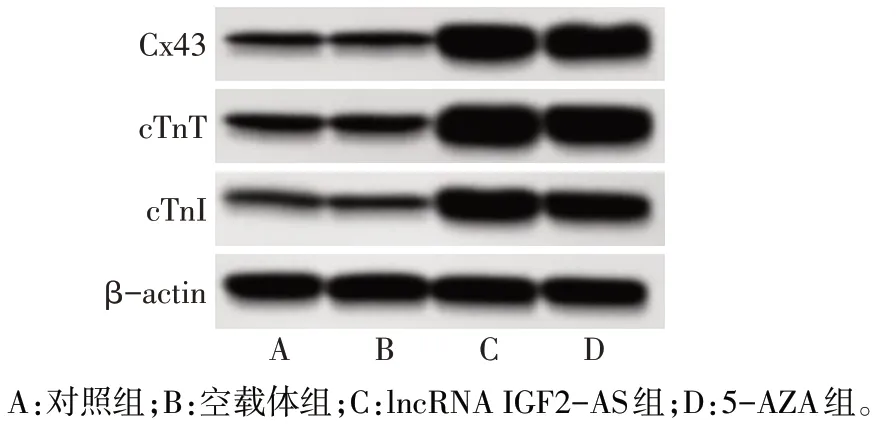
Fig.3 Effects of overexpression of IGF2-AS on the expression of Cx43,cTnT and cTnI proteins in BMSCs detected by Western blot assay图3 Western blot检测过表达IGF2-AS对BMSCs中Cx43、cTnT、cTnI蛋白表达的影响
Tab.1 Comparison of IGF2-AS mRNA expression,cardiomyocyte-like differentiation and cell viability between the four groups by overexpression of IGF2-AS表1 过表达IGF2-AS对各组IGF2-AS mRNA表达、心肌样分化及细胞活力比较 (n=6,)

Tab.1 Comparison of IGF2-AS mRNA expression,cardiomyocyte-like differentiation and cell viability between the four groups by overexpression of IGF2-AS表1 过表达IGF2-AS对各组IGF2-AS mRNA表达、心肌样分化及细胞活力比较 (n=6,)
**P<0.01;a与对照组比较,b与空载体组比较,c与lncRNA IGF2-AS组比较,P<0.05。
组别对照组空载体组lncRNA IGF2-AS组5-AZA组F IGF2-AS mRNA 1.02±0.14 1.04±0.12 2.46±0.17ab 1.68±0.17abc 120.784**Cx43/β-actin 0.41±0.03 0.45±0.04 1.72±0.16ab 1.49±0.09abc 311.133**组别对照组空载体组lncRNA IGF2-AS组5-AZA组F cTnT/β-actin 0.62±0.04 0.66±0.05 2.03±0.25ab 1.71±0.14abc 145.234**cTnI/β-actin 0.29±0.01 0.31±0.02 1.25±0.13ab 0.89±0.11abc 178.414**OD490 1.27±0.12 1.06±0.11a 1.03±0.14a 0.82±0.07abc 15.953**
2.3 沉默IGF2-AS对BMSCs中IGF2-AS表达、心肌样分化及细胞活力的影响 与对照组、si-NC 组相比,si-IGF2-AS 组 BMSCs 中 IGF2-AS mRNA 表达,Cx43、cTnT、cTnI 蛋白表达显著降低,5-AZA 组BMSCs 中 IGF2-AS mRNA 表达,Cx43、cTnT、cTnI 蛋白表达显著升高(P<0.05)。与对照组相比,si-NC组、si-IGF2-AS 组、5-AZA 组细胞活力显著降低,且5-AZA 组细胞活力明显低于si-IGF2-AS 组,见图4、表2。

Fig.4 Effects of silencing IGF2-AS on the expression of Cx43,cTnT and cTnI proteins in BMSCs detected by Western blot assay图4 Western blot检测沉默IGF2-AS对BMSCs中Cx43、cTnT、cTnI蛋白表达的影响SCs中Cx43、cTnT、cTnI蛋白表达的影响
Tab.2 Comparison of IGF2-AS mRNA expression,cardiomyocyte-like differentiation and cell viability between the four groups by silencing IGF2-AS表2 沉默IGF2-AS对各组IGF2-AS mRNA表达、心肌样分化及细胞活力比较 (n=6,)

Tab.2 Comparison of IGF2-AS mRNA expression,cardiomyocyte-like differentiation and cell viability between the four groups by silencing IGF2-AS表2 沉默IGF2-AS对各组IGF2-AS mRNA表达、心肌样分化及细胞活力比较 (n=6,)
**P<0.01;a与对照组比较,b与si-NC 组比较,c与si-IGF2-AS 组比较,P<0.05。
组别对照组si-NC组si-IGF2-AS组5-AZA组F IGF2-AS mRNA 1.03±0.12 1.01±0.13 0.42±0.03ab 1.66±0.12abc 132.086**Cx43/β-actin 0.43±0.04 0.46±0.03 0.15±0.01ab 1.48±0.06abc 1 318.452**组别对照组si-NC组si-IGF2-AS组5-AZA组F cTnT/β-actin 0.65±0.06 0.68±0.07 0.27±0.02ab 1.73±0.14abc 330.800**cTnI/β-actin 0.32±0.02 0.34±0.01 0.11±0.01ab 0.86±0.06abc 581.857**OD490 1.29±0.13 1.05±0.10a 1.02±0.12a 0.84±0.08abc 17.208**
2.4 IGF2-AS 上调IGF2 表达 通过生物信息数据库发现IGF2-AS 为IGF2 的反义转录本。Western blot 结果显示,与对照组、空载体组相比,lncRNA IGF2-AS 组细胞中IGF2 蛋白表达显著升高(P<0.05),见图5。与对照组、si-NC组相比,si-IGF2-AS组细胞中IGF2 蛋白表达显著降低(P<0.05),见图6。RNA下拉实验和RIP实验结果表明,IGF2-AS能与IGF2蛋白相互作用,见图7、8。
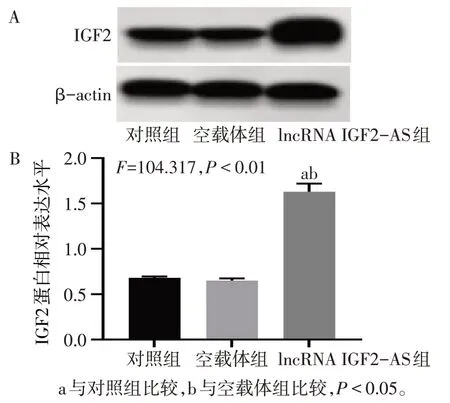
Fig.5 Effects of overexpression of IGF2-AS on IGF2 protein expression in BMSCs detected by Western blot assay图5 Western blot检测过表达IGF2-AS对BMSCs中IGF2蛋白表达的影响
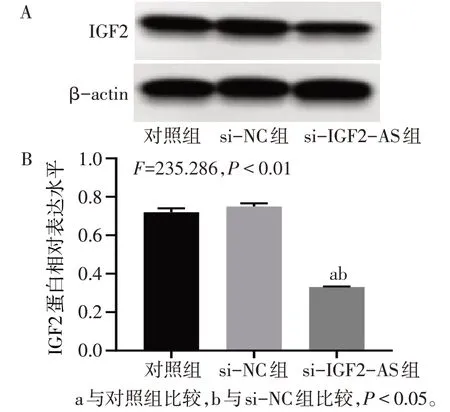
Fig.6 Effects of silencing IGF2-AS on IGF2 protein expression in BMSCs detected by Western blot assay图6 Western blot检测沉默IGF2-AS对BMSCs中IGF2蛋白表达的影响
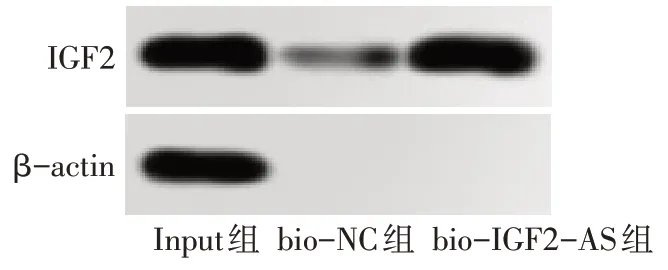
Fig.7 RNA pull-down experiment proved that IGF2 combined with IGF2-AS图7 RNA下拉实验证明IGF2与IGF2-AS结合
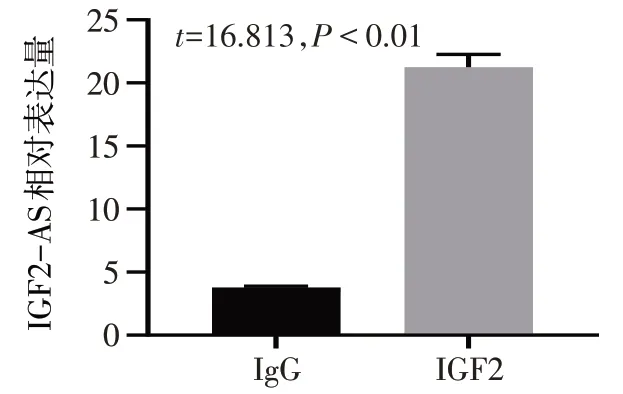
Fig.8 The interaction between IGF2-AS and IGF2 protein verified by RIP experiment图8 RIP实验验证IGF2-AS与IGF2蛋白相互作用
2.5 沉默 IGF2 对 BMSCs 中 IGF2 蛋白、心肌样分化及细胞活力的影响 与对照组、si-NC 组相比,si-IGF2组BMSCs中IGF2、Cx43、cTnT、cTnI蛋白表达显著降低,5-AZA 组BMSCs 中IGF2、Cx43、cTnT、cTnI蛋白表达显著升高(P<0.05)。与对照组相比,si-NC 组、si-IGF2 组、5-AZA 组细胞活力显著降低,且5-AZA 组细胞活力明显低于si-IGF2 组,见图9、表3。
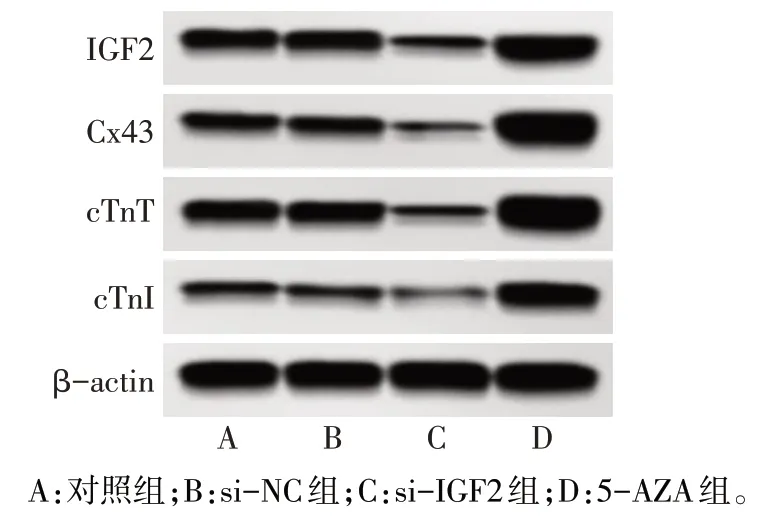
Fig.9 Effects of silencing IGF2 on protein expressions of IGF2,Cx43,cTnT and cTnI in BMSCs detected by Western blot assay图9 Western blot检测沉默IGF2对BMSCs中IGF2、Cx43、cTnT、cTnI蛋白表达的影响
Tab.3 Comparison of IGF2 protein,cardiomyocyte-like differentiation and cell viability between the four groups表3 各组IGF2蛋白、心肌样分化及细胞活力比较(n=6,)
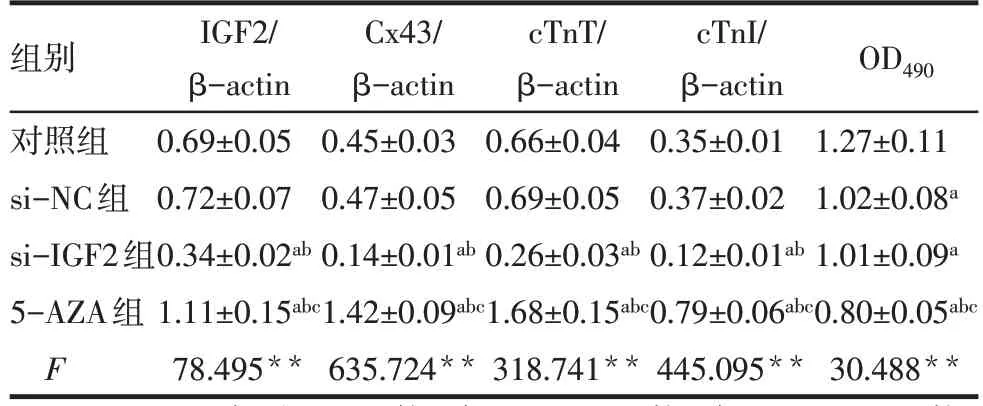
Tab.3 Comparison of IGF2 protein,cardiomyocyte-like differentiation and cell viability between the four groups表3 各组IGF2蛋白、心肌样分化及细胞活力比较(n=6,)
**P<0.01;a与对照组比较,b与si-NC组比较,c与si-IGF2组比较,P<0.05。
组别对照组si-NC组si-IGF2组5-AZA组F IGF2/β-actin 0.69±0.05 0.72±0.07 0.34±0.02ab 1.11±0.15abc 78.495**Cx43/β-actin 0.45±0.03 0.47±0.05 0.14±0.01ab 1.42±0.09abc 635.724**cTnT/β-actin 0.66±0.04 0.69±0.05 0.26±0.03ab 1.68±0.15abc 318.741**cTnI/β-actin 0.35±0.01 0.37±0.02 0.12±0.01ab 0.79±0.06abc 445.095**OD490 1.27±0.11 1.02±0.08a 1.01±0.09a 0.80±0.05abc 30.488**
2.6 沉默 IGF2 逆转了过表达 IGF2-AS 对 BMSCs 心肌样分化的促进作用 与对照组、空载体组相比,lncRNA IGF2-AS 组 、5-AZA 组 BMSCs 中 IGF2、Cx43、cTnT、cTnI 蛋白表达显著升高,且 lncRNA IGF2-AS组相应指标明显高于5-AZA组(P<0.05);与 lncRNA IGF2-AS 组、lncRNA IGF2-AS+si-NC 组相比,lncRNA IGF2-AS+si-IGF2 组 BMSCs 中 IGF2、Cx43、cTnT、cTnI 蛋白显著降低,但相应指标均高于对照组、空载体组(P<0.05),见图10、表4。

Fig.10 Effects of silencing IGF2 and overexpression of IGF2-AS on the protein expressions of IGF2,Cx43,cTnT and cTnI in BMSCs detected by Western blot assay图10 Western blot检测沉默IGF2及过表达IGF2-AS对BMSCs中IGF2、Cx43、cTnT、cTnI蛋白表达的影响
Tab.4 Comparison of IGF2 protein and cardiomyocytelike differentiation between the six groups表4 各组IGF2蛋白及心肌样分化比较(n=6,)
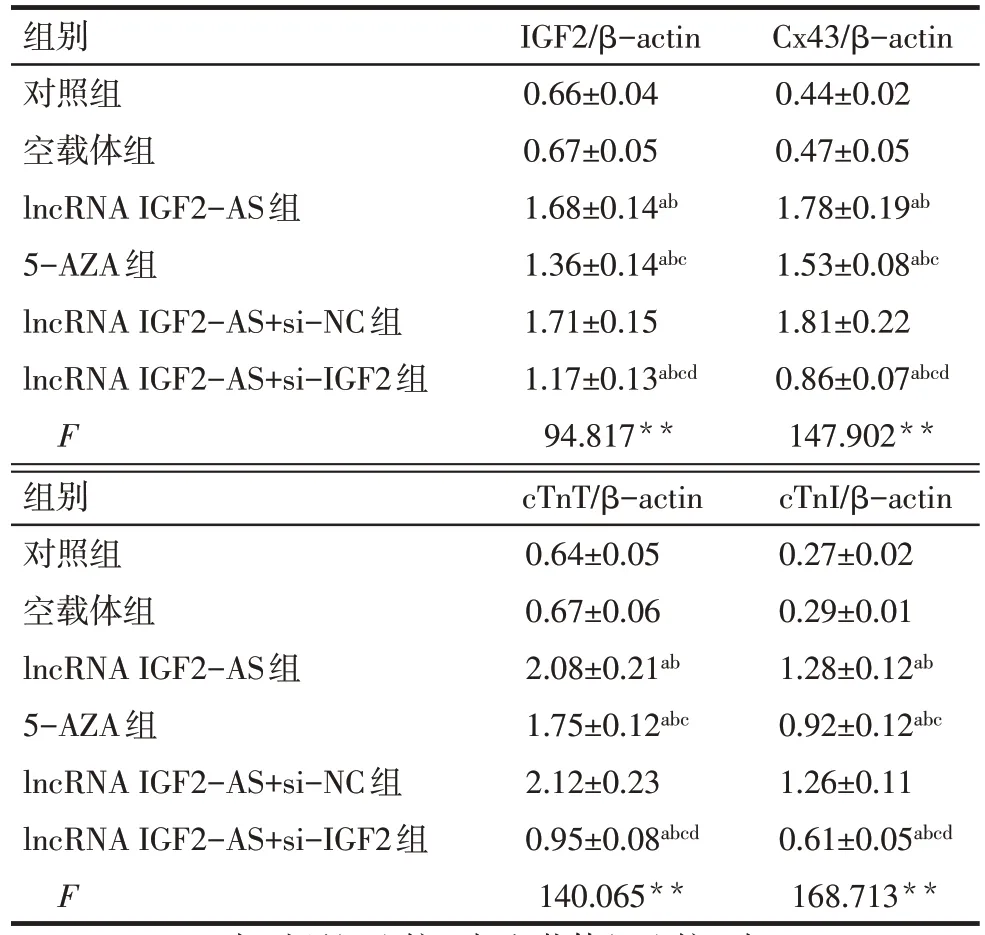
Tab.4 Comparison of IGF2 protein and cardiomyocytelike differentiation between the six groups表4 各组IGF2蛋白及心肌样分化比较(n=6,)
**P<0.01;a与对照组比较,b与空载体组比较,c与lncRNA IGF2-AS组比较,d与lncRNA IGF2-AS+si-NC组比较,P<0.05。
组别对照组空载体组lncRNA IGF2-AS组5-AZA组lncRNA IGF2-AS+si-NC组lncRNA IGF2-AS+si-IGF2组F IGF2/β-actin 0.66±0.04 0.67±0.05 1.68±0.14ab 1.36±0.14abc 1.71±0.15 1.17±0.13abcd 94.817**Cx43/β-actin 0.44±0.02 0.47±0.05 1.78±0.19ab 1.53±0.08abc 1.81±0.22 0.86±0.07abcd 147.902**组别对照组空载体组lncRNA IGF2-AS组5-AZA组lncRNA IGF2-AS+si-NC组lncRNA IGF2-AS+si-IGF2组F cTnT/β-actin 0.64±0.05 0.67±0.06 2.08±0.21ab 1.75±0.12abc 2.12±0.23 0.95±0.08abcd 140.065**cTnI/β-actin 0.27±0.02 0.29±0.01 1.28±0.12ab 0.92±0.12abc 1.26±0.11 0.61±0.05abcd 168.713**
3 讨论
3.1 BMSCs 的成功分离 近年来急性心肌梗死的发生率呈逐渐上升的趋势,该病发生过程中会导致心肌细胞丧失,严重影响人类健康[7]。BMSCs 移植是一种可行的方法,其通过分化为心肌细胞来修复缺血心肌,从而逆转心脏重塑、减轻心脏纤维化并改善心脏功能[8]。然而目前诱导BMSCs向心肌细胞分化的效率较低,成为影响BMSCs 移植疗效的因素之一[9]。有文献报道,大多数BMSCs 高表达细胞表面抗原CD29、CD90、CD44,低表达CD34、CD45[10]。本研究发现,第3代BMSCs细胞呈长梭形,相邻细胞间呈纤维细胞样,且高表达CD29、CD90,低表达CD45,表明从大鼠中成功分离BMSCs。
3.2 过表达IGF2-AS 可以促进BMSCs 心肌样分化 lncRNA 是一类非编码RNA,包含200多个核苷酸。其在表观遗传、转录和转录后等多个层面调节基因表达,广泛参与机体的生理与病理过程[11]。lncRNA IGF2-AS 是IGF2 的反义转录物,其通过调节 miR-3、126-5p/KLK4 轴增 强 BMSCs 的 成 骨 分化[12];IGF2-AS在小鼠成肌细胞中高表达,并参与肌管的形成[13],表明lncRNA IGF2-AS可参与细胞分化过程。但关于IGF2-AS 对BMSCs 心肌样分化的影响尚不明确。Cx43 是心肌细胞中最常见的连接蛋白,其正常表达是心脏正常活动及协调收缩与舒张的重要保证[14]。cTnT 在心肌组织中具有组织特异性,其高表达代表BMSCs已向心肌细胞分化[15]。在心肌收缩过程中,cTnI具有调节粗、细肌丝间的相对滑行的作用[16]。本研究结果显示,过表达IGF2-AS或 5-AZA 处理均可促进 BMSCs 中 Cx43、cTnT、cTnI蛋白表达,且lncRNA IGF2-AS组细胞活力明显高于5-AZA 组 ;沉 默 IGF2-AS 可抑 制 BMSCs 中 Cx43、cTnT、cTnI 蛋白表达,表明 IGF2-AS 转染或 5-AZA处理均可促进BMSCs 心肌样分化,且利用IGF2-AS转染引起的细胞损伤更轻,效果更佳。
3.3 过表达lncRNA IGF2-AS 通过上调IGF2 促进BMSCs心肌样分化 IGF2是位于7号染色体上的印迹基因,其可促进牛成肌细胞的分化[17],在小鼠胚胎干细胞定向分化为胰岛样细胞过程中高表达[18],且可增强来自根尖乳头的干细胞的成骨分化潜能[19]。本研究发现IGF2-AS 为IGF2 的反义转录本。有研究显示,反义转录物可以调节其有义链基因的转录和翻译[20]。推测 IGF2-AS 可能通过调控 IGF2 影响BMSCs 心肌样分化。为了验证该推测,本研究通过Western blot发现,过表达IGF2-AS可促进IGF2蛋白表达,沉默IGF2-AS 可抑制IGF2 蛋白表达,表明IGF2-AS 可能正向调控IGF2 的表达。为进一步验证该假设,本研究利用RNA 下拉和RIP 实验证实IGF2-AS能与IGF2蛋白相互作用,沉默IGF2逆转了过表达IGF2-AS 对BMSCs 心肌样分化的促进作用,最终证明了过表达lncRNA IGF2-AS 可通过上调IGF2促进BMSCs心肌样分化。因此,本研究为寻找高效诱导BMSCs 心肌样分化的方法提供了新的思路。

