骨髓间充质干细胞来源外泌体对炎症微环境中巨噬细胞表型及软骨细胞的调控作用
邢逸,窦一鸣,王敏,徐海楠,杨强,孙逊,赵艳红△
颞下颌关节骨关节炎(temporomandibular joint osteoarthritis,TMJ-OA)是临床中常见的颌面部关节疾病,发病率高。颞下颌关节软骨无血管,无神经,骨关节炎所致软骨缺损难以自我修复[1],亟需更有效的治疗手段来解决这一临床难题。骨软骨组织工程技术的发展为TMJ-OA提供了新的治疗策略。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)已广泛应用于骨软骨组织工程领域[2]。已有研究证明间充质干细胞(MSCs)的治疗作用主要通过旁分泌外泌体(exosomes,Exo)实现[3]。Exo是细胞分泌到胞外的直径为40~160 nm的双层脂质囊泡,可将蛋白质、微小RNA(miRNA)等运输到靶细胞,实现细胞间通讯[4]。由于Exo较细胞疗法具有更低的免疫原性,已作为细胞治疗的替代疗法应用在多种疾病的研究中。巨噬细胞(Mφ)是滑膜组织中参与骨关节炎(OA)炎症和组织损伤修复过程的主要免疫细胞[5],可分为经典激活M1 巨噬细胞(M1Mφ)和交替激活M2 巨噬细胞(M2Mφ)。M1Mφ释放炎性因子促进炎症微环境发展,M2Mφ 则产生抗炎因子抑制炎症发展[6]。M1Mφ/M2Mφ 比例的不同导致了炎症微环境中促炎/抗炎的平衡改变[7]。因而,M1Mφ和M2Mφ在TMJ-OA的发展过程中起到了关键作用,为TMJ-OA的防治提供了新的研究方向。转化生长因子(TGF)-β1是一种软骨形成诱导因子,可调控软骨细胞增殖及软骨细胞外基质的合成代谢,在OA的发病机制中起重要作用。相关研究已证实,抑制软骨中的TGF-β1 信号传导可导致关节软骨退化[8]。因此,TGF-β1是维持软骨完整性的重要靶点。本研究收集BMSCs 来源的Exo(BMSCs-Exo),旨在探讨BMSCs-Exo 在炎症微环境中对Mφ极化及促骨修复的调控作用,为治疗TMJ-OA 提供具有潜在临床应用价值的方向与方法。
1 材料与方法
1.1 主要材料 BMSCs、小鼠单核巨噬细胞白血病细胞RAW264.7细胞系、原代软骨细胞购自武汉普诺赛生物公司;DMEM 培养基、青霉素-链霉素双抗、胎牛血清(FBS)、0.25%胰蛋白酶购自Gibco公司;ALG2相互作用蛋白X(Alix)抗体、肿瘤易感基因101蛋白(TSG101)抗体、一氧化氮合酶(iNOS)抗体、精氨酸酶-1(Arg-1)抗体、基质金属蛋白酶(MMP)-13抗体购自Abcam公司;β-actin抗体、Ⅱ型胶原(COLⅡ)抗体、TGF-β1 抗体购自 Bioss 公司;白细胞介素(IL)-1β 购自Preprotech公司,干扰素(IFN)-γ购自R&D公司;RNA提取试剂盒购自福际生物公司;反转录试剂盒购自Takara 公司;qPCR SYBR®Green Master 试剂盒购自 Yeasen 公司;CCK-8试剂盒购自Biosharp 公司;GAPDH、iNOS、Arg-1、IL-1β、IL-6、COL2a1、TGF-β1 引物购自北京擎科生物科技有限公司;IL-1β、IL-6 酶联免疫吸附试验(ELISA)试剂盒购自索莱宝公司。
1.2 研究方法
1.2.1 BMSCs、RAW264.7、原代软骨细胞培养 将BMSCs、RAW264.7、原代软骨细胞以4.0×104个/mL 的密度接种于培养瓶中,加入适量含有10%FBS和1%青霉素-链霉素双抗的DMEM 完全培养基,置于5%CO2,饱和湿度的37 ℃培养箱中常规培养。细胞融合度为80%~90%时,0.25%胰蛋白酶消化2~3 min,使用完全培养基终止消化,1 000 r/min 离心5 min,以 1∶3 的比例传代。取 P2-P9 的 BMSCs、P2-P5 的原代软骨细胞及对数生长期的RAW264.7用于后续实验。
1.2.2 BMSCs-Exo 的提取及观察 BMSCs 传代后细胞培养过夜,更换为不含外泌体血清的培养基培养48 h,收集细胞培养上清液,置于-80 ℃保存。将收集的上清液通过以下差速离心步骤收集BMSCs-Exo:300 ×g,10 min;2 000 ×g,10 min;10 000 ×g,30 min;120 000 ×g,90 min。超速离心后,弃去上清液,沉淀即主要为BMSCs-Exo,用1 mL PBS 重悬,0.22µm滤膜过滤,-80 ℃保存。将20µL BMSCs-Exo 悬液滴加在铜网上,室温1 min后滴加20µL磷钨酸溶液,1 min后吸去磷钨酸溶液,红外灯下烘烤10 min,吸去多余液体,透射电镜(TEM)下观察Exo结构。
1.2.3 BMSCs-Exo促巨噬细胞、软骨细胞增殖能力检测 将RAW264.7 以 2×103个/孔的密度接种于 96 孔板中,实验分为对照组(0 mg/L Exo)、10 mg/L Exo组、50 mg/L Exo组。将软骨细胞以2×103个/孔的密度接种于96 孔板中,实验分为对照组、模型组(10 mg/L IL-1β 组)、治疗组(IL-1β+10 mg/L Exo组、IL-1β+50 mg/L Exo 组)。细胞培养24 h 后分别在各组孔中加入100µL 含不同剂量BMSCs-Exo 的完全培养基,继续培养24、48 h。在相应的时间点,每孔加入10µL CCK-8 反应液,置于37 ℃培养箱中反应2 h后,酶标仪检测各孔450 nm处的光密度(OD)值,每组均重复4次。
1.2.4 BMSCs-Exo 对巨噬细胞极化表型的影响及对炎症的调控 实验分组同1.2.3。将RAW264.7 以1×104个/孔的密度接种于6 孔板中,细胞贴壁后,使用20 µg/L 的IFN-γ 刺激RAW264.7 细胞24 h,使其极化为M1Mφ 后,弃去培养基,分别更换为含0、10、50 mg/L BMSCs-Exo 的完全培养基,继续培养24 h 后收集蛋白样本及总RNA 样本,以用于后续实验。
1.2.5 BMSCs-Exo 对炎症软骨细胞的调控作用 实验分组同1.2.3。将原代软骨细胞以1×104个/孔的密度接种于6孔板中,细胞贴壁后,使用10µg/L 的IL-1β刺激模型组和治疗组24 h;弃去培养基,在对照组和模型组中加入不含BMSCs-Exo的完全培养基,在治疗组中分别加入含10 mg/L 和50 mg/L BMSCs-Exo的完全培养基,继续培养24 h后收集蛋白样本及总RNA样本,以用于后续实验。
1.2.6 实时荧光定量聚合酶链式反应(qRT-PCR)检测巨噬细胞极化表型、炎性因子表达及软骨细胞表型 使用RNA提取试剂盒提取总RNA,Nanodrop 检测所提RNA 浓度及纯度。按照试剂盒说明加入反转录酶反转录及合成cDNA,-20 ℃保存。按照2×qPCR SYBR®Green Master的试剂盒说明配制反应体系,并上机检测。反应体系为:qPCR SYBR Green Master Mix 10µL,上、下游引物(10µmol/L)各0.4µL,cDNA 2µL,ddH2O 7.2 µL。反应条件为:95 ℃预变性5 min;95 ℃变性10 s,56 ℃退火20 s,72 ℃延伸20 s,共50 个循环;熔解曲线 95 ℃ 15 s,60 ℃ 1 min,95 ℃ 1 s。每组均重复 3 次。以GAPDH为内参基因,使用2-ΔΔCt法测定mRNA相对表达水平。相关基因引物序列见表1。

Tab.1 qRT-PCR primer sequence information表1 qRT-PCR引物序列信息
1.2.7 Western blot 检测巨噬细胞极化表型及软骨细胞表型 在蛋白样本中加入含有PMSF 和磷酸酶抑制剂的RIPA裂解液,置于冰上裂解 1 h,4 ℃ 12 000 r/min 离心20 min,取上清液,并用BCA试剂盒进行蛋白定量。在上清液中加入适量5×SDS 蛋白上样缓冲液,95 ℃金属浴煮沸蛋白10 min。配制PAGE 凝胶,在浓缩胶中上样蛋白30 µg,80 V 电压30 min,120 V电压60 min进行蛋白电泳,待溴酚蓝跑出分离胶底部即可停止电泳。将PAGE 凝胶转移到PVDF 膜中,转膜220 mA 90 min。5%脱脂奶粉室温封闭1 h 后,按蛋白marker 裁剪 PVDF 膜条带,在 Alix、TSG101、iNOS、Arg-1、MMP-13、β-actin、COLⅡ、TGF-β1 一抗中 4 ℃孵育过夜。TBST洗膜10 min 3次,辣根过氧化物酶标记的二抗室温孵育1 h,TBST再次洗膜10 min 3次。加入ECL发光液,于化学发光显影系统中观察。
1.2.8 ELISA 检测巨噬细胞炎性因子蛋白表达水平 实验分组同1.2.3。将RAW264.7以1×104个/孔的密度接种于6孔板中,细胞贴壁后,使用20 µg/L 的IFN-γ 刺激RAW264.7 细胞24 h,使其极化为M1Mφ后,弃去培养基,分别更换为含0、10、50 mg/L BMSCs-Exo的完全培养基,继续培养24 h后收集细胞培养上清液,1 000 r/min 离心 10 min,取上清液,-80 ℃保存。配制蛋白标准品,将样本和标准品分别加入IL-1β及IL-6 抗体预包被酶标板反应孔中,37 ℃培养箱中孵育90 min,洗板4 次;加入生物素化抗体工作液至反应孔中,孵育60 min后洗板4次;加入酶结合物工作液至反应孔中,孵育30 min后洗板4次;加入显色液至反应孔中,避光孵育30 min后加入终止液,酶标仪检测各孔450 nm 处的OD 值,计算出细胞上清中的IL-1β 及IL-6 蛋白表达水平。每组均重复3次。
1.3 统计学方法 采用SPSS 22.0 软件对实验数据进行分析。符合正态分布的计量资料以均数±标准差()表示,2组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析(ANOVA),组间多重比较时方差齐行LSD-t法,方差不齐行Dunnett’s T3检验。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs-Exo 的提取与表征 透射电镜观察到BMSCs-Exo 为圆形囊泡,呈杯状,为双层膜结构,粒径大小约为100 nm,与外泌体结构一致(图1A)。Western blot 结果示,该囊泡表达外泌体特征蛋白Alix、TSG101,进一步证明收集到的囊泡为BMSCs-Exo(图1B)。
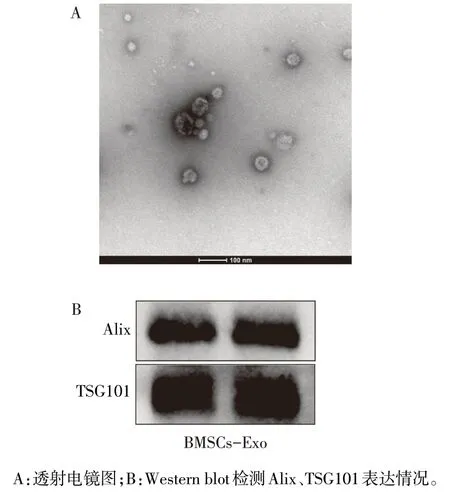
Fig.1 Identification of BMSCs-Exo图1 BMSCs-Exo的鉴定
2.2 BMSCs-Exo 对巨噬细胞及软骨细胞增殖的影响 与24 h 相比,巨噬细胞培养48 h 后细胞数目增加,且50 mg/L Exo 组细胞数目最多,见表2。模型组中的IL-1β 明显抑制了软骨细胞的增殖,而加入50 mg/L Exo处理后,IL-1β的抑制作用减轻,细胞增殖较模型组明显,见表3。以上结果证明BMSCs-Exo具有良好的生物相容性,能促进细胞增殖。
Tab.2 Comparison of the proliferation promoting effects of BMSC-Exos on macrophages for 24 h and 48 h表2 BMSC-Exos对巨噬细胞作用24 h和48 h的促增殖效果比较 (n=4,OD值,)
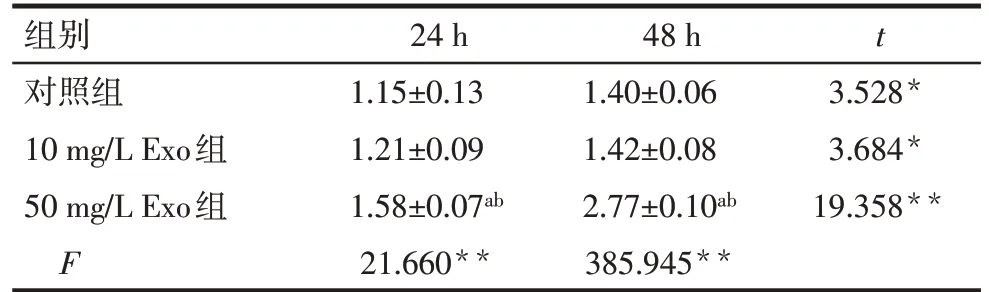
Tab.2 Comparison of the proliferation promoting effects of BMSC-Exos on macrophages for 24 h and 48 h表2 BMSC-Exos对巨噬细胞作用24 h和48 h的促增殖效果比较 (n=4,OD值,)
*P<0.05,**P<0.01;a 与对照组比较,b 与 10 mg/L Exo 组比较,P<0.05。
组别对照组10 mg/L Exo组50 mg/L Exo组F 24 h 1.15±0.13 1.21±0.09 1.58±0.07ab 21.660**1.40±0.06 1.42±0.08 2.77±0.10ab 385.945**48 h t 3.528*3.684*19.358**
Tab.3 Comparison of the proliferation promoting effects of BMSC-Exos on chondrocytes for 24 h and 48 h表3 BMSC-Exos对软骨细胞作用24 h和48 h的促增殖效果比较 (n=4,OD值,)
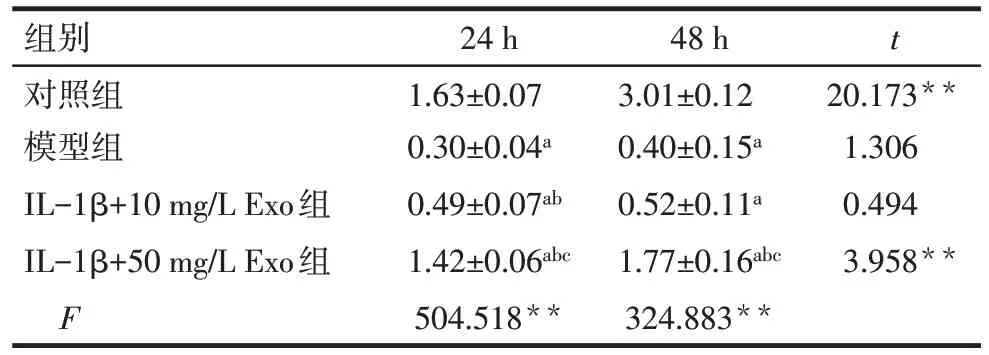
Tab.3 Comparison of the proliferation promoting effects of BMSC-Exos on chondrocytes for 24 h and 48 h表3 BMSC-Exos对软骨细胞作用24 h和48 h的促增殖效果比较 (n=4,OD值,)
*P<0.05,**P<0.01;a与对照组比较,b与模型组比较,c与IL-1β+10 mg/L Exo组比较,P<0.05。
组别对照组模型组IL-1β+10 mg/L Exo组IL-1β+50 mg/L Exo组F 24 h 1.63±0.07 0.30±0.04a 0.49±0.07ab 1.42±0.06abc 504.518**48 h 3.01±0.12 0.40±0.15a 0.52±0.11a 1.77±0.16abc 324.883**t 20.173**1.306 0.494 3.958**
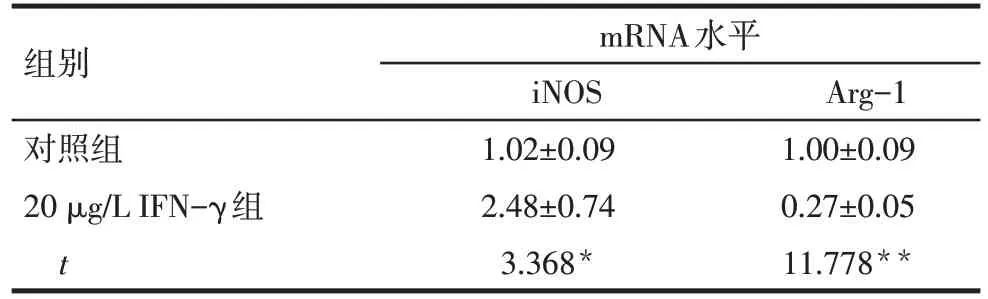
2.3 BMSCs-Exo 对巨噬细胞形态的影响 未对巨噬细胞进行干预时,细胞形态较圆,生长状态良好,呈团状聚集(图2A)。使用20µg/L IFN-γ 刺激24 h后,iNOS 表达水平升高,Arg-1 表达水平降低,证明巨噬细胞细胞极化为M1Mφ,见表4,且细胞呈不规则形态,可见伪足(图2B)。Mφ在极化为M1Mφ后,使用不同剂量的BMSCs-Exo 对M1型巨噬细胞进行干预。BMSCs-Exo 为10 mg/L 时,细胞形态发生改变,细胞变圆,但仍可见部分有伪足细胞(图2C);50 mg/L时,基本无分化细胞,细胞形态较圆,细胞密集(图2D)。
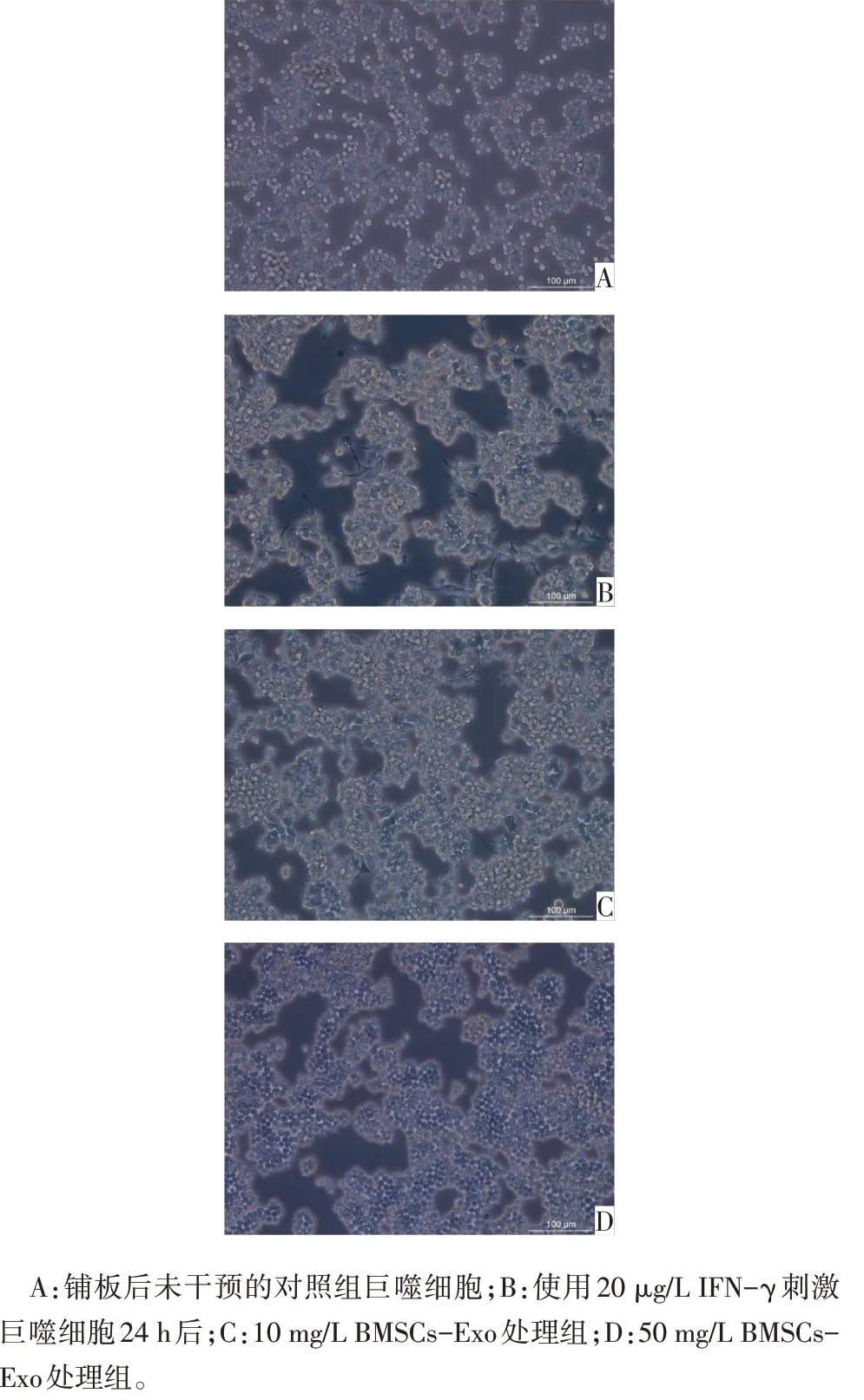
Fig.2 Macrophage cell morphology of different treatment groups(Scale bar represents 100µm)图2 不同处理组巨噬细胞形态(标尺=100µm)
Tab.4 Comparison of mRNA levels of M1/M2 macrophage-related markers after IFN-γ stimulation表4 IFN-γ刺激后M1/M2巨噬细胞相关标志物的mRNA水平比较 (n=3,)
Tab.4 Comparison of mRNA levels of M1/M2 macrophage-related markers after IFN-γ stimulation表4 IFN-γ刺激后M1/M2巨噬细胞相关标志物的mRNA水平比较 (n=3,)
*P<0.05,**P<0.01。
组别对照组20µg/L IFN-γ组t mRNA水平iNOS 1.02±0.09 2.48±0.74 3.368*Arg-1 1.00±0.09 0.27±0.05 11.778**
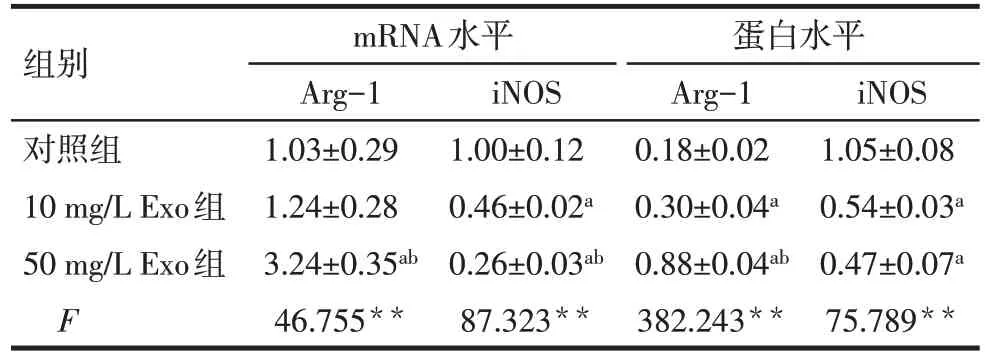
2.4 BMSCs-Exo 对巨噬细胞表型极化的调控作用 与对照组相比,10 mg/L 和50 mg/L BMSCs-Exo处理组的M1表型相关蛋白iNOS的表达降低;而M2表型相关蛋白Arg-1 表达增多,50 mg/L Exo 组的Arg-1表达量显著增多,见图3、表5。mRNA 检测结果显示,与对照组相比,BMSCs-Exo 的处理可降低M1表型相关基因iNOS的表达,升高M2表型相关基因Arg-1 的表达水平,与Western blot 的结果趋势一致,见表5。BMSCs-Exo 具有调控巨噬细胞表型极化的作用,可促M1向M2表型极化。
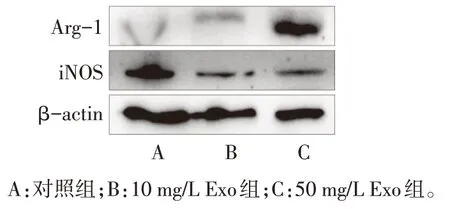
Fig.3 Macrophage phenotypic polarization图3 巨噬细胞表型极化
Tab.5 Comparison of the regulatory effects of different doses of BMSCs-Exo on expression levels of phenotypeassociated markers in M1/M2 macrophages表5 不同剂量BMSCs-Exo对M1/M2巨噬细胞表型相关标志物表达水平的调控作用比较(n=3,)
Tab.5 Comparison of the regulatory effects of different doses of BMSCs-Exo on expression levels of phenotypeassociated markers in M1/M2 macrophages表5 不同剂量BMSCs-Exo对M1/M2巨噬细胞表型相关标志物表达水平的调控作用比较(n=3,)
**P<0.01;a与对照组比较,b与10 mg/L Exo组比较,P<0.05。
组别对照组10 mg/L Exo组50 mg/L Exo组F mRNA水平Arg-1 1.03±0.29 1.24±0.28 3.24±0.35ab 46.755**iNOS 1.00±0.12 0.46±0.02a 0.26±0.03ab 87.323**蛋白水平Arg-1 0.18±0.02 0.30±0.04a 0.88±0.04ab 382.243**iNOS 1.05±0.08 0.54±0.03a 0.47±0.07a 75.789**
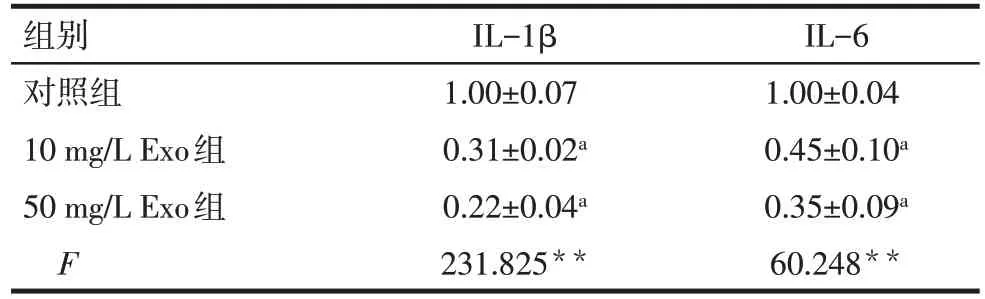
2.5 BMSCs-Exo 对炎性因子表达的调控 与对照组相比,BMSCs-Exo 处理组的炎性因子IL-1β、IL-6的 mRNA 表达水平显著降低(P<0.05),见表 6。ELISA检测结果显示,对照组细胞培养上清液中IL-1β 及 IL-6 的蛋白表达水平较高,50 mg/L BMSCs-Exo 处理可降低IL-1β及IL-6的蛋白表达水平(P<0.05),见表7。
Tab.6 Comparison of the regulatory effects of different doses of BMSCs-Exo on the mRNA expression levels of inflammatory factors in macrophages表6 不同剂量BMSCs-Exo对巨噬细胞炎性因子mRNA水平的调控作用比较 (n=3,)
Tab.6 Comparison of the regulatory effects of different doses of BMSCs-Exo on the mRNA expression levels of inflammatory factors in macrophages表6 不同剂量BMSCs-Exo对巨噬细胞炎性因子mRNA水平的调控作用比较 (n=3,)
**P<0.01;a与对照组比较,P<0.05。
组别对照组10 mg/L Exo组50 mg/L Exo组F IL-1β 1.00±0.07 0.31±0.02a 0.22±0.04a 231.825**IL-6 1.00±0.04 0.45±0.10a 0.35±0.09a 60.248**
Tab.7 Comparison of the regulatory effects of different doses of BMSCs-Exo on the expression levels of inflammatory factor proteins in macrophages表7 不同剂量BMSCs-Exo对巨噬细胞炎性因子蛋白表达水平的调控作用比较 (n=3,ng/L,)

Tab.7 Comparison of the regulatory effects of different doses of BMSCs-Exo on the expression levels of inflammatory factor proteins in macrophages表7 不同剂量BMSCs-Exo对巨噬细胞炎性因子蛋白表达水平的调控作用比较 (n=3,ng/L,)
*P<0.05,**P<0.01;a 与对照组比较,b 与 10 mg/L Exo 组比较,P<0.05。
组别对照组10 mg/L Exo组50 mg/L Exo组F IL-1β 27.81±8.84 26.88±6.80 12.11±3.27ab 5.169*IL-6 7.25±1.25 2.03±1.05a 3.04±1.40a 14.877**
2.6 BMSCs-Exo 对炎症软骨细胞的调控 与模型组相比,BMSCs-Exo 处理组的软骨细胞成软骨相关蛋白COLⅡ及TGF-β1 表达明显升高,而MMP-13表达显著降低,见图4、表8。mRNA 水平结果显示,IL-1β 刺激抑制了COL2a1、TGF-β1 的mRNA 表达,并升高MMP-13 mRNA 的表达水平,而50 mg/L BMSCs-Exo 处理组的 COL2a1、TGF-β1 的 mRNA 表达水平则显著高于模型组,见表9。
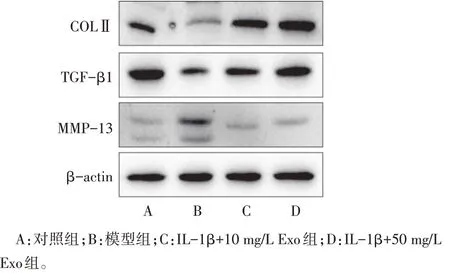
Fig.4 Expression levels of chondrogenesis-related proteins图4 成软骨相关蛋白的表达水平
Tab.8 Comparison of the regulatory effects of different doses of BMSCs-Exo on the expression levels of chondrogenic-related proteins in chondrocytes表8 不同剂量BMSCs-Exo对软骨细胞成软骨相关蛋白表达水平的调控作用比较 (n=3,)
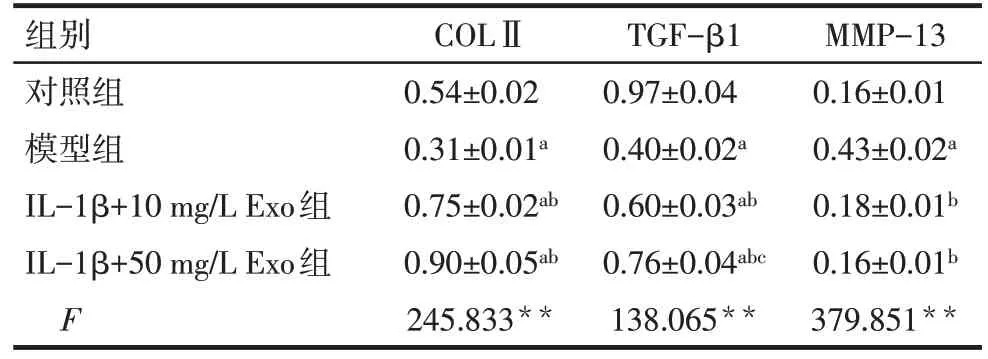
Tab.8 Comparison of the regulatory effects of different doses of BMSCs-Exo on the expression levels of chondrogenic-related proteins in chondrocytes表8 不同剂量BMSCs-Exo对软骨细胞成软骨相关蛋白表达水平的调控作用比较 (n=3,)
**P<0.01;a与对照组比较,b与模型组比较,c与IL-1β+10 mg/L Exo组比较,P<0.05。
组别对照组模型组IL-1β+10 mg/L Exo组IL-1β+50 mg/L Exo组F COLⅡ0.54±0.02 0.31±0.01a 0.75±0.02ab 0.90±0.05ab 245.833**TGF-β1 0.97±0.04 0.40±0.02a 0.60±0.03ab 0.76±0.04abc 138.065**MMP-13 0.16±0.01 0.43±0.02a 0.18±0.01b 0.16±0.01b 379.851**
Tab.9 Comparison of the regulatory effects of different doses of BMSCs-Exo on the mRNA expression levels of chondrogenesis-related genes in chondrocytes表9 不同剂量BMSCs-Exo对软骨细胞成软骨相关基因mRNA表达水平的调控作用比较(n=3,)
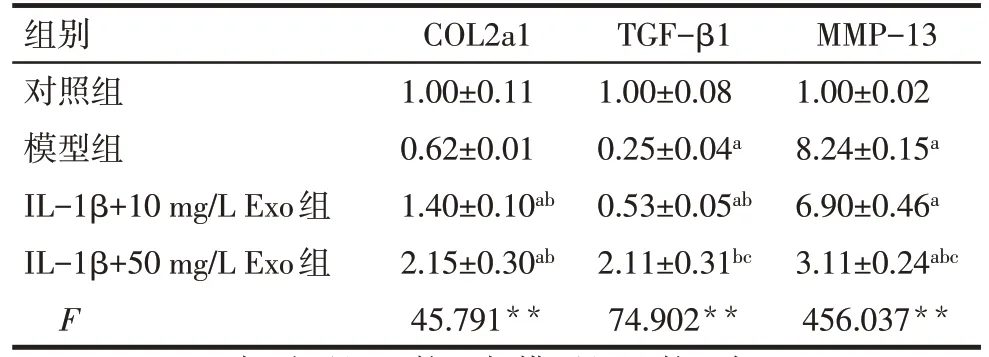
Tab.9 Comparison of the regulatory effects of different doses of BMSCs-Exo on the mRNA expression levels of chondrogenesis-related genes in chondrocytes表9 不同剂量BMSCs-Exo对软骨细胞成软骨相关基因mRNA表达水平的调控作用比较(n=3,)
**P<0.01;a与对照组比较,b与模型组比较,c与IL-1β+10 mg/L Exo组比较,P<0.05。
组别对照组模型组IL-1β+10 mg/L Exo组IL-1β+50 mg/L Exo组F COL2a1 1.00±0.11 0.62±0.01 1.40±0.10ab 2.15±0.30ab 45.791**TGF-β1 1.00±0.08 0.25±0.04a 0.53±0.05ab 2.11±0.31bc 74.902**MMP-13 1.00±0.02 8.24±0.15a 6.90±0.46a 3.11±0.24abc 456.037**
3 讨论
3.1 治疗TMJ-OA 的骨软骨组织工程策略 TMJOA 病理机制复杂,涉及软骨退变、滑膜炎症等[9]。现阶段TMJ-OA的治疗方法主要分为保守治疗与手术治疗,但均存在局限性。保守治疗仅能缓解局部症状,手术治疗具有免疫排斥等风险[10]。因此,开发新的治疗手段是目前TMJ-OA 领域亟需解决的难题。
组织工程是一种以实现受损组织结构和功能再生的新兴治疗技术,其中,MSCs 是研究较为深入的组织工程种子细胞[11]。尽管干细胞疗法在再生医学中具有良好的前景,但目前干细胞的临床应用仍存有争议[12]。BMSCs-Exo 具有与 BMSCs 相似的功能特性,与干细胞疗法相比,Exo避免了干细胞应用中的伦理及肿瘤发生等问题,更易对靶细胞进行调控,被认为是干细胞疗法的替代[13]。MSCs 衍生的Exo可通过调节免疫系统、刺激细胞增殖等发挥治疗作用[14]。基于此,本研究提取了BMSCs-Exo,通过体外实验探索了其对Mφ表型极化的影响及在炎症微环境中发挥的免疫调控作用;结果显示,所收集的囊泡具有双层膜结构,表达外泌体特征性表面蛋白,并且BMSCs-Exo 具有良好的生物相容性,可促进巨噬细胞及软骨细胞增殖。
3.2 BMSCs-Exo可极化Mφ表型及维持软骨细胞表型 Mφ 是骨关节滑膜液中主要的免疫细胞,在TMJ-OA 的发病机制中发挥着重要的作用[15]。Mφ易受微环境刺激,M1Mφ 可释放高水平的促炎因子IL-1β、IL-6等,促进炎症的发生发展;M2Mφ可产生抗炎因子IL-1α、Arg-1 等,缓解炎症反应并促进组织修复再生[6]。本研究结果显示,当巨噬细胞极化为M1Mφ,经BMSCs-Exo 处理后,M1Mφ 中高表达的iNOS 表达水平降低,50 mg/L BMSCs-Exo 与 10 mg/L BMSCs-Exo 相比,可更明显下调iNOS 的表达,并显著上调M2Mφ相关蛋白Arg-1的表达水平。
M1Mφ 和M2Mφ 之间的平衡与TMJ-OA 的严重程度相关[7]。在OA 患者的滑膜液中可检测到高水平促炎因子和大量的M1Mφ。已有研究证明,通过改变 M1Mφ/M2Mφ 比例可有效缓解炎症反应[16]。Kim等[17]发现,M2Mφ衍生的外泌体可以将M1Mφ重编程为M2Mφ,达到抗炎及促进皮肤伤口愈合的目的。Zheng 等[18]报道了原代软骨细胞衍生的外泌体可以增加M2Mφ 的浸润,减少M1Mφ 的数量,抑制OA 的发展。本研究中,50 mg/L BMSCs-Exo 能显著诱导 M1Mφ 高表达M2Mφ 表型相关基因,BMSCs-Exo具有调控M1Mφ向M2Mφ极化的能力,与上述报道一致。
TGF-β1可促进软骨细胞增殖、Ⅱ型胶原聚集和蛋白聚糖的分泌[19],并导致Smad2磷酸化,进而上调软骨标志物Col2a1、Sox9、Acan表达水平以促进软骨生成[20]。本研究中也发现了BMSCs-Exo 在炎症软骨细胞中具有一致的效果,进一步证实了BMSCs-Exo 在炎症微环境中可促进软骨细胞增殖,维持软骨细胞表型,具有促进软骨修复的作用。笔者通过观察BMSCs-Exo 对炎症软骨细胞的调控发现,BMSCs-Exo 处理能减少IL-1β 对TGF-β1 的抑制作用,降低MMP-13 表达,升高COL2a1 表达水平。本研究证明了在炎症的免疫调节过程中,Mφ极化与炎性因子表达有关,BMSCs-Exo处理后的M1Mφ中,极化表型可发生改变,IL-1β 和 IL-6 的 mRNA 表达水平下调,有助于降低炎症微环境中的炎性因子水平,同时可促进炎症微环境中的软骨修复。
综上所述,BMSCs-Exo 可通过调控Mφ 的表型极化,降低炎性因子表达水平,同时促进炎症微环境中的软骨修复,为探索BMSCs-Exo 缓解TMJ-OA 和参与组织再生的机制提供了新的思路与方向。BMSCs-Exo对TMJ-OA的作用及其更深入的机制还有待于更进一步的研究发现。

