三七总皂苷对流产大鼠子宫出血的影响及子宫内膜修复作用机制的研究
张靖,李潇
目前,米非司酮联合米索前列醇为终止早孕常用的药物流产方案,然而,该方案仍可能引起不完全流产[1-2]。子宫内膜是妊娠成功的关键因素,易受感染、药物及各种宫腔操作的影响。异常子宫出血(abnormal uterine bleeding,AUB)是不完全流产常见的严重不良反应,如不尽早治疗极易引发贫血,造成子宫内膜纤维化、宫腔粘连,进而导致反复流产、月经异常出血和其他妇科并发症[3-4]。因此,预防和治疗不完全流产引起的AUB 具有重要意义。三七是一味传统中药,具有活血化瘀、镇定止痛的功效,又有止血功效。《本草纲目》记载三七可治“崩中经水不止,产后恶血不下”。有研究显示,三七对AUB有较好的疗效[5-6],但其发挥作用的具体成分及机制尚不明确。三七总皂苷是从三七根中提取的重要化合物,长期以来被用作止血药[7-8]。有关三七总皂苷对AUB保护作用的相关研究鲜见。本研究旨在探讨三七总皂苷对流产大鼠子宫出血的影响及潜在作用机制。
1 材料与方法
1.1 实验动物 SPF级雌性SD大鼠70只,7~8周龄,平均体质量(240±20)g;雄性 SD 大鼠 30 只,7~8 周龄,平均体质量(280±20)g,购自北京维通利华实验动物技术有限公司,生产许可证为SCXK(京)2019-0009。大鼠饲养于温度(20±2)℃、湿度45%~55%、12 h光照/12 h黑暗周期条件下,自由饮水和摄食。实验经本院伦理委员会批准,并按实验动物使用3R原则给予人道关怀。
1.2 主要试剂与仪器 三七总皂苷(纯度≥98%,成都普菲德生物技术有限公司,批号JOT-11108);米索前列醇(华润紫竹药业有限公司,批号43171106,规格0.2 mg×3片/盒);米非司酮(湖北葛店人福药业有限责任公司,批号180102,规格25 mg×60片/盒);断血流片(回音必集团安徽制药有限公司,批号14000433810,规格0.42 g×60 片/盒);大鼠血浆雌二醇(estradiol,E2)、孕酮(progesterone,P)、肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-6、6-酮前列腺素F1α(6-keto-prostaglandin F1α,6-keto-PGF1α)、血栓素B2(thromboxane B2,TXB2)酶联免疫吸附试验(enzymelinked immuno sorbent assay,ELISA)试剂盒均购自上海酶联生物科技有限公司;兔抗大鼠CD31抗体、羊抗兔IgG 二抗均购自英国abcam 公司;实时荧光定量PCR(quantitative PCR,qPCR)引物由上海GenePharma 公司设计合成。NanoDrop 2000分光光度计(美国Thermo Scientific);ABI7500实时荧光定量PCR仪(美国应用生物系统公司);iMark680多功能酶标仪、蛋白转膜装置(美国Bio-Rad 公司);BZ-X800E一体化荧光显微成像系统(日本Keyence公司)。
1.3 模型制备及分组 按随机数字表法抽取10只雌性大鼠为空白对照组,将其余处于动情周期的雌性和雄性大鼠按照雌∶雄=2∶1的比例进行合笼交配,成功交配后,次日清晨对雌性大鼠进行阴道涂片,并置于显微镜下观察,若镜下(×400)可见阴栓或游动精子,则为受孕成功大鼠,记为妊娠第1天,参考文献[9]采用米非司酮(8.3 mg/kg)和米索前列醇(100µg/kg)诱导建立AUB 模型。将50 只模型制作成功大鼠随机分为模型组、阳性组(断血流片,0.45 g/kg)以及三七总皂苷低(25 mg/kg)、中(50 mg/kg)、高(100 mg/kg)剂量组[10],每组10只。阳性组给予断血流片0.45 g/kg灌胃,三七总皂苷各剂量组给予相应剂量的三七总皂苷灌胃,空白对照组和模型组给予等体积生理盐水灌胃,1次/d,共7 d。
1.4 子宫出血量测定 除空白对照组外,其余各组大鼠在给药的同时将1 个称取质量后的棉球(85~100 mg)放入阴道。分别于8:00和18:00将棉球取出,放入密闭EP管中于4 ℃保存,取出旧棉球的同时将新棉球放入阴道内,以上操作连续7 d 至给药结束。给药结束后,采集大鼠眼眶静脉血20µL,用4 mL 5%NaOH 溶解。将收集的每只大鼠的棉球置于EP管内,加5 mL 5%NaOH浸渍提取24 h,并充分挤压棉球血渍至血液完全浸出,过滤后在546 nm波长处测定浸提液以及大鼠静脉血溶解液的吸光度(A)值,子宫出血量(µL)=[静脉血量(µL)×A棉球血浸提液×浸泡棉球血所用 NaOH 体积(mL)]/[A静脉血×溶解静脉血所用NaOH体积(mL)]。
1.5 ELISA 检测血浆炎性因子、E2、P、TXB2 以及 6-keto-PGF1α 水平 给药结束后,戊巴比妥钠麻醉大鼠,经腹主动脉取血2 mL,静置后1 500 r/min离心10 min,分离血浆,按照ELISA 试剂盒说明书检测血浆TNF-α、IL-6、E2、P、TXB2、6-keto-PGF1α水平。
1.6 子宫内膜病理损伤观察 取大鼠子宫,分为2 部分,一部分-80 ℃冰箱保存;另一部分置于4%多聚甲醛中固定过夜,包埋在石蜡中,切4 µm 厚切片,分别进行HE 染色和Masson 染色观察子宫内膜的病理损伤和胶原蛋白的积累。每张切片均随机读取4个高倍镜视野,计数子宫内膜腺体数量,并用Image-Pro Plus 6.0图像分析软件测量子宫内膜的厚度和子宫内膜的纤维化面积比。子宫内膜厚度为子宫浆膜层和子宫腔表面之间的垂直距离。纤维化面积比=子宫内膜间质的纤维化面积/子宫内膜的间质以及腺体总面积(不包括子宫腔)×100%。
1.7 免疫荧光染色法检测子宫内膜组织中微血管密度(MVD) 取1.6 制备的子宫组织石蜡块,切取子宫内膜组织5µm,微波修复后用10%正常山羊血清封闭1 h,加入一抗兔抗大鼠CD31 抗体(1∶100),4 ℃过夜,洗去一抗,滴加二抗羊抗兔lgG-FITC(1∶200),室温孵育1 h,DAPI 复染细胞核,甘油封片,于荧光显微镜下(×400)取3个视野,计算微血管数,取平均值作为该组织切片的MVD。子宫内膜组织中CD31标记的内皮细胞呈红色荧光,DAPI重染细胞核呈蓝色荧光,合并图像中的亮色是微血管。
1.8 qPCR检测子宫组织血管内皮生长因子(VEGF)、基质金属蛋白酶(MMP)-2和MMP-9mRNA的表达 取-80 ℃冰箱保存的子宫组织,剪碎后使用Trizol 试剂提取总RNA。分光光度计测量总RNA 浓度。使用PrimeScriptTMRT 试剂盒将RNA 反转录为互补DNA(cDNA),进行qPCR。反应体系(20 µL):SYBR®Premix Ex TaqTM(2×)10 µL,上下游引物各0.8 µL,cDNA 2 µL,ddH2O 6.4 µL。反应条件:95 ℃预变性1 min;95 ℃变性18 s,60 ℃持续55 s,最后72 ℃延伸2 min,40个循环。所有反应均重复3 次。mRNA 的表达量采用2-ΔΔCt方法计算,β-actin作为内参,引物序列见表1。

Tab.1 qPCR primer sequence表1 qPCR引物序列
1.9 统计学方法 采用GraphPad Prism 9.0软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠子宫出血量和TXB2、6-keto-PGF1α水平比较 与空白对照组比较,模型组大鼠血浆TXB2 水 平 降 低 ,6-keto-PGF1α 水 平 增 加(P<0.05);与模型组比较,阳性组和三七总皂苷高剂量组大鼠子宫出血量、6-keto-PGF1α 水平降低,TXB2水平增加(P<0.05);与阳性组比较,三七总皂苷高剂量组大鼠上述指标差异无统计学意义(P>0.05),而三七总皂苷低剂量组子宫出血量、6-keto-PGF1α水平均增加,TXB2水平降低(P<0.05),三七总皂苷中剂量组子宫出血量增加,TXB2 水平降低(P<0.05),见表2。
Tab.2 Comparison of uterine bleeding and coagulation function of rats between the six groups表2 各组大鼠子宫出血量及凝血功能比较(n=10,)
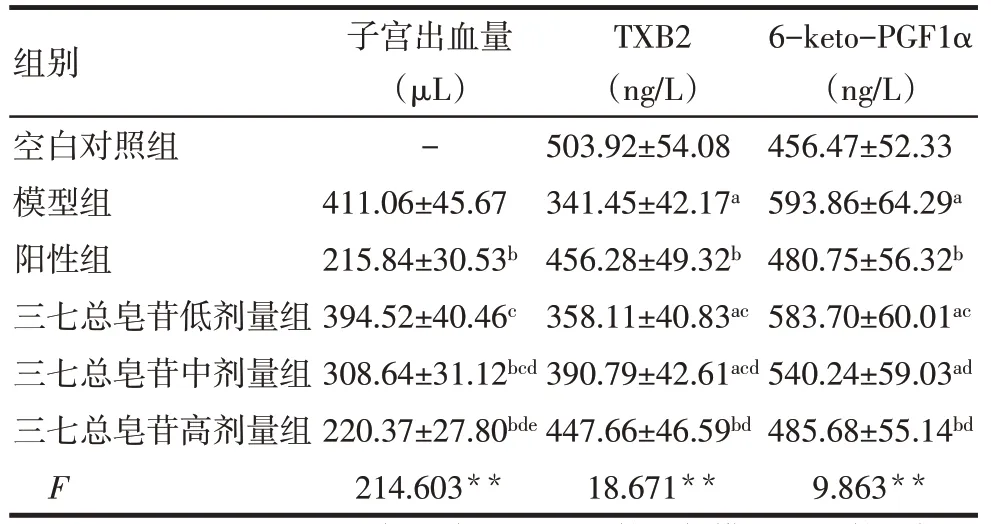
Tab.2 Comparison of uterine bleeding and coagulation function of rats between the six groups表2 各组大鼠子宫出血量及凝血功能比较(n=10,)
*P<0.05,**P<0.01;a与空白对照组比较,b与模型组比较,c与阳性组比较,d与三七总皂苷低剂量组比较,e与三七总皂苷中剂量组比较,P<0.05。
组别空白对照组模型组阳性组三七总皂苷低剂量组三七总皂苷中剂量组三七总皂苷高剂量组F子宫出血量(µL)-411.06±45.67 215.84±30.53b 394.52±40.46c 308.64±31.12bcd 220.37±27.80bde 214.603**TXB2(ng/L)503.92±54.08 341.45±42.17a 456.28±49.32b 358.11±40.83ac 390.79±42.61acd 447.66±46.59bd 18.671**6-keto-PGF1α(ng/L)456.47±52.33 593.86±64.29a 480.75±56.32b 583.70±60.01ac 540.24±59.03ad 485.68±55.14bd 9.863**
2.2 各组大鼠血浆炎性因子和雌激素水平比较 与空白对照组比较,模型组大鼠血浆TNF-α、IL-6 水平增加,E2、P 水平降低(P<0.05);与模型组比较,阳性组和三七总皂苷中、高剂量组大鼠血浆TNF-α、IL-6水平降低,E2水平升高(P<0.05);与阳性组比较,三七总皂苷高剂量组大鼠上述指标差异无统计学意义(P>0.05),而三七总皂苷中、低剂量组TNF-α、IL-6 水平升高,E2水平降低(P<0.05),见表3。
Tab.3 Comparison of serum inflammatory factors and estrogen levels of rats between the six groups表3 各组大鼠血清炎性因子和雌激素水平比较 (n=10,µg/L,)
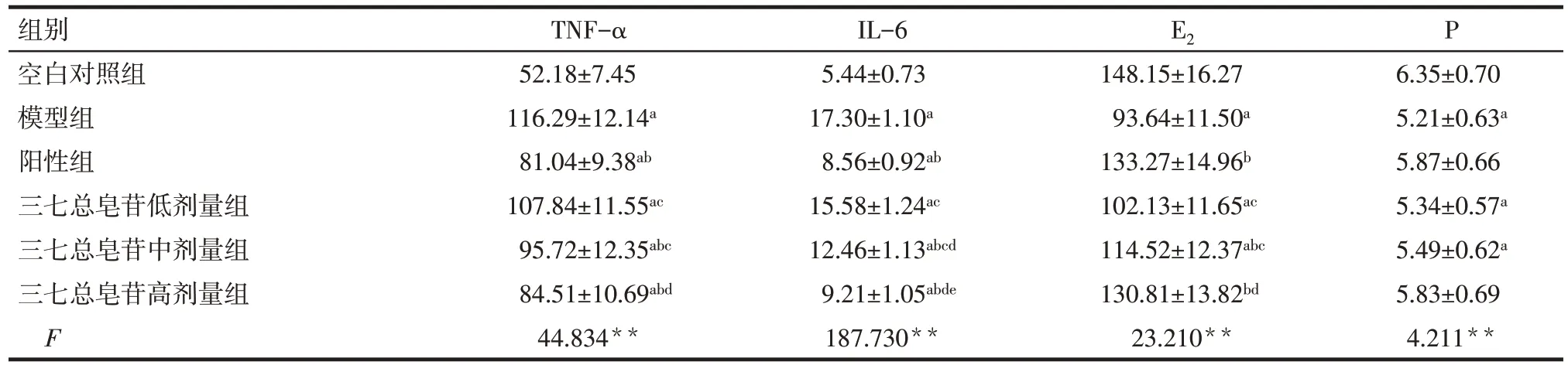
Tab.3 Comparison of serum inflammatory factors and estrogen levels of rats between the six groups表3 各组大鼠血清炎性因子和雌激素水平比较 (n=10,µg/L,)
*P<0.05,**P<0.01;a与空白对照组比较,b与模型组比较,c与阳性组比较,d与三七总皂苷低剂量组比较,e与三七总皂苷中剂量组比较,P<0.05。
组别空白对照组模型组阳性组三七总皂苷低剂量组三七总皂苷中剂量组三七总皂苷高剂量组F TNF-α 52.18±7.45 116.29±12.14a 81.04±9.38ab 107.84±11.55ac 95.72±12.35abc 84.51±10.69abd 44.834**IL-6 5.44±0.73 17.30±1.10a 8.56±0.92ab 15.58±1.24ac 12.46±1.13abcd 9.21±1.05abde 187.730**E2P 148.15±16.27 93.64±11.50a 133.27±14.96b 102.13±11.65ac 114.52±12.37abc 130.81±13.82bd 23.210**6.35±0.70 5.21±0.63a 5.87±0.66 5.34±0.57a 5.49±0.62a 5.83±0.69 4.211**
2.3 各组大鼠子宫内膜病理损伤情况比较
2.3.1 HE 染色结果 空白对照组大鼠子宫内膜细胞结构完整,排列整齐;模型组大鼠可见子宫内膜上绒毛和蜕膜残留较多,内皮细胞充血水肿,子宫内膜缺损。与空白对照组比较,模型组子宫内膜厚度、腺体数量降低(P<0.05);与模型组比较,阳性组和三七总皂苷中、高剂量组大鼠子宫内膜损伤减轻,子宫内膜厚度、腺体数量增加(P<0.05);与阳性组比较,三七总皂苷高剂量组大鼠子宫内膜厚度、腺体数量差异无统计学意义(P>0.05),而三七总皂苷中、低剂量组子宫内膜厚度、腺体数量均降低(P<0.05),见图1、表4。
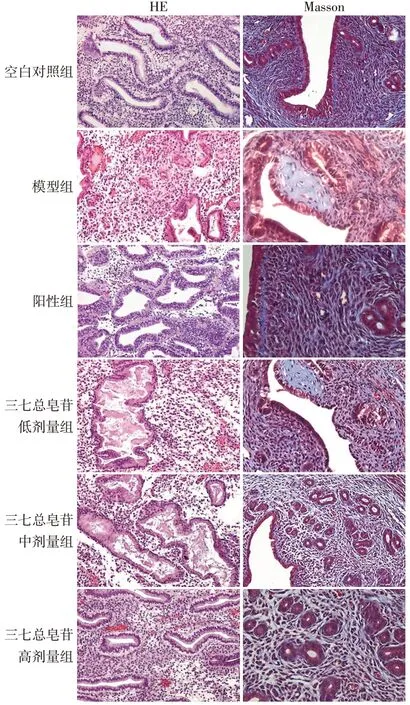
Fig.1 HE and Masson staining of endometrium of rats in each group(×200)图1 各组大鼠子宫内膜组织HE、Masson染色(×200)
2.3.2 Masson 染色结果 与空白对照组比较,模型组大鼠子宫组织的纤维化面积比增加(P<0.05);与模型组比较,阳性组和三七总皂苷中、高剂量组大鼠子宫组织的纤维化面积比减少(P<0.05);与阳性组比较,三七总皂苷高剂量组大鼠子宫组织的纤维化面积比差异无统计学意义(P>0.05),而三七总皂苷中、低剂量组纤维化面积比增加(P<0.05),见图1、表4。
Tab.4 Comparison of pathological damage of endometrium and MVD between the six groups表4 各组大鼠子宫内膜病理损伤和MVD比较(n=10,)

Tab.4 Comparison of pathological damage of endometrium and MVD between the six groups表4 各组大鼠子宫内膜病理损伤和MVD比较(n=10,)
*P<0.05,**P<0.01;a与空白对照组比较,b与模型组比较,c与阳性组比较,d与三七总皂苷低剂量组比较,e与三七总皂苷中剂量组比较,P<0.05;表5同。
组别空白对照组模型组阳性组三七总皂苷低剂量组三七总皂苷中剂量组三七总皂苷高剂量组F子宫内膜厚度(mm)354.82±41.63 186.51±32.94a 312.63±35.17b 201.43±28.69ac 254.78±30.85abcd 307.19±34.34abde 38.175**腺体数量[个/高倍镜视野(HP)]12.70±1.35 4.35±0.82a 10.10±1.13ab 6.65±0.94ac 7.23±0.85abc 9.75±1.06abde 81.235**组别空白对照组模型组阳性组三七总皂苷低剂量组三七总皂苷中剂量组三七总皂苷高剂量组F纤维化面积比(%)20.45±3.36 53.63±5.54a 32.07±4.20ab 48.96±5.12ac 41.25±4.63abcd 36.11±4.15abd 69.245**MVD(个/HP)27.35±2.81 8.41±1.76a 16.20±1.95ab 9.22±1.34ac 11.37±1.52abc 14.89±1.66abde 134.582**
2.4 各组大鼠子宫内膜MVD 比较 与空白对照组比较,模型组大鼠子宫内膜MVD减少(P<0.05);与模型组比较,阳性组和三七总皂苷中、高剂量组大鼠子宫内膜MVD增加(P<0.05);与阳性组比较,三七总皂苷高剂量组大鼠子宫内膜MVD 差异无统计学意义(P>0.05),而三七总皂苷中、低剂量组子宫内膜MVD减少(P<0.05),见表4、图2。
2.5 各组大鼠子宫组织VEGF、MMP-2和MMP-9mRNA 表达 与空白对照组比较,模型组大鼠子宫组织MMP-2和MMP-9mRNA 表达水平增加,VEGFmRNA 表达水平降低(P<0.05);与模型组比较,阳性组和三七总皂苷高剂量组大鼠子宫组织VEGFmRNA 表达增加,MMP-2和MMP-9mRNA 表达水平降低(P<0.05);与阳性组比较,三七总皂苷高剂量组大鼠子宫组织上述指标表达水平差异无统计学意义(P>0.05),而三七总皂苷低剂量组MMP-2和MMP-9mRNA 表达水平增加,VEGFmRNA 表达降低,三七总皂苷中剂量组VEGFmRNA 表达水平降低(P<0.05),见表5。
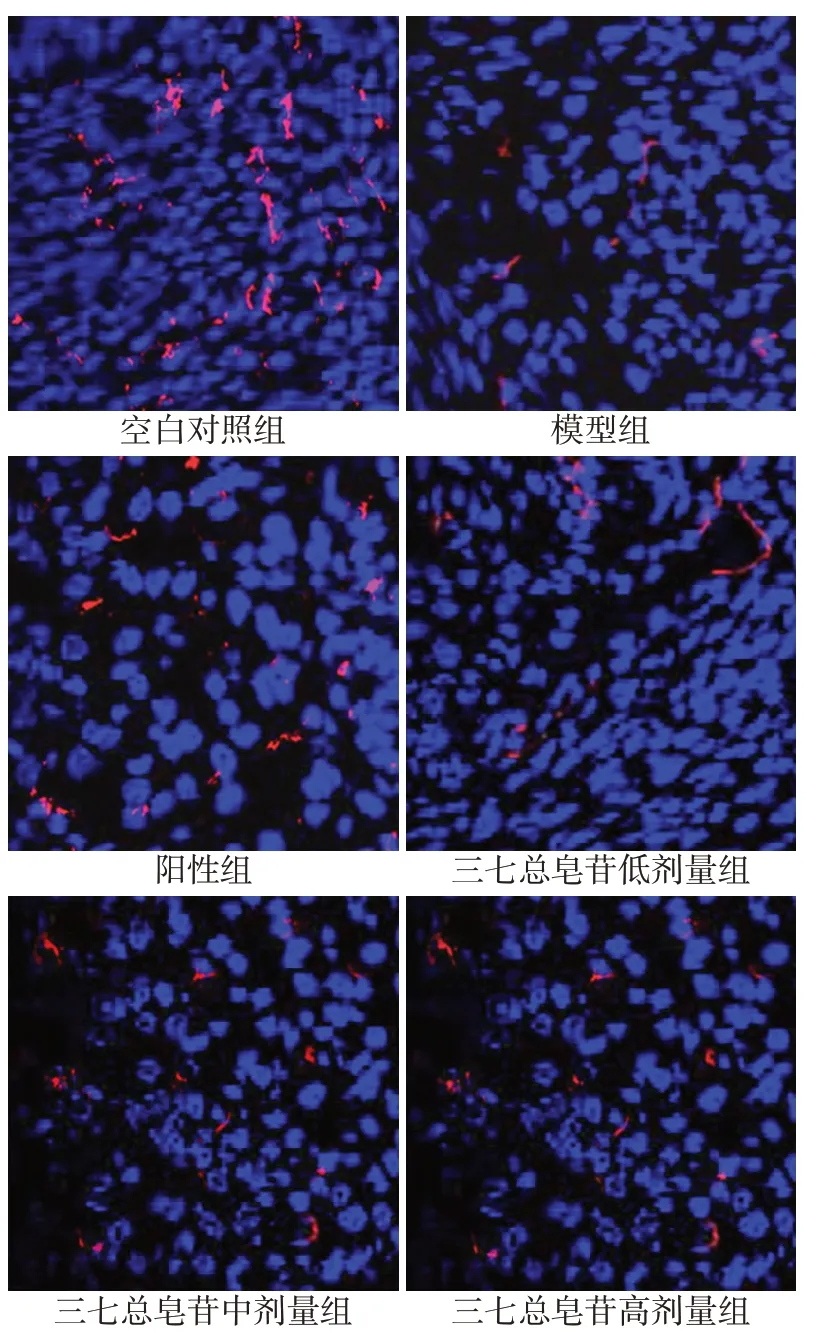
Fig.2 Immunofluorescence staining of CD31 in endometrium of rats in each group(×400)图2 各组大鼠子宫内膜CD31免疫荧光染色(×400)
Tab.5 Comparison of VEGF,MMP-2 and MMP-9 mRNA expression in uterine tissues of rats between the six groups表5 各组大鼠子宫组织中VEGF、MMP-2和MMP-9 mRNA表达比较 (n=10,)
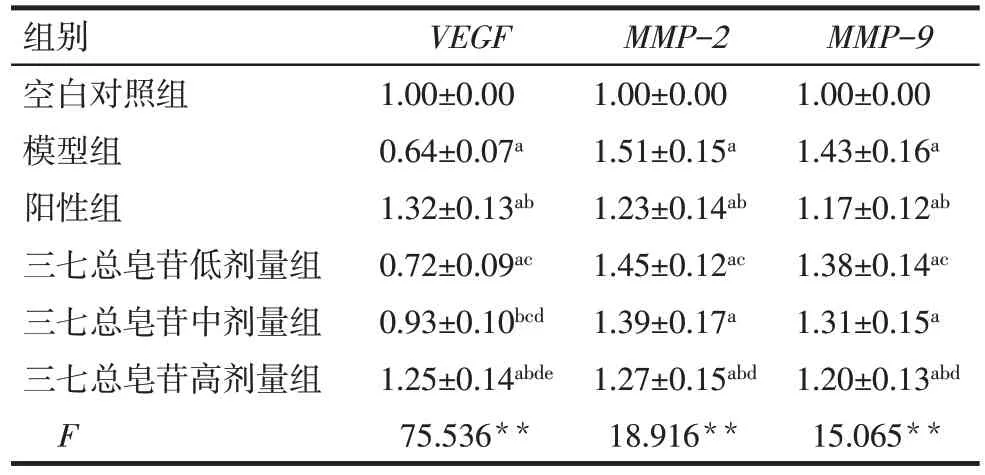
Tab.5 Comparison of VEGF,MMP-2 and MMP-9 mRNA expression in uterine tissues of rats between the six groups表5 各组大鼠子宫组织中VEGF、MMP-2和MMP-9 mRNA表达比较 (n=10,)
组别空白对照组模型组阳性组三七总皂苷低剂量组三七总皂苷中剂量组三七总皂苷高剂量组F VEGF 1.00±0.00 0.64±0.07a 1.32±0.13ab 0.72±0.09ac 0.93±0.10bcd 1.25±0.14abde 75.536**MMP-2 1.00±0.00 1.51±0.15a 1.23±0.14ab 1.45±0.12ac 1.39±0.17a 1.27±0.15abd 18.916**MMP-9 1.00±0.00 1.43±0.16a 1.17±0.12ab 1.38±0.14ac 1.31±0.15a 1.20±0.13abd 15.065**
3 讨论
AUB 的主要病理特征是有大量出血、子宫内膜损伤、子宫组织炎症及凝血缺陷。怀孕大鼠在给予米非司酮和米索前列醇灌胃后出现大量月经出血和残留坏死蜕膜,这与AUB 的症状一致。TXB2 和6-keto-PGF1α 是影响凝血功能的常见因素,TXB2 由TXA2 转化而来,影响血小板聚集和血管收缩;6-keto-PGF1α 通过抑制血小板聚集而发挥抗凝作用[11]。药物引起的不完全流产后机体激素水平降低可触发炎症细胞流入子宫内膜,导致蜕膜和绒毛的降解和坏死。TNF-α 和IL-6 是与炎症相关的常见细胞因子,TNF-α的过度表达与着床、胎盘和妊娠相关的炎症机制有关,对妊娠有不利影响,可导致流产;过度表达的IL-6也对妊娠产生负面影响[12]。本研究结果显示,与空白对照组比较,模型组子宫出血量、6-keto-PGF1α、TNF-α、IL-6 水平均增加,而TXB2、E2、P 降低;病理染色可见模型组子宫内膜上绒毛和蜕膜残留较多,内皮细胞充血水肿,子宫内膜缺损,表明模型大鼠子宫发生炎症和凝血功能障碍,子宫内膜损伤,AUB模型构建成功。
三七总皂苷是一种含有多种不同皂苷的混合物,具有显著的抗炎和雌激素样生物活性。研究显示,三七总皂苷可降低血清TNF-α、IL-6 以及白细胞和中性粒细胞计数,减轻油酸脂多糖所致的大鼠急性肺损伤[13];可改善小鼠缺血再灌注后白细胞黏附和脑血管内皮屏障破坏[14];还可抑制TNF-α诱导的骨关节炎软骨细胞衰老和凋亡[15]。因此,三七总皂苷可以用作抗炎剂。Fan 等[16]发现,三七总皂苷可预防雌激素缺乏引起的骨质流失。本研究结果显示,模型大鼠在给予高剂量三七总皂苷干预后,子宫出血量、6-keto-PGF1α 和炎性因子水平降低,TXB2、E2升高,子宫内膜损伤减轻,提示高剂量三七总皂苷可治疗流产大鼠子宫出血,其治疗作用可能与抑制子宫内膜炎症、促进雌孕激素水平和凝血功能恢复有关。
合适厚度的子宫内膜能够为胚胎植入提供优良的场所,是确保妊娠成功的关键,但是人工流产极易损伤子宫内膜,使其厚度过薄,内膜腺体及间质出现萎缩,同时纤维组织明显地增生,内膜逐渐瘢痕化,影响子宫内膜容受性,进而导致胚胎着床失败。子宫内膜的厚度、腺体数量及纤维化程度是衡量子宫内膜损伤是否得到修复的重要指标。MMP 可通过基底膜破坏子宫内膜间连接,影响子宫内膜的重建和修复。三七总皂苷能降低MMP-9水平,改善心肌梗死大鼠的心功能和纤维化[17]。本研究结果显示,高剂量的三七总皂苷能增加模型大鼠的子宫内膜厚度和腺体数量,降低纤维化面积比及MMP-2和MMP-9mRNA表达水平,减轻子宫纤维化程度,表明高剂量三七总皂苷可促进子宫内膜损伤后的修复。
组织的再生修复依赖于血管的生成及血流灌注情况,因此血管生成情况也是子宫内膜修复评价指标。MVD是衡量微血管新生的定量指标,即子宫内膜组织中MVD 值越高,新生毛细血管越丰富;且与血管生成密切相关的VEGF被认为是子宫内膜修复的关键因素[18]。三七总皂苷也是潜在的血管生成剂,其可通过促进骨质疏松模型小鼠的血管生成来预防骨质流失[19],并增加VEGF表达,促进内皮祖细胞血管生成[20]。本研究结果显示,模型大鼠子宫MVD和VEGF较正常大鼠降低,而高剂量的三七总皂苷干预后子宫MVD和VEGFmRNA水平增加,新生血管增多,提示高剂量三七总皂苷可促进血管生成。
综上所述,高剂量三七总皂苷可治疗流产大鼠子宫出血,其作用机制可能是抑制过度纤维化和炎症,上调VEGF 表达,促进血管重塑,进而促进子宫内膜修复,但其通过何种途径减轻子宫组织炎症反应和纤维化程度,仍有待进一步研究。此外,已知三七总皂苷是一种活性化合物的混合物,明确这些化合物中促进子宫血管生成的皂苷,以及这些皂苷是否具有协同作用以驱动血管生成活性,也是今后研究的重点。

