水热法制备TiO2纳米晶及其光催化性能研究
杜意恩,帖鑫龙,马文香,郭彦青
(1.晋中学院 化学化工系,山西 晋中 030619;2.河北省魏县第一中学,河北 邯郸 056800)
二氧化钛(TiO2)自1972年由Fujishima等发现可用于光催化分解水制氢以来,一直受到研究者的广泛关注[1]。TiO2因具有高催化活性、良好的化学稳定性、对环境友好及价格低廉等优点而被应用于光催化降解有机污染物、光催化还原CO2制CH4、裂解水制氢和太阳能电池、超级电容器、生物医学设备、锂离子电池的制造等领域[2-4]。在自然界中,TiO2晶体主要有锐钛矿型(四方晶系、I41/amd空间群)、金红石型(四方晶系、P42/mnm空间群)和板钛矿型(斜方晶系、Pbca空间群)三种类型,其中,锐钛矿型TiO2具有出色的光催化性能,被广泛应用于光催化领域[5-6]。
制备TiO2的方法主要有液相合成法(包括水热合成、溶解热合成和溶胶—凝胶合成等)和固相合成法(包括固态混合法和直接焙烧法等)。其中,液相合成法是根据溶解—重结晶的原理进行的。如闫慧等以Ti(SO4))2为钛源,以正丙醇为溶剂,以聚乙烯吡咯酮(PVP)为分散剂,采用液相合成法制备了球型锐钛矿型TiO2[7]。固体合成法是在研钵中加入合适的反应原料和少量无水乙醇,然后通过混匀、研磨、干燥和高温焙烧等处理过程得到所需产品。如章金兵等以TiOSO4∙2H2O和Na2C2O4为原料,利用固相合成法生制备了锐钛矿型TiO2纳米晶[8]。
本研究以层状钛酸盐K2Ti4O9/K2Ti6O13/K4TiO4为钛源,通过质子交换、插层和剥离等一系列反应制备不同结构和形貌的TiO2纳米晶,并将其应用于光催化降解罗丹明B溶液,为解决水体中的有机污染物提供了技术支持。
1 材料与方法
1.1 试剂和仪器
试剂:钛酸钾复合物(K2Ti4O9/K2Ti6O13/K4TiO4),上海麦克林生化有限公司;盐酸,天津市永大化学试剂有限公司;四甲基氢氧化铵,上海笛柏生物科技有限公司;氟化铵,天津市博迪化工有限公司;过氧化氢,天津市博迪化工有限公司;氨水,天津市凯通化工试剂有限公司;罗丹明B,卡迈舒(上海)生物科技有限公司。以上试剂均为分析纯。
仪器:HGZF-Ⅱ/H-101-1型电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;KH-101S型集热式恒温加热磁力搅拌器,邦西仪器科技有限公司;KSL-1400X 型高温箱式烧结炉,合肥科晶材料技术有限公司;FB224型电子分析天平,上海舜宇科学仪器有限公司;SHZ-D(Ⅲ)型循环水式多用真空泵,巩义市科瑞仪器有限公司;SB-3200DTDN型超声波清洗仪,宁波新艺生物科技股份有限公司;TU-1901型紫外-可见分光光度计,北京普析通用仪器有限公司;XRD-6100型X射线衍射分析仪,日本岛津株式会社;REGULUS8100型扫描电子显微镜,日本日立高新技术株式会社,加速电压5.0 kV,工作电流10µA;A-250型低压汞灯,上海铭耀玻璃五金厂。
1.2 实验方法
1.2.1 TiO2纳米晶的制备
称取20.023 4 g K2Ti4O9/K2Ti6O13/K4TiO4样品加入到盛有2 000 mL 1.5 mol/L 稀盐酸的烧杯中,磁力搅拌48 h 进行质子交换(重复操作3 次)以制备出质子交换后的产物H2Ti4O9/H2Ti6O13/H4TiO4,自然晾干后进行XRD 表征。称取13.020 8 g 96%的四甲基氢氧化铵于烧杯中,向其中加入87 mL 蒸馏水配制成质量分数为12.5%的四甲基氢氧化铵溶液,将其平均装入N2、N4两个釜芯中,再向其中各加入5.040 4 g H2Ti4O9/H2Ti6O13/H4TiO4,密封后放入均相反应器于100 ℃加热24 h。冷却后,将N2、N4反应釜中的溶液转移到2 000 mL烧杯中,再向其中加入900 mL蒸馏水,搅拌72 h后得到含H2Ti4O9/H2Ti6O13/H4TiO4纳米片的胶态悬浮液。
分别取上述胶态悬浮液200 mL,各加5.025 7 g NH4F、15 mL HCl、15 mLH2O2和15 mL NH3·H2O,搅拌均匀后分别转移到反应釜中;将反应釜放入恒温鼓风干燥箱于180 ℃加热24 h,冷却后抽滤、干燥、研磨,得到的产品分别标记为NH4F-TiO2、HCl-TiO2、H2O2-TiO2和NH3·H2O-TiO2,然后进行XRD分析。
1.2.2 光催化性能测试
用电子分析天平称取0.010 3 g 罗丹明B,用去离子水定容到1 000 mL 容量瓶中,配置成2×10-5mol/L 的罗丹明B储备液,依次按表1稀释,将稀释后的溶液置于5 mL的塑料离心管中,使用TU-1901型分光光度计在350~650 nm 范围内测定其吸光度(最佳吸收波长为554 nm),根据测定结果绘制吸光度(A)相对于浓度(C)的标准曲线。

表1 罗丹明B标准溶液的配制Table 1 Preparation of rhodamine B standard solution
分别称取0.075 0 g NH3·H2O-TiO2、H2O2-TiO2、HCl-TiO2、NH4F-TiO2和工业-TiO2于5 个不同的烧杯中,各加入150 mL罗丹明B溶液,避光搅拌30 min,然后静置2 h,以使其达到吸附平衡。在光照前,吸取3 mL上层清液装入玻璃离心管中作为溶液降解前的浓度。将其余液体置于紫外灯(光源为175 W,发光主波长为365 nm)下继续搅拌进行光催化实验,降解过程中每隔15 min用胶头滴管取3 mL悬浮液放入玻璃离心管中,再将玻璃离心管置于低速离心机离心5 min,通过TU-1901 型分光光度计测定溶液在最大吸收波长为554 nm处的吸光度,并求得降解率。

2 结果与讨论
2.1 样品的XRD结构表征
图1为原料钛酸钾K2Ti4O9/K2Ti6O13/K4TiO4复合物和质子交换后的钛酸H2Ti4O9/H2Ti6O13/H4TiO4的XRD衍射图,从图中可以看到两个样品都有很强的衍射峰,表明K4TiO4和H4TiO4的结晶性很好。
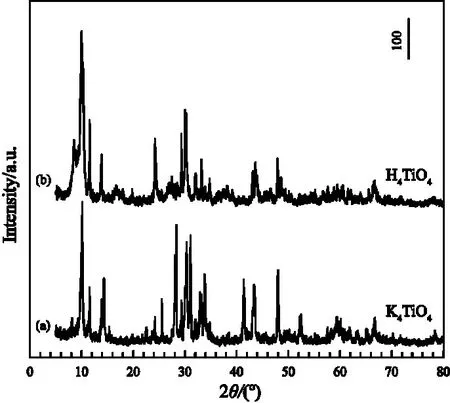
图1 K2Ti4O9/K2Ti6O13/K4TiO4(a)和H2Ti4O9/H2Ti6O13/H4TiO4(b)的XRD衍射图谱Figure 1 XRD patterns of K2Ti4O9/K2Ti6O13/K4TiO4(a)and H2Ti4O9/H2Ti6O13/H4TiO4(b)
图2是所制备的TiO2的XRD 衍射图谱,从图中可以看出所制备的TiO2晶体结构不同。对于NH4F-TiO2样品,在2θ为25.26°(101)、37.98°(004)、53.96°(105)、54.04°(211)、62.68°(204)、68.98°(116)、69.06°(220)、74.92°(215)处出现的衍射峰对应于锐钛矿型TiO2,在25.70°(110)处的衍射峰对应于金红石型TiO2,其中锐钛矿型TiO2是主相,金红石型TiO2是次主相,如曲线a所示。对于HCl-TiO2样品,从曲线b中可以看出,在2θ为25.38°(120)、30.88°(121)和48.08°(231)处的衍射峰对应于板钛矿型TiO2,在2θ为25.50°(110)、36.16°(101)、39.30°(200)、41.26°(111)、45.60°(210)、54.36°(211)、56.70°(200)、61.58°(002)、62.80°(310)、67.16°(301)和69.00°(112)处的衍射峰对应于金红石型TiO2,其中金红石型TiO2是主相,板钛矿型TiO2是次主相。对于NH3·H2O-TiO2样品,如曲线c所示,在2θ为25.44°(101)、37.94°(004)、48.14°(200)、55.12°(211)、62.10°(204)、68.80°(116)、70.38°(220)、75.14°(215)处的衍射峰对应于锐钛矿型TiO2,而在2θ为44.58°、64.90°和77.94°处的衍射峰对应于未反应的层状钛酸相,其中锐钛矿型TiO2是主相。对于H2O2-TiO2样品,在2θ为11.66°、13.96°、29.38°、32.08°、44.54°、57.68°和64.88°处的衍射峰对应于未反应的层状钛酸相,在2θ为25.42°(101)、37.98°(004)、48.10°(200)、54.00°(105)、55.14°(211)、62.82°(204)、68.98°(116)、70.34°(220)和75.16°(215)处的衍射峰对应于锐钛矿型TiO2,其中锐钛矿型TiO2是主相。与NH3·H2O-TiO2样品相比,H2O2-TiO2样品中锐钛矿型TiO2的结晶度高,表明其颗粒尺寸较大。从上述分析可知,不同的形貌控制剂存在条件对所合成的样品结构有较大的影响。NH4F是弱酸弱碱盐,其水解后使溶液显弱酸性,而酸性条件有利于金红石型TiO2的生成,导致所合成的NH4F-TiO2样品中含有极少量的金红石型TiO2。HCl 属于强酸,使H2Ti4O9/H2Ti6O13/H4TiO4纳米片的胶态悬浮液呈现酸性,因此得到的NH3·H2O-TiO2样品中含有大量的金红石型TiO2。H2O2和NH3·H2O 能够抑制H2Ti4O9/H2Ti6O13/H4TiO4纳米片发生脱水反应,导致在生成的H2O2-TiO2和NH3·H2O-TiO2样品含有未反应的层状相,需进一步提高反应温度或延长反应时间才能制备出纯的锐钛矿型TiO2。
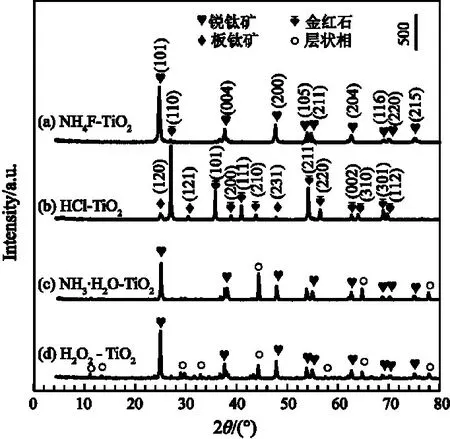
图2 在不同条件下制备的TiO2的XRD衍射图谱Figure 2 XRD patterns of TiO2 prepared under different conditions
2.2 样品的SEM表征
图3 是原料钛酸钾K2Ti4O9/K2Ti6O13/K4TiO4复合物和质子交换后的钛酸H2Ti4O9/H2Ti6O13/H4TiO4复合物以及所制备的NH4F-TiO2、HCl-TiO2、NH3·H2O-TiO2和H2O2-TiO2的SEM 图。图4 是利用复旦大学的粒度分析(Nano Measurer)软件分别测量NH4F-TiO2、HCl-TiO2、NH3·H2O-TiO2和H2O2-TiO2样品SEM 图中100 个左右粒子所得到的粒径分布图。从图3(a)和图3(b)中可以看出,原料K2Ti4O9/K2Ti6O13/K4TiO4为长0.36~4.62µm、宽0.09~0.75µm的棒状形貌,质子交换后H4TiO4为长0.34~4.20µm、宽0.10~0.48µm的棒状形貌,表明质子交换后颗粒的形貌没有明显变化。图3(c)~图3(f)为在不同条件下制备的TiO2的SEM图,从图3(c)中可以看出,当以NH4F为形貌控制剂时,所制备的NH4F-TiO2样品中锐钛矿型TiO2(金红石型TiO2太少,未观察到)主要为立方体状和不规则形貌,粒径为23~79 nm,平均粒径为44 nm,粒径大小主要集中在31~55 nm,其粒径分布如图4(a)所示。当以HCl为形貌控制剂时,所制备HCl-TiO2样品中金红石型TiO2主要为棒状,粒径长192~480 nm,宽31~86 nm,除此之外,在棒状颗粒的表面还附着许多粒径为22~68 nm 的板钛矿型TiO2纳米颗粒,如图3(d)所示,其对应的粒径分布如图4(b)所示。当以NH3·H2O和H2O2为形貌控制剂时,所制备的NH3·H2O-TiO2和H2O2-TiO2样品中锐钛矿型TiO2主要为梭形(长25~120 nm),少数为不规则形貌(长约200 nm),其粒径分布分别如图4(c)和图4(d)所示。由于产物中所含的层状相较少,在NH3·H2OTiO2和H2O2-TiO2样品中未观察到层状相。

图3 K2Ti4O9/K2Ti6O13/K4TiO4(a)、H2Ti4O9/H2Ti6O13/H4TiO4(b)和在不同条件下制备的TiO2的SEM图Figure 3 SEM images of K2Ti4O9/K2Ti6O13/K4TiO4(a),H2Ti4O9/H2Ti6O13/H4TiO4(b)and TiO2 prepared under different conditions

图4 在不同条件下制备的TiO2的粒径分布图Figure 4 Particle size distribution of TiO2 prepared under different conditions
2.3 TiO2样品的光催化性能研究
图5为不同浓度的罗丹明B标准溶液的吸光度,其拟合浓度–吸光度的关系符合朗伯–比尔定律[9]。由此得出其标准曲线线性方程为y=97 089x(y表示吸光度,x表示罗丹明B 溶液的浓度),线性相关系数R2=0.999 2。
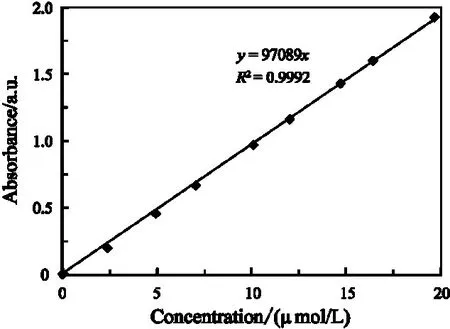
图5 罗丹明B溶液标准曲线Figure 5 Standard curve of Rhodamine B solution
图6显示了罗丹明B溶液在不同TiO2催化剂存在时吸光度随时间的变化曲线。从图6(a)~(e)可以看出,在不同催化剂存在下,罗丹明B溶液的吸光度都随着光照时间(时间间隔为15 min)的增加而逐渐降低,且位于最强处的吸收峰(波长为554 nm)逐渐向短波长方向移动,即吸收峰发生了蓝移现象[10]。从图6(f)中可以看出,在没有催化剂的情况下,罗丹明B溶液的吸光度随着照射时间的增加几乎没有发生变化,表明其降解率非常低,且位于波长为554 nm处的特征吸收峰未向短波长处移动。
从图7中可以看出,不同催化剂在同一光照时间内对罗丹明B溶液的降解率不同,刚开始持续增加,一段时间后达到平衡状态。在光照时间为90 min时,不同催化剂对罗丹明B溶液的降解效果由高到低依次为:NH4F-TiO2(78.5%)>H2O2-TiO2(77.3%)>工业-TiO2(65.0%)>NH3·H2O-TiO2(54.9%)>HCl-TiO2(22.2%)>空白样品(4.2%)。当NH4F-TiO2催化剂存在时,罗丹明B 溶液的褪色效果最好,其光催化活性分别是H2O2-TiO2、工业-TiO2、NH3·H2O-TiO2、HCl-TiO2和空白样品的1.02、1.21、1.43、3.54 和18.70 倍。众所周知,TiO2的光催化性能与其晶体结构、颗粒尺寸大小和比表面积有关。在所制备的四种样品中,NH4F-TiO2、H2O2-TiO2和NH3·H2O-TiO2的主要成分都是锐钛矿型TiO2,而HCl-TiO2的主要成分是金红石型TiO2;颗粒尺寸由小到大依次为NH4F-TiO2 图7 罗丹明溶液降解率随光照时间变化的曲线Figure 7 Curves of degradation rate of rhodamine solution with time of illumination 不同TiO2催化剂对罗丹明B 溶液的光催化降解是一个准一级反应,其反应动力学方程可以用ln(C0/Ct)=kt表示,其中,k为速率常数,C0和Ct分别表示罗丹明B溶液没有光照时的初始浓度和光照一段时间后的浓度。图8 是在紫外光照下不同催化剂降解罗丹明B 溶液的动力学曲线图及其对应的表观速率常数。从图8中可以看出,反应符合一级动力学模型,NH4F-TiO2的表观反应速率常数最高,为1.74×10–2/min,分别是H2O2-TiO2(1.61×10–2/min)、工业-TiO2(1.15×10–2/min)、NH3·H2O-TiO2(0.89×10–2/min)、HCl-TiO2(0.28×10–2/min)、空白样品(0.04×10–2/min)的1.08、1.51、1.96、6.21、43.5倍。上述分析结果表明,NH4F-TiO2的光催化性能明显高于工业-TiO2光催化剂和其他合成的TiO2催化剂。 图8 罗丹明B溶液降解的动力学曲线(a)和对应的表观速率常数(b)Figure 8 Kinetic curves of rhodamine B solution degradation (a)and the corresponding apparent rate constants (b) 以K2Ti4O9/K2Ti6O13/K4TiO4为钛源,通过质子交换、插层反应和剥离反应,得到纳米片胶态溶液,然后通过水热反应,制备不同TiO2纳米晶,并研究其对罗丹明B的降解效果。结果表明,对罗丹明B降解的效率按照大小依次为NH4F-TiO2>H2O2-TiO2>工业-TiO2>NH3·H2O-TiO2>HCl-TiO2>空白样品。NH4F-TiO2在光催化降解罗丹明B溶液中表现出最佳的光催化性能,归因于其主要成分是锐钛矿型TiO2,颗粒尺寸最小,且比表面积最大。该研究为制备具有优越催化性能的锐钛矿型TiO2纳米晶体提供了研究思路,有望应用于环境净化中。

3 结论

