IGF-1R通过调控JAK/STAT信号通路对脓毒症大鼠作用机制的研究
胡 伟,张 涛,盛尚春,刘 翔,丁贵梅,代 琼(宜宾市第二人民医院检验科,四川宜宾 644000)
脓毒症(sepsis)是因感染引起的全身性炎症反应综合征,创伤、感染等是其常见的并发症,全球每天约有14 000 人死于其并发症[1-2]。脓毒症救治困难、预后不良,高发病率、高死亡率,是危重症病房常见病[3]。目前临床上采用液体复苏、抗感染及器官支持等治疗,但患者的死亡率仍然很高,可见寻找一种新的治疗方法尤为重要。脓毒症的发病机制较为复杂,有研究发现细胞因子网络和脓毒症的发生发展有密切关系,其会激活机体中的炎性细胞和免疫活性细胞,促进细胞因子释放,在脓毒症发病时通过调控Janus 激酶/信号转导和转录激活因子(janus kinase/signal transducer and activvator of transcription,JAK/STAT)信号通路参与脓毒症的发生[4-5]。有研究发现,JAK/STAT 通路可调节多种细胞因子信号通路,且STAT1和STAT3 参与大部分炎症侵袭细胞内的信号转导过程,影响脓毒症的发生、发展[6]。有文献报道,抑制JAK/STAT信号通路可减轻脓毒症大鼠的重要脏器功能损伤[7]。1型胰岛素样生长因子受体(insulin-like growth factor 1 receptor,IGF-1R)是一种跨膜受体,可调节细胞的分化增殖、机体免疫等生物学活性[8]。胰岛素样生长因子-1/2(insulin-like growth factor -1/2,IGF-1/2)是IGF-1R的同源配体,当IGF-1R 被IGF-1/2或胰岛素激活时,自身会发生磷酸化,进而激活磷脂酰肌醇-3 激酶/蛋白激酶B(phosphatidylinositol-3 kinase/protein kinase B,PI3K/Akt)信号通路,调节细胞周期和凋亡[9]。但IGF-1R 对JAK/STAT信号通路的调控,及对脓毒症大鼠的作用机制尚不明确,因此本文通过探究IGF-1R的作用机制,为临床治疗脓毒症提供实验依据。
1 材料与方法
1.1 研究对象 60 只雄性大鼠均购自军事医学科学院实验动物中心。大鼠体质量220~250g,健康级,大鼠均饲养在统一的动物房内,室温20~24℃,相对湿度40%~50%,普通饲料喂养,自由饮食饮水,适应1 周新环境。本次实验经我院动物伦理审批同意。
1.2 试剂与仪器 IGF-1R,货号:HZ5445(ProsPec公司);兔抗大鼠IGF-1 单克隆抗体(北京沃凯生物科技有限公司);兔抗大鼠JAK1(批号:K0303)和STAT3(批号:C1303)单克隆抗体(广州翔博生物科技有限公司);TG20 台式离心机(上海安亭科学仪器厂);ts-100b 恒温摇床(江苏新春兰科学仪器有限公司)。
1.3 方法
1.3.1 脓毒症大鼠模型制备及分组:将60 只大鼠按照数字随机法随机分为三组,分别为假手术组(sham组)、脓毒症大鼠模型组(sepsis 组)和脓毒症大鼠模型给予IGF-1R 干预组(IGF-1R 组),每组20只。本文以盲肠结扎穿孔术为参照制备脓毒症大鼠模型。10g/dl 水合氯醛麻醉大鼠并固定,沿腹部中线切1.5 cm的小口,结扎盲肠,注意避免结扎回肠及盲肠系膜血管。分3 次穿刺盲肠,用留置的橡皮片贯穿盲肠,完成后将盲肠回归原来位置,逐层缝合皮肤。Sham 组大鼠仅开腹但不结扎盲肠。为防止大鼠休克立即皮下注射林格氏液10 ml,将大鼠放回笼内,给予充足的水分。
1.3.2 给药:造模成功后,IGF-1R 组经侧脑室定位注射药物,麻醉大鼠后固定头部。剔除头颅正中毛发并消毒,从右耳窝线中线开始向鼻侧做中切线,切1.5 cm的小口。分离各组大鼠皮下筋膜和骨膜,充分暴露前囟,在前囟向后0.8 mm、中缝靠右1.5 mm 处钻一小孔,以颅骨上缘为起点,在钻孔处将针垂直向下插入4.5 mm,同时向右侧脑室注射10 μl IGF-1R,保证药物流速为1 μl/min,注射完成20 min 后再缓慢拔出注射器,缝合消毒。Sham 组和sepsis 组大鼠均于同等位置注射10 μl的生理盐水干预,一天一次,连续注射7 天。
1.3.3 标本采集:消毒大鼠皮肤后开腹,完全分离腹主动脉,取腹主动脉血5 ml 至离心管中,12 000 r/min离心10 min,分离血清,-20℃保存待测。消毒皮肤后开腹,取出肺组织,置于消毒的冻存管中,放置-80 ℃环境中保存,待用。
1.3.4 免疫荧光染色检测大鼠肺组织中IGF-1R 阳性细胞比例:给药干预后麻醉各组大鼠,消毒开胸取肺组织,将组织用4g/dl 多聚甲醛固定,经脱水、石蜡包埋,切片机切成5 μm的薄片,自来水冲洗,用枸橼酸缓冲液修复组织2 min,待切片组织冷却后冲洗,用画圈笔画圈。过氧化氢将组织在黑暗的环境中封闭20 min,PBS 溶液洗涤3 次,室温封闭1 h。每张切片加入50 μl的IGF-1R 抗体,4 ℃孵育组织过夜,PBS 再次清洗5 次。避光环境中加入二抗,室温孵育6 h 后再次清洗3 次,避光环境下将DAPI 加入,避光孵育11 min,PBR 溶液清洗3次后,用甘油封片,荧光显微镜下观察并拍照。
1.3.5 ELISA 检测血清中IL-6和TNF-α 含量:分别取出三组大鼠的肺组织,将组织放置到均浆器中,同时把3 倍体积的磷酸缓冲液加入到均浆器中,制成组织均浆。离心机离心组织均浆,3 000 r/min 离心10 min,收集上清液,检测血清中IL-6和TNF-α 含量。
1.3.6 HE 染色检测肺组织病理形态变化:取各组大鼠左肺上叶组织,经梯度酒精脱水、石蜡包埋,用石蜡切片将组织切成厚度为6 μm的薄片,将组织进行常规的HE 染色后,每张切片随机取4 个清晰的视野于显微镜下观察。
1.3.7 TUNEL 检测细胞凋亡:肺组织与蛋白酶K室温孵育,切片浸入TUNEL 反应液中,后PBS 冲洗3 次。过氧化氢冲洗淬灭酶活性,后联合抗生物蛋白过氧化氢酶和二氨基联苯胺覆盖,凋亡细胞为棕黄色,随机选择5 个视野下的细胞观察凋亡率。
1.3.8 免疫印迹检测组织中p-JAK1和p-STAT3 蛋白表达:分别取三组大鼠50 mg 肺组织,用WB 裂解液裂解,研磨组织30 min,离心机离心,12 000r/min 离心5 min,收集上清液检测蛋白浓度,在每孔中加入50 μg的蛋白样品,根据蛋白浓度计算样本体积。把浓缩的SDS-PAGE 缓冲液加入到上清液中,加热上清液,5 min 后在预制的胶孔中把蛋白样本加入,在封闭的环境中孵育。1h 后加入一抗,TBST 溶液将蛋白样品清洗3 次,曝光成像后分析。
1.4 统计学分析 采用SPSS19.0 软件进行本实验的统计学分析,满足正太性分布及方差的计量资料以均数±标准差(±s)表示,多组间数据采用单因素方差分析;两组间数据用成组设计资料的t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织中IGF-1R 阳性细胞比例 组织中IGF-1R 阳性细胞在sham 组(58.32%±5.21%)、sepsis 组(21.65%±8.73%)和IGF-1R 组(46.58%±6.72%)占比比较,差异有统计学意义(F=141.7,P<0.000 1)。和sham 组相比,sepsis 组大鼠肺组织中IGF-1R 阳性细胞在总细胞中所占的比例减少(t=16.13,P<0.000 1);IGF-1R 组大鼠肺组织中IGF-1R 阳性细胞在总细胞中所占的比例较sepsis 组增加(t=10.12,P<0.000 1),差异均有统计学意义。
2.2 各组大鼠血清中IL-6和TNF-α 含量比较 见表1。 血清中IL-6 在sham 组、sepsis 组和IGF-1R 组的含量比较,差异有统计学意义(F=18.23,P<0.000 1);血清中TNF-α 在sham 组、sepsis组和IGF-1R 组的含量比较差异有统计学意义(F=130.7,P<0.000 1)。和sham 组相比,sepsis组血清中IL-6和TNF-α 含量增加;IGF-1R 组血清中IL-6和TNF-α 含量较sepsis 组减少,差异均有统计学义(P<0.000 1)。
表1 各组大鼠血清IL-6,TNF-α 含量(±s,pg/ml)

表1 各组大鼠血清IL-6,TNF-α 含量(±s,pg/ml)
项 目sham 组①sepsis 组②IGF-1R 组③① vs ②③ vs ②t P tP IL-64.35±2.019.81±4.265.11±2.575.18<0.000 14.23<0.000 1 TNF-α2.31±1.1214.15±3.266.58±2.1521.98<0.000 112.01<0.000 1
2.3 各组大鼠肺组织病理变化比较 见图1。Sham组大鼠肺组织正常,没有明显的病理改变;sepsis组肺组织有大量的炎性细胞浸润,肺泡间隔明显厚于sham 组,部分肺组织完整性受到破坏。和sepsis组大鼠相比,IGF-1R 组大鼠肺组织得到了明显的改善。
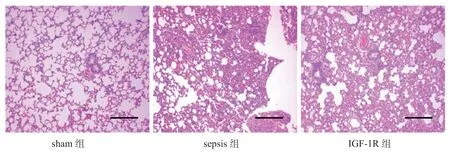
图1 各组大鼠肺组织病理变化(HE 染色,×100)
2.4 各组大鼠肺组织细胞凋亡率比较 见图2。细胞凋亡率在sham 组(6.35%±2.51%)、sepsis 组(37.84%±6.62%)和IGF-1R 组(22.71%±4.28%)间比较差异有统计学意义(F=217.4,P<0.000 1)。和sham 组相比,sepsis 组细胞凋亡率增加(t=19.89,P<0.000 1);和sepsisi 组相比,IGF-1R 组大鼠细胞凋亡率降低(t=8.583,P<0.000 1),差异均有统计学意义。

图2 各组大鼠肺组织细胞凋亡情况(TUNEL 染色,×100)
2.5 各组大鼠肺组织中p-JAK1和p-STAT3 蛋白表达比较 肺组织中p-JAK1 在sham 组(0.15±0.11)、sepsis 组(0.33±0.16)和IGF-1R 组(0.17±0.13)中表达差异有统计学意义(F=10.70,P=0.000 1)。肺组织中p-STAT3 在sham 组(0.12±0.10)、sepsis组(0.28±0.15)和IGF-1R 组(0.19±0.12)中表达差异有统计学意义(F=8.230,P=0.000 7)。和sham 组相比,sepsis 组肺组织中p-JAK1和p-STAT3蛋白表达增加(t=4.146,3.969,P=0.000 2,0.000 3);IGF-1R 组大鼠肺组织中p-JAK1和p-STAT3 蛋白低于sepsis 组(t=3.471,2.095,P=0.001 3,0.042 9)。
3 讨论
脓毒症的高发病率、高死亡率严重威胁患者的生命健康[10-11]。脓毒症的病理性表现以急性炎症为主,包括TNFα,IL-1β和IL-6 等炎症介质过度释放[12]。虽然目前抗生素的完善一定程度提高了脓毒症患者的病死率,但对复杂的脓毒症发病机制认识尚不全面,持续炎症、免疫抑制等新问题也逐渐出现,因此降低脓毒症患者的病死率和发病率是目前临床亟待解决的问题。IGF-1 主要由肝脏分泌,其会通过内分泌、自分泌、旁分泌等不同的分泌方式和靶细胞表面的1 型胰岛素样因子受体(IGF-1R)相结合,进而调节外周组织、细胞的生理和病理变化。有研究发现IGF-1R 能调节脓毒症患者机体内的炎症反应,但其具体的作用机制尚不明确,因此本研究对脓毒症大鼠给予IGF-1R 干预治疗,研究其对脓毒症的作用机制[13]。
脓毒症早期会释放大量的炎症因子且浸润到细胞中,减少中性粒细胞的凋亡,损伤毛细血管及血管功能障碍,进而导致肺间质严重水肿、蛋白出现渗漏等多种不同机制的发生,和脓毒症致急性肺损伤有密切关系[14]。有研究显示,机体内的炎症反应失调是导致脓毒症所致肺损伤的主要发病机制,其中IL-6 是最主要的一种内源性炎症细胞因子,可启动机体内的炎症反应,还能对炎症反应进行催化和放大,有效判断炎症程度,进而影响机体的炎性反应。有学者通过对脓毒症患者体内炎症因子检测时发现IL-6和TNF-α 含量增加,抑制IGF-1的合成,降低机体血液中IGF-1水平,增加脓毒症发生时的细菌移位,最终加重脓毒症患者病情[15]。本研究结果显示脓毒症大鼠血清中IL-6和TNF-α 含量升高,IGF-1 阳性表达降低,细胞出现大量的凋亡;IGF-1R 干预后脓毒症大鼠血清中的炎症因子减少,且细胞凋亡率也降低,提示IGF-1R 对脓毒症所致肺损伤有一定治疗作用。TIAN 等[16]研究证实,在脓毒症患儿中IGF-1表达降低,并在病程中保持稳定,但血糖变化和IGF-1 没有明显的联系。
有研究发现JAK/STAT信号通路是炎症反应中最显著的细胞内信号网络之一[17]。白介素、干扰素、肿瘤坏死因子招募JAK 蛋白结合于受体表位,使JAK 蛋白彼此靠近而相互磷酸化激活,激活的JAK进一步对STAT 蛋白磷酸化,致使其二聚化入核,识别特定的DNA 序列,调控靶基因的表达,介导B淋巴细胞转换和T 淋巴细胞增殖分化,并通过释放大量的炎症因子和趋化因子,使得巨噬细胞、中性粒细胞聚集,介导炎症反应[18-19]。JAK/STAT 通路参与炎症免疫反应的应答,对脓毒症所致急性肺损伤的机制中信号转导具有重要意义。
有研究证实,JAK/STAT信号通路可调节CLP诱导的脓毒症大鼠模型的急性肺损伤,同时抑制JAK 或STAT 可减轻严重脓毒症所致的急性肺损伤和致死性[20]。本研究结果显示,脓毒症大鼠组织中JAK/STAT信号被激活,促进了p-JAK1和p-STAT3表达;IGF-1R 干预后可抑制JAK/STAT信号,进而减轻脓毒症所致急性肺损伤,提示抑制JAK/STAT通路的激活可减轻脓毒症所致的急性肺损伤。XIE等[21]通过对大鼠实验研究证实,电针可抑制脓毒症最大数炎症介质的释放,抑制细胞凋亡,进而减轻脓毒症大鼠的肺损伤,其机制是通过调节JAK1/STAT3 通路来实现的。
综上所述,IGF-1R 可对JAK/STAT信号通路进行调节,降低血清中炎症因子的含量,进而改善脓毒症所致的急性肺损伤。但由于本研究选取的样本数量和动物有限,使本文存在一定的局限性。在今后的实验中,会加大样本的研究数量,且进行人体实验研究,以进一步验证IGF-1R 在脓毒症中的应用价值。

