胃癌并发Hp感染患者血清miR-101,HSP-70,IL-1β表达水平与肿瘤增殖和侵袭力的相关性研究
王 允,申重阳,韩建军,贾 利,高 飞,何 君,闵燕梅
(1.绵阳市第三人民医院/四川省精神卫生中心肿瘤内科,四川绵阳 621000;2.成都中医药大学基础医学院,成都 610041)
胃癌为全球发病率第四的恶性肿瘤,居恶性肿瘤病死原因第二位,胃癌晚期患者5年生存率仅20%~25%,预后差[1-2]。幽门螺杆菌(Helicobacter pylori,Hp)被认为是胃癌的最主要危险因素,研究报道,约69%胃癌患者伴Hp 感染,且Hp 感染可能会促进胃癌发病及进展,但具体机制尚未明确[3]。研究报道,Hp 感染可造成胃黏膜炎症与癌前病变,导致胃癌发生、进展[4]。白细胞介素-1β(interleukin-1β,IL-1β)可参与组织破坏及慢性炎症,属驱动癌症炎症细胞因子[5]。热休克蛋白-70(heat shock protein-70,HSP-70)可参与自身免疫性损伤及机体炎症过程,影响癌细胞浸润、黏附能力,促进恶性肿瘤发生、进展[6]。miRNA 于肿瘤中可发挥类似抑癌基因与致癌基因作用。本研究拟通过分析胃癌并发Hp感染患者血清miR-101,HSP-70和IL-1β表达水平与肿瘤增殖和侵袭力的相关性,初步探究Hp促进胃癌进展的机制,为胃癌诊疗提供一定参考。
1 材料与方法
1.1 研究对象 选取2017年2月~2020年2月绵阳市第三人民医院胃癌患者120 例为观察组(依据Hp 检测结果分为胃癌Hp 阳性组68 例、胃癌Hp 阴性组52 例),同期慢性胃炎患者86 例为对照组。纳入标准:①胃癌Hp 阳性组、胃癌Hp 阴性组均符合《中国早期胃癌筛查及内镜诊治共识意见》[7]中胃癌有关诊断标准,且经组织病理学检查证实,既往无免疫治疗与放化疗史;②对照组均符合《中国慢性胃炎诊治共识意见》[8]中慢性胃炎诊断标准,近两个月未采取系统治疗;③各组均未采取抗Hp 治疗,知晓本研究,签订知情同意书。排除标准:①并发严重肝肾疾病;②急性心肌梗死;③并发脑梗死、颅脑损伤等严重脑血管疾病;④并发精神系统疾病;⑤并发胃底食管静脉曲张、肠梗阻、肠穿孔;⑥并发其他部位恶性肿瘤;⑦近期曾应用激素、非甾体类抗生素治疗。其中胃癌Hp 阳性组男性36 例,女性32 例,年龄54~76岁,平均年龄62.72±7.09 岁;体质量指数(BMI)16~28 kg/m2,平均BMI 22.79±2.07kg/m2;TNM分期:Ⅰ~Ⅱ期42 例,Ⅲ~Ⅳ期26 例,并发症:糖尿病16 例,高脂血症19 例,高血压24 例。胃癌Hp 阴性组男性30 例,女性22 例,年龄53~79岁,平均年龄63.68±6.14 岁;BMI 17~28 kg/m2,平均BMI 23.05±2.46kg/m2;TNM分期:Ⅰ~Ⅱ期29 例,Ⅲ~Ⅳ期23 例,并发症:糖尿病10 例,高脂血症12 例,高血压16 例。对照组男性47 例,女性39 例,年龄51~78 岁,平均年龄61.75±7.36 岁;BMI 16~27 kg/m2,平均 BMI 22.42±2.18kg/m2;并发症:糖尿病18 例,高脂血症21 例,高血压27 例。各组年龄、性别、BMI,并发症等一般资料差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准。
1.2 仪器与试剂 Megafuge2.0R 高速离心机购于德国Heraeus 公司;MDF382 型超低温冰箱购于日本SANYO 公司;MK3 型酶标仪购于芬兰雷柏公司;7500 型实时荧光定量PCR 仪购于美国ABI 公司;GVE-2100 型电子胃镜购于上海涵飞医疗器械有限公司;HUBT-20P 型Hp 检测仪购于上海三崴医疗设备有限公司。酶联免疫吸附法试剂盒购于南京建成生物工程研究所。miR-101,肿瘤增殖、侵袭基因检测试剂盒购于北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 血清指标检测方法:入院后采集患者清晨空腹静脉血6 ml,以酶联免疫吸附法测定血清HSP-70,IL-1β水平;提取总RNA,鉴定RNA 纯度与质量浓度,以实时荧光定量PCR 法测定血清miR-101 相对表达量,结果以2-△△Ct表示,操作严格按仪器与试剂盒说明书执行。
1.3.2 Hp 感染测定方法:①胃镜检查:于胃镜下取胃黏膜组织,应用甲醛溶液(浓度10%)固定,石蜡包埋,做连续切片,采取Giemsa 法染色,1 000倍显微镜下进行观察,若切片组织染色为紫红色则判定为Hp 阳性。②碳14 尿素呼气试验:于空腹下进行试验,口服碳14 尿素胶囊,15 min 后,嘱患者向呼气卡呼气约3 min,而后将呼气卡插入至Hp检测仪,进行自动检测,记录Hp 感染U 值,若测定Hp 感染U 值≥100 dpm/mmol 则判定为阳性。结合胃镜检查与碳14 尿素呼气试验结果,若两项结果均为阳性则判断为Hp 感染[9]。
1.3.3 胃癌组织中肿瘤增殖、侵袭基因测定方法:手术切除胃癌患者病灶后,取适量胃癌组织,以液氮冻存30 min 后置于-80 ℃冰箱中储存;以RNA提取试剂盒将组织中总RNA分离,而后以cDNA第一链合成试剂盒反转录总RNA 为cDNA;采取cDNA 样本稀释(比例为1∶5),以实时荧光定量PCR 法测定胃癌组织中肿瘤增殖基因[磷脂酰肌醇-3 激酶催化亚基δ(phosphatidylinositol-3 kinase catalytic subunit δ,PIK3CD),C-myc癌基因(C-myc oncogene,C-myc),zeste 基因增强子同源物2(zeste gene enhancer homolog 2,EZH2)],侵袭基因[泛素样含PHD和环指域1(ubiquitin-like containing PHD and ring finger domain 1,UHRF1),Vav3 癌基因(Vav3 oncogene,Vav3)]的mRNA表达量。
1.3.4 随访至2021年2月探讨血清miR-101,HSP-70,IL-1β 对胃癌并发Hp感染患者生存率的影响。
1.4 统计学分析 采用SPSS21.0 软件进行统计分析,计数资料以率(%)描述,行χ2检验;计量资料以均数±标准差(±s)描述,多组间比较采取单因素方差分析,进一步两两组间比较行SNK-q检验,两组间比较行独立样本t检验;Hp 感染与胃癌患者血清各指标的关系采用Pearson 相关分析;胃癌并发Hp感染患者血清各指标与胃癌组织中肿瘤增殖、侵袭基因关系应用Spearman 相关性分析;绘制Kaplan-Merier 生存曲线,观察患者生存率。P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清miR-101,HSP-70,IL-1β水平,Hp 感染U 值比较 见表1。胃癌Hp 阳性组血清miR-101水平低于胃癌Hp 阴性组、对照组(t=11.707,22.969,均P<0.001),且胃癌Hp 阴性组低于对照组(t=12.786,P<0.001),HSP-70,IL-1β水平及Hp 感染U 值高于胃癌Hp 阴性组、对照组(t=7.877,18.176;6.445,11.817;40.674,58.298,均P<0.001),且胃癌Hp 阴性组高于对照组(t=8.158,4.863,9.984,均P<0.001),差异均有统计学意义(P<0.05)。
表1 各组血清miR-101,HSP-70,IL-1β水平,Hp 感染U 值比较(±s)

表1 各组血清miR-101,HSP-70,IL-1β水平,Hp 感染U 值比较(±s)
项目胃癌Hp 阳性组(n =68)胃癌Hp 阴性组(n =52)对照组(n =86)FP miR-1010.51±0.130.82±0.161.38±0.29317.051<0.001 HSP-70(pg/L)2.73±0.691.80±0.571.14±0.38160.533<0.001 IL-1β(ng/L)42.07±18.5423.61±10.3816.37±7.0979.650<0.001 Hp 感染U 值(dpm/mmol)246.59±31.2859.26±12.6841.35±8.392 297.784<0.001
2.2 Hp 感染与胃癌患者血清各指标水平关联性分析 Pearson 相关性分析显示,Hp 感染U 值与胃癌Hp 阳性组患者血清miR-101水平呈显著负相关(r=-0.629,P<0.05),与HSP-70,IL-1β水平呈显著正相关(r=0.574,0.539,均P<0.05);Hp 感染U值与胃癌Hp 阴性组患者血清miR-101,HSP-70,IL-1β水平无明显相关性(r=-0.237,0.198,0.174,均P>0.05)。
2.3 胃癌Hp 阳性组不同血清指标水平患者组织中肿瘤增殖、侵袭基因表达比较 见表2。以胃癌Hp 阳性患者血清miR-101,HSP-70,IL-1β 水平平均数为界限,分为miR-101,HSP-70,IL-1β高水平、低水平患者。miR-101 高水平患者组织中PIK3CD,C-myc,EZH2,UHRF1,Vav3 基因表达量均低于低水平患者,HSP-70,IL-1β 高水平患者组织中上述各基因表达量均高于低水平患者,差异均有统计学意义(均P<0.001)。
表2 胃癌Hp 阳性组不同血清指标水平患者组织中肿瘤增殖、侵袭基因表达比较(±s)
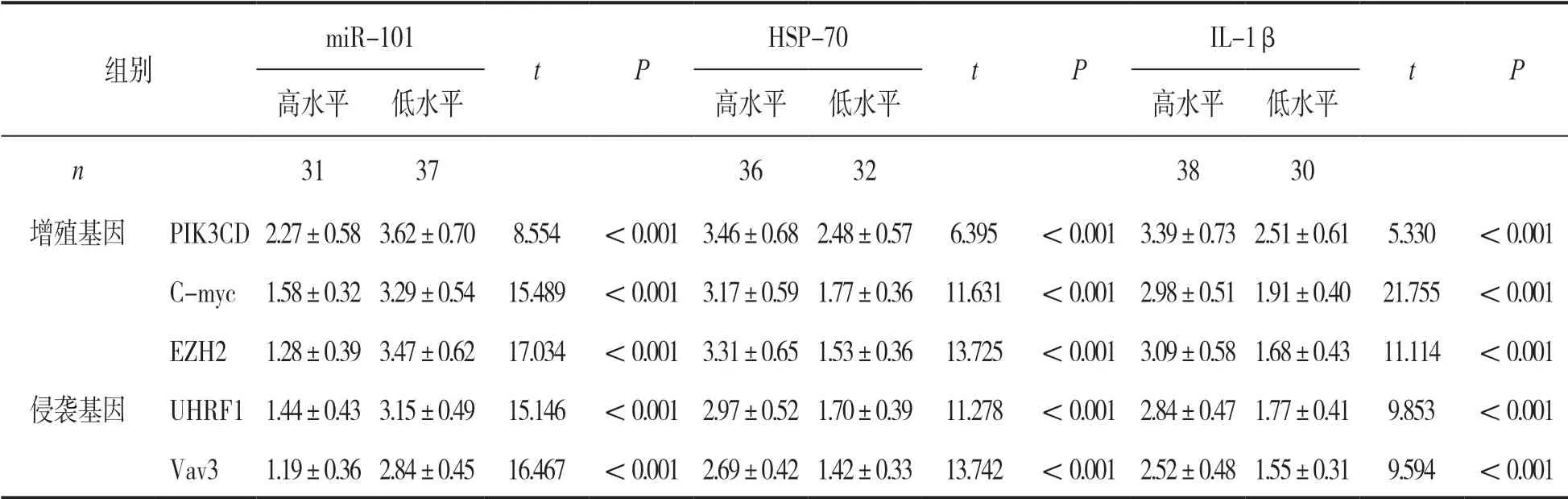
表2 胃癌Hp 阳性组不同血清指标水平患者组织中肿瘤增殖、侵袭基因表达比较(±s)
组别miR-101 tP HSP-70 tP IL-1β tP高水平低水平高水平低水平高水平低水平n 313736323830增殖基因PIK3CD 2.27±0.58 3.62±0.70 8.554<0.001 3.46±0.68 2.48±0.57 6.395<0.001 3.39±0.73 2.51±0.61 5.330<0.001 C-myc 1.58±0.32 3.29±0.54 15.489 <0.001 3.17±0.59 1.77±0.36 11.631 <0.001 2.98±0.51 1.91±0.40 21.755 <0.001 EZH2 1.28±0.39 3.47±0.62 17.034 <0.001 3.31±0.65 1.53±0.36 13.725 <0.001 3.09±0.58 1.68±0.43 11.114 <0.001侵袭基因UHRF1 1.44±0.43 3.15±0.49 15.146 <0.001 2.97±0.52 1.70±0.39 11.278 <0.001 2.84±0.47 1.77±0.41 9.853<0.001 Vav31.19±0.36 2.84±0.45 16.467 <0.001 2.69±0.42 1.42±0.33 13.742 <0.001 2.52±0.48 1.55±0.31 9.594<0.001
2.4 胃癌并发Hp感染患者血清各指标水平与组织中肿瘤增殖、侵袭基因表达关系 Spearman 相关分析可知,胃癌Hp 阳性患者血清miR-101水平与组织中PIK3CD,C-myc,EZH2,UHRF1,Vav3 基因表达量呈显著负相关(r=-0.664,-0.709,-0.714,-0.702,-0.687,均P<0.05),HSP-70,IL-1β水平与组织中PIK3CD,C-myc,EZH2,UHRF1,Vav3 基因表达量呈显著正相关(rHSP-70=0.629,0.693,0.702,0.685,0.659 ;rIL-1β=0.608,0.672,0.687,0.664,0.636,均P<0.05)。
2.5 血清各指标与胃癌并发Hp感染患者生存期的相关性 见图1~3。随访至2021年2月,68 例胃癌并发Hp感染患者中共有3 例失访。经Kaplan-Meier 生存分析显示,HSP-70,IL-1β 高水平患者生存率均低于HSP-70,IL-1β 低水平患者,差异有统计学意义(χ2=9.862,8.163,P=0.002,0.004),miR-101 高水平患者生存率高于低水平患者,差异有统计学意义(χ2=8.669,P=0.003)。
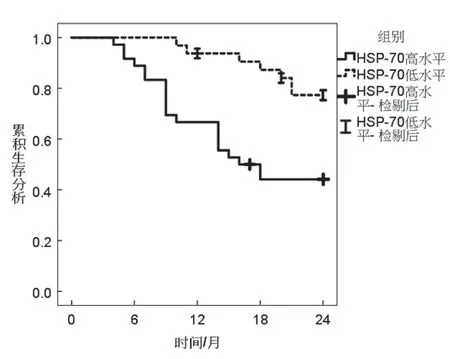
图1 不同miR-101水平胃癌患者生存曲线
3 讨论
Hp 为一种存活在胃内的微生物,Hp 感染可导致细胞壁缺陷,提升黏附能力,逃脱免疫监视,引起胃黏膜慢性损伤,造成炎症反应与免疫反应,在胃癌发生、进展中起着重要作用[10-11]。进一步探讨Hp 促进胃癌进展的具体机制对胃癌及时、合理诊疗,改善患者预后具有积极意义。

图2 不同HSP-70水平胃癌患者生存曲线
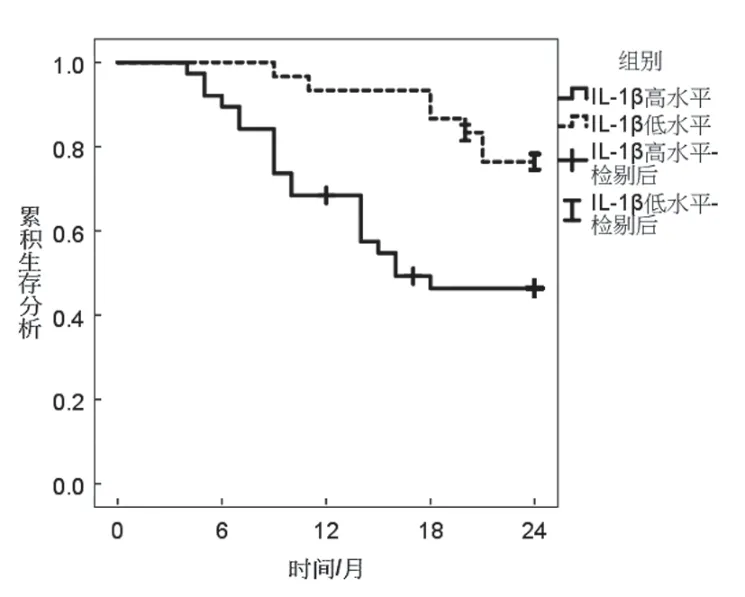
图3 不同IL-1β水平胃癌患者生存曲线
IL-1β 为白细胞介素-1 主要存在形式与传导途径,KIM 等[12]研究报道,IL-1β 可与Hp 感染一同参与胃癌致病过程,Hp 根除后胃癌患者血清IL-1β水平可持续降低。本研究显示,胃癌Hp 阳性组血清IL-1β水平较高,且其水平与Hp 感染U值呈正相关。表明血清IL-1β和Hp 感染于胃癌病程进展中具有协同作用机制,Hp 感染可能会促进血清IL-1β 异常表达,促进胃癌发生、进展。分析原因可能为,Hp 经由感染活性氧簇途径促使NOD 样受体热蛋白结构域相关蛋白3 炎症复合体激活,并促使Yes 相关蛋白-1 核易位,调节有关信号通路,促进IL-1β表达[13-14]。同时,IL-1β 高表达可刺激其他细胞因子与炎性因子分泌及释放,加快B 淋巴细胞增殖与分化,促进免疫球蛋白分泌,并可促使血小板生长因子、集落刺激因子形成与T 淋巴细胞激活,增强因细胞免疫引起的组织损伤,造成胃黏膜组织受损,促进胃癌发生、进展[15-16]。基于此,本研究生存分析显示,IL-1β 高水平胃癌Hp 阳性患者生存率较低。提示,IL-1β水平还与胃癌Hp阳性患者预后具有一定关系,通过测定其表达可为疾病诊治提供更多参考,利于增加患者临床获益。
HSP-70 为热休克蛋白家族中一员,付保芹等[17]研究报道,胃癌患者血清HSP-70表达可显著增高,且表达与Hp 感染有关。本研究发现,胃癌Hp 阳性组血清HSP-70水平较高,且其水平与Hp 感染U 值有关。提示血清HSP-70 可能与Hp 感染协同促进胃癌发生、进展。其原因可能为,Hp 感染可影响细胞毒素相关蛋白基因A表达,促使机体应激系统激活,进而影响血清HSP-70表达[18]。同时,相关研究报道,血清HSP-70表达增高可激活下游炎症反应,影响肿瘤微环境,引起肿瘤细胞生物学改变,增加癌细胞转移风险;且能参与B 淋巴细胞瘤-2 基因等癌基因凋亡调控工作;并可诱导Bcl-2相关的X 基因构象变化,阻止应激活化蛋白激酶诱导的Bcl-2 相关X 基因磷酸化,阻滞细胞凋亡;同时,HSP-70表达升高可影响癌细胞中多聚蛋白沉积速度,提升癌细胞膜内侧第二信使激活程度,进而促进肿瘤浸润深度、临床分期进展;此外,还可减弱胃黏膜上皮细胞基因错配修复能力,促进癌细胞上皮-间质转换,进而加速胃癌病情进展[19]。缪孟郡等[20]研究报道,有淋巴结转移、Ⅲ~Ⅳ期胃癌患者血清HSP-70水平高于无淋巴结转移、Ⅰ~Ⅱ期患者,与肿瘤淋巴结转移、临床分期有关。本研究绘制生存曲线发现,HSP-70 高水平胃癌Hp 阳性患者生存率较低。也说明HSP-70水平与胃癌Hp 阳性患者预后有关,可为预后评价提供一定参考信息。
miRNA 可靶向调控有关基因表达参与肿瘤细胞分化、增殖与侵袭过程,在恶性肿瘤病程进展中起到致癌或抑癌作用[21]。miR-101 为一种具有抑癌作用的miRNA,黄光墉等[22]研究报道,胃癌患者miR-101表达可显著降低。本研究中,胃癌Hp 阳性组血清miR-101水平明显降低,且相关性分析可知,其表达与Hp 感染U 值呈负相关,绘制生存曲线提示,miR-101 高水平患者生存率高于低水平患者。说明血清miR-101 可能与Hp 感染协同促进了胃癌病程进展,影响患者预后,测定该指标水平可为临床制定合理治疗方案提供一定依据。考虑原因为,Hp 感染可促进细胞空泡毒素、尿素酶等物质分泌,增强对胃黏膜组织的刺激,加剧炎症反应与免疫系统激活程度,进而致使血清miR-101水平降低。同时,临床研究发现,miR-101 可抑制肿瘤细胞上皮-间质转化,降低细胞间黏附蛋白表达,抑制肿瘤细胞扩散与转移,miR-101表达降低可导致机体对肿瘤细胞增殖与转移抑制作用减弱,促进胃癌发病、进展[23]。
此外,PIK3CD,C-myc,EZH2 为调控细胞增殖过程促增殖基因,高表达与癌细胞恶性增殖有关。UHRF1,Vav3 为调控细胞侵袭重要基因,高表达可促进癌细胞侵袭过程。本研究显示,胃癌伴Hp感染患者血清miR-101水平与组织中上述肿瘤增殖、侵袭基因表达量呈负相关,HSP-70,IL-1β水平与组织中上述肿瘤增殖、侵袭基因表达量呈正相关。也提示Hp 感染可诱导血清miR-101,HSP-70,IL-1β 异常表达,促进肿瘤增殖、侵袭。在临床中应注意检测Hp 性质与miR-101,HSP-70,IL-1β表达情况,为胃癌诊治提供更多参考,改善患者预后。
综上,胃癌患者并发Hp感染可促进血清miR-101,HSP-70,IL-1β异常表达,促使肿瘤增殖、侵袭,影响患者预后。但本研究为单中心研究,仍有待将来多中心研究进一步探究。

