发酵小米工艺优化及其体外抗氧化活性研究
葛迎港,赵博凯,王晓闻
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
0 引言
纳豆是一种源于中国的天然发酵食品,是大豆经过纳豆芽孢杆菌发酵而成的健康食品,许多研究表明,在发酵的纳豆中具有很多生理调节功能[1],如溶血栓、降血压、抗菌、预防骨质疏松、调节肠道菌群平衡等。在发酵过程中产生的纳豆激酶,具有凝血、激活人体血栓溶解系统的功能[2],有研究表明其提取物能显著缓解高果糖诱导的葡萄糖不耐受症、高胰岛素血症和血脂障碍等生理疾病[3]。
小米是一种优质的杂粮资源,其蛋白质含量在11.43%~13.72%,氨基酸含量丰富[4];因其高膳食纤维、低血糖生成指数(GI) 的特性被广泛应用于健康食品的开发中[5-6];又因其抗干旱、产量高、容易管理的特性被广泛种植。在国外有食用发酵的习惯,如小米稠粥、塞拉米,这些都是通过微生物发酵小米来达到改善小米的口感和风味的目的[7]。在国内,通过对发酵小米糠[8-9]和酶解小米分离蛋白[10]来获得的抗氧化多肽;同时,也有依托地区特色食品为蓝本利用乳酸菌来发酵小米,分离具有抗菌活性的多肽[7]。在食品加工中氧化是一个影响食品品质的重要过程,其对食品的营养、风味、结构、安全都有重要影响[11-12],在氧化过程中产生的自由基与人体细胞损伤密切相关[13]。体外评价抗氧化能力化学指标法和细胞试验法,化学指标法因具有快速方便、成本低的特征,被广泛应用于初期的抗氧化研究。测试方法有自由基清除法、氧化还原法和脂质过氧化抑制法。通过对不同条件下发酵小米中抗氧化活性和蛋白质含量变化,为发酵小米的提取抗氧化物质提取提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料
东方亮1 号小米,山西东方亮生命科技股份公司提供;黑豆,忻州市汇丰粮业有限公司提供;小米分离蛋白,实验室碱溶酸沉自提。
1.1.2 试剂
牛血清白蛋白(BR)、考马斯亮蓝G-250(BR)、大豆分离蛋白(BR)、22 - 二- 1 - 苦肼基自由基(BR)、SDS(BR)、ABTS(BR),北京索莱宝科技有限公司提供;其他试剂为分析纯。
1.1.3 试验设备及仪器
UV-1100 型紫外分光光度计、SW-CJ-2FD 型双人单面净化工作台、SB25-12DTDN 型超声波清洗机、HH·B11·420-BY 型恒温培养箱、DGL-50GL 型立式蒸汽灭菌器、迷你离心机、ST-3100 型pH 计。
1.2 试验方法
1.2.1 发酵剂制作
将15 g 黑豆用80 mL 蒸馏水浸泡12 h,煮沸20 min,在超净工作台中,用灭菌的纱布过滤,将黑豆置于100 mL 灭菌的烧杯中用8 层纱布和1 层扎孔的牛皮纸密封,在常温下避光发酵,每8 h 补充2 mL 的无菌水并摇动通气,待大豆表面生成大量乳白色黏稠物质时停止培养。
1.2.2 菌悬液的制备
将1.5 g 小米分离蛋白、0.05 g 氯化钠、0.25 g 葡萄糖和50 mL 蒸馏水混匀加入200 mL 锥形瓶中,6 层纱布密封。于121 ℃下灭菌15 min,再经超声处理10 min,向上述发酵黑豆中加入10 mL 无菌水,摇匀转移到小米蛋白培养基,于37.6 ℃下以转速180 r/min培养24 h,冷藏保存,每15 d 传代培养1 次[14]。
1.2.3 固态发酵
将5.0 g 小米浸泡12 h,然后与0.01 g 磷酸氢二钾、0.3 g 大豆分离蛋白、5 mL 蒸馏水混匀,高压灭菌完成的固态培养基置于超净工作台,先加入适量无菌水,保持基质含水量在60%左右,用无菌玻璃棒把结块的小米充分搅碎,摇匀接入菌悬液。接种时保证菌悬液与无菌水共3 mL,然后在恒温培养箱中培养,每12 h 用2 mL 无菌水润湿纱布并摇动锥形瓶通气。
1.2.4 小米发酵单因素试验
在温度37 ℃,接种量6%,pH 值7 条件下发酵24 h,以提取液中蛋白和清除自由基能力作为指标,研究最佳发酵条件。分别研究发酵时间为0,12,24,36,48 h;发酵温度为31,33,35,37,39 ℃;基质pH 值为5,6,7,8,9;接种量为0,3%,6%,9%,12%对发酵的影响。每组试验重复3 次,取平均值。
1.2.5 正交试验
在单因素试验的基础上以发酵温度、发酵时间、初始pH 值和接种量4 个因素,进行四因素三水平正交试验,利用综合平衡法对2 个指标进行分析筛选最佳发酵条件。
1.2.6 不同时间下发酵对照试验
在最优解的基础上测试不同时间0,12,24,36,48 h 下接种与未接种小米基质抗氧化能力变化。
1.2.7 蛋白含量的计算
(1) 标准曲线制作。参照文献[15-16]的方法,稍作改进。取6 支试管分别加入0,0.2,0.4,0.6,0.8,1.0 mL 的0.1 mg/mL 牛血清蛋白,用盐酸-氯化钠缓冲液补足2 mL,加入用95%乙醇溶解的考马斯亮蓝缓冲液3 mL,摇匀在遮光处静置5 min,用紫外分光光度计在波长595 nm 处测定吸光度,以质量浓度为横坐标、吸光度为纵坐标绘制标准曲线。
(2) 上清液中蛋白含量测定。随机多次取样1.000 g 的发酵基质于研钵中加入4 ℃下保存的缓冲液(盐酸—氯化钠) 8 mL,充分研磨,在低速离心机中以转速5 000 r/mim 离心20 min,取上清液用0.22 μm 滤膜(天津·津腾) 过滤得提取液α。在离心管中分别加入0.5 mL 提取液α,1.5 mL 的缓冲液,3 mL 考马斯亮蓝溶液充分摇匀,避光反应5 min,以不含提取液α 的混合液调零,在波长595 nm 处快速测定其吸光度,以相关变量为横坐标、基质中蛋白含量为纵坐标作图。
1.2.8 抗氧化能力的测定
(1) DPPH 自由基清除能力测定。随机多次取样1.000 g 发酵基质,加入蒸馏水8 mL 充分研磨,在100 ℃下灭酶10 min,低速离心机以转速5 000 r/mim离心20 min,取上清液用0.22 μm 滤膜过滤得提取液β。参照文献[17]中方法稍作修改,将提取液β 0.4 mL 和浓度为0.2 mmol/L 的DPPH 溶液0.6 mL 加入离心管,然后在振荡器上快速振荡摇匀,以转速为7 000 r/mim 离心1 min,在37 ℃下恒温、避光反应30 min,将反应完成的混合液加入石英狭缝比色皿中,用紫外分光光度计于波长517 nm 处测定各吸光度。以变量为横坐标、清除率为纵坐标作图。计算公式如下:
式中:A样——加入样品吸光度;
A对——用等量蒸馏水代替提取液β 的吸光度;
A空——用无水乙醇取代DPPH 溶液。
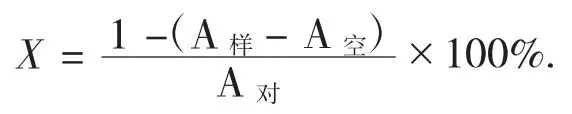
(2) ABTS 自由基清除能力测定。参照Lin Zheng 等人[18]的方法,稍作修改。将7 mmol ABTS 溶解在蒸馏水中并于2.45 mmol 的过硫酸钾混合。使混合物在黑暗中静置16 h 产生ABTS 自由基。然后用50 mmol/L,pH 值7.4 的PBS 溶液进行稀释,稀释到吸光值为0.70±0.02,蒸馏水调零。然后取提取液β 0.1 mL与ABTS 稀释液1.9 mL,混合摇匀在黑暗中反应30 min,反应完成后加入石英狭缝比色皿在波长734 nm 处测定吸光度。

式中:A样——加入样品吸光度;
A对——用等量蒸馏水代替提取液β 的吸光度;
A空——用PBS 溶液取代ABTS 稀释液。
(3) 总还原力的测定。参照Kadriye I B 等人[19]改良后的铁氰化钾法测定总还原力稍作修改。依次向试管中加入提取液β 0.5 mL,H2O 0.5 mL,1 mol/L HCl 0.75 mL,铁氰化物溶液(1%,M/V) 0.75 mL,SDS(1%,M/V) 0.25 mL,FeCl3·6H2O 溶液(0.2%,M/V) 0.25 mL 混合摇匀,将混合物在50 ℃水浴20 min,冷却至室温,反应完成后加入普通比色皿中,于波长750 nm 处测定吸光度,用蒸馏水取代提取液调零。
1.2.9 感官分析
分别从颜色、黏连性、颗粒完整程度、气味、硬度方面对不同时间下接种与未接种的小米进行感官分析。
1.2.10 数据处理
使用SPSS 25 进行显著性差异分析,使用Excel 2019 整合试验数据和作图。
2 结果与分析
2.1 标准曲线制作
牛血清蛋白标准曲线见图1。
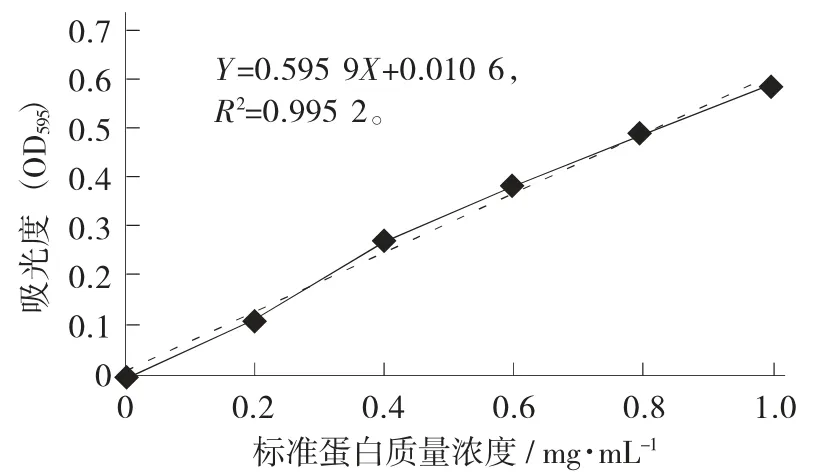
图1 牛血清蛋白标准曲线
由图1 可知,其线性曲线为Y=0.5959X+0.010 6,R2=0.995 2 在一定质量浓度范围内有较好的线性关系。
2.2 小米发酵单因素结果分析
2.2.1 发酵时间对小米发酵的影响
发酵时间对蛋白含量与DPPH 自由基清除率的影响见图2。
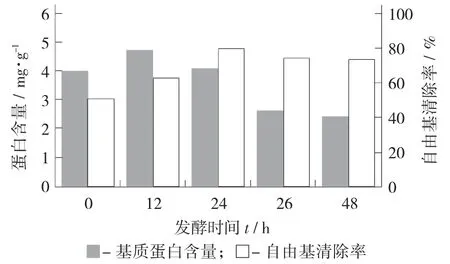
图2 发酵时间对蛋白含量与DPPH 自由基清除率的影响
由图2 可知,随着发酵时间的延长,蛋白含量与DPPH 自由基清除率呈现先上升后下降的趋势,其原因可能是细菌分泌胞外酶破坏了小米的细胞壁,使一部分蛋白被释放出来,同时分泌的蛋白酶水解大分子的蛋白质和改善蛋白质疏水特性。Shuang Yang 等人[20]在利用蛹虫草发酵玉米醇溶蛋白发现发酵能显著改善醇溶蛋白的溶解特性。在Haicheng Yin 等人[21]的研究中纳豆菌在0~8 h 内释放蛋白酶,其后以羧基肽酶为主。在延莎等人[22],B.R.Veenashri 等人[23]的研究中小米本身的酚类和多糖具有较好的抗氧化能力。发酵米糠[8]、板栗[24]、豆粕[25]的研究中表明,时间是影响发酵产物的关键因素。在培养12 h 时其蛋白含量与其他组具有显著差异(p<0.05),但是其抗氧化水平显著低于24 h(p<0.05),表明其在短时间内其分泌的胞外酶不能彻底水解大分子物质。因此,认为发酵时间为24 h 比较合适的发酵时间。
2.2.2 接种量对发酵小米的影响
接种量对蛋白含量与DPPH 自由基清除率的影响见图3。
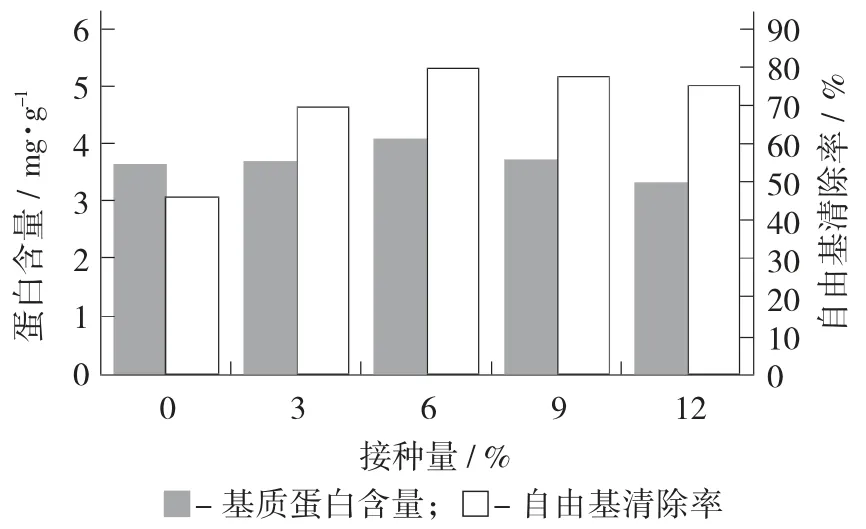
图3 接种量对蛋白含量与DPPH 自由基清除率的影响
接种量主要是在前期影响发酵进程,在细菌的对数生长期,过多接种会导致容器氧气量供应不足,影响细菌生长。接种量过少使基质中的酶过少不能有效地水解其中大分子物质,改善基质的抗氧化能力。由图3 可知,在接种量为6%时其蛋白含量与其他组有显著差异(p<0.05),DPPH 自由基清除能力也显著(p<0.05) 高于接种量为0%,3%的基质提取液,表明在24 h 内发酵接种量对基质中大分子物质分解有较大影响,这与邝嘉华等人[26]、王銮[27]报道结果一致。因此,接种量6%为适宜的发酵条件。
2.2.3 基质pH 值对发酵小米的影响
基质pH 值对蛋白含量与DPPH 自由基清除率的影响见图4。
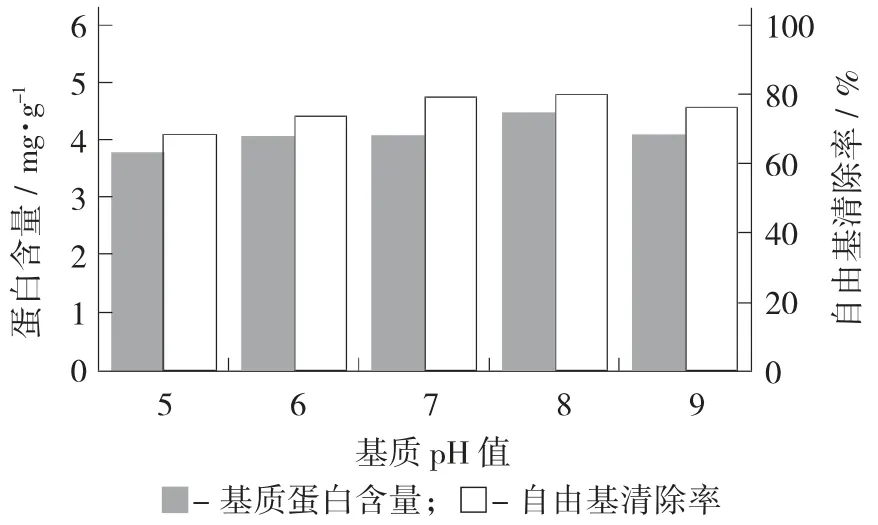
图4 基质pH 值对蛋白含量与DPPH 自由基清除率的影响
由图4 可知,在基质pH 值8 时,其蛋白含量和抗氧化能力要高于中性条件,可能的原因是在微碱性的条件下,有利于蛋白溶出,方便细菌借助基质中氮源快速生长;当基质pH 值>8 时,其碱性环境开始抑制细菌的生长,使其生长和酶的分泌受到抑制。在基质pH 值5 时基质蛋白含量显著(p<0.05)低于弱碱性下蛋白含量。在酸性的条件下,H+会与蛋白质表面电子结合,降低其溶解特性。一些研究表明,培养基pH 值会影响营养成分的运输,如葡萄糖和氮源[25]。在张建萍等人[28]的研究中,pH 值4.5 即可沉淀获取小米蛋白。因此,认为基质pH 值8 是最佳发酵条件。
2.2.4 发酵温度发酵小米的影响
发酵温度对蛋白含量与DPPH 自由基清除率的影响图5。
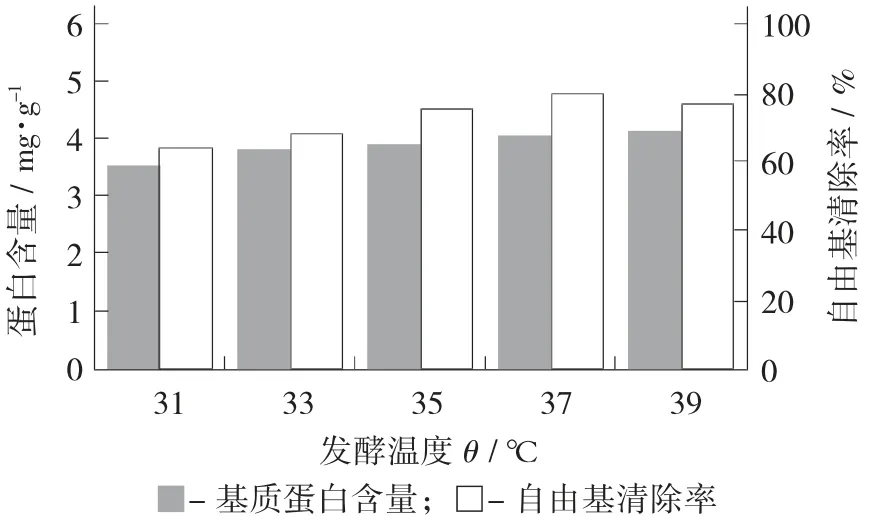
图5 发酵温度对蛋白含量与DPPH 自由基清除率的影响
在微生物的生长发育中,主要依靠酶和其相关的催化反应进行新陈代谢,而酶的催化活性由温度决定[20]。由图5 可知,随着发酵温度上升,基质抗氧化能力呈现先上升后下降的趋势,在低温和高温的条件下细菌的生长受到抑制,同时低温也会抑制胞外酶的活性,高温会影响酶的结构和改变基因的表达。在37 ℃培养条件下蛋白含量和自由基清除能力显著(p<0.05) 高于低温条件培养。在39 ℃条件培养与37 ℃并无显著(p>0.05) 差异。因此,选用37 ℃为最佳发酵条件。
2.3 发酵正交结果分析
在单因素试验最佳结果的基础对发酵温度、发酵时间、基质pH 值和接种量进行四因素三水平正交试验,进一步探究这些因素对抗氧化活性物质的影响。
固态发酵正交因素水平见表1,固态发酵正交试验设计与结果见表2,固态发酵正交试验设计方差分析见表3。

表1 固态发酵正交因素水平
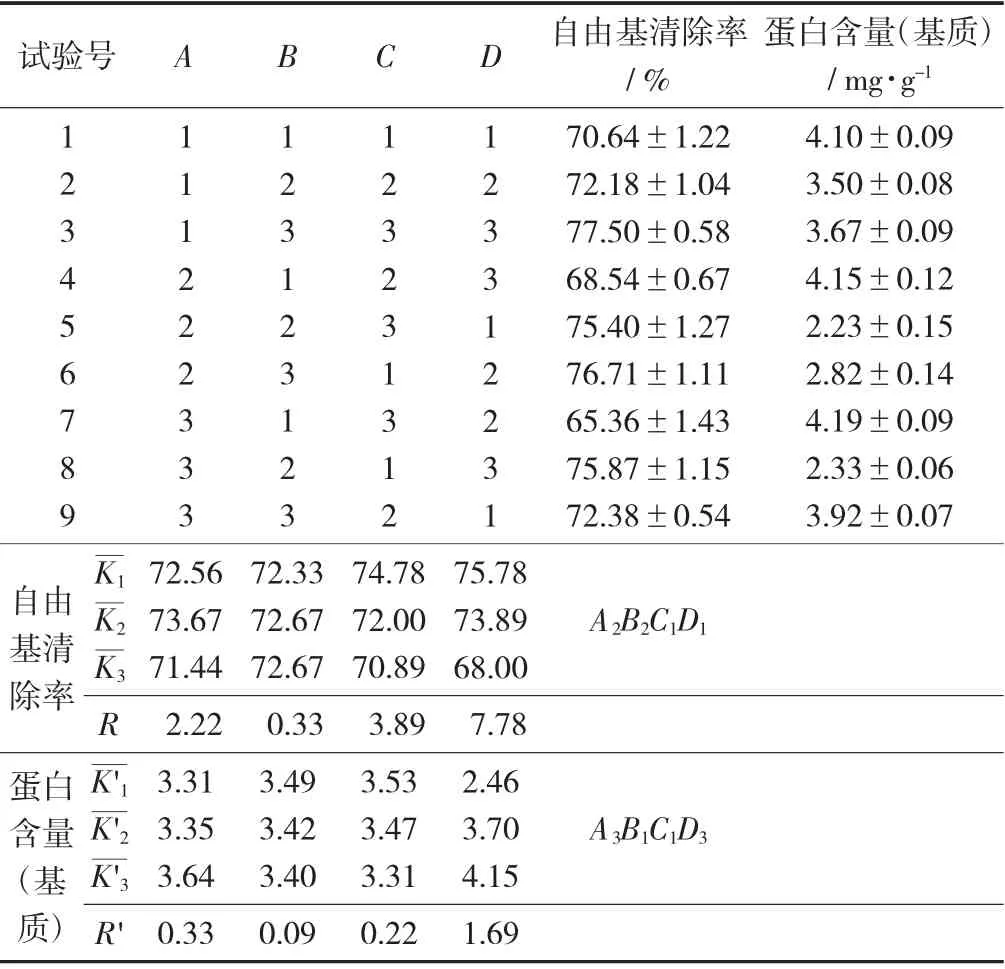
表2 固态发酵正交试验设计与结果
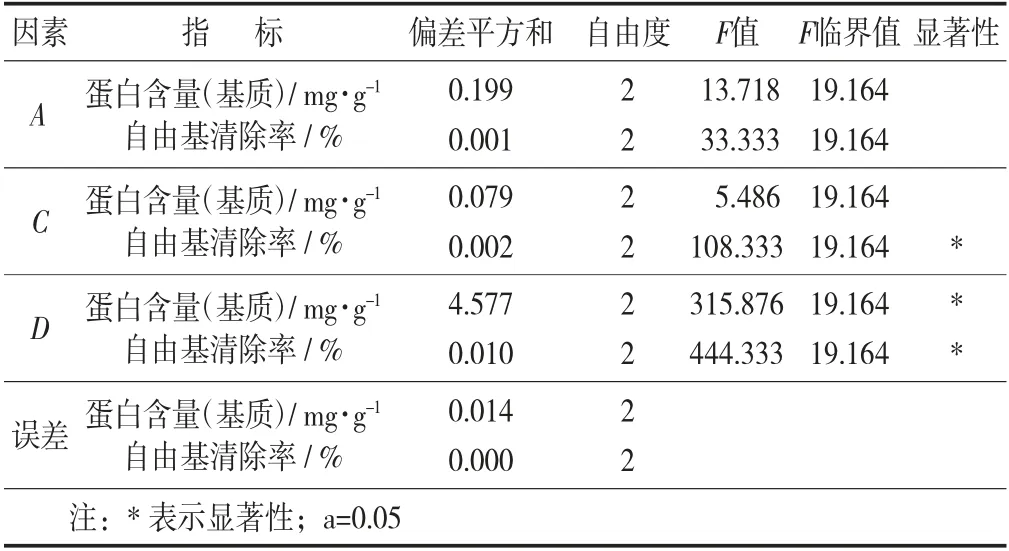
表3 固态发酵正交试验设计方差分析
由表2 可知,发酵时间对基质蛋白含量与自由基清除能力影响最大。对基质蛋白含量影响因素依次为发酵时间、发酵温度、接种量、基质pH 值,即D>A>C>B。其均值的最大项为其最优解。对于基质清除自由基能力影响依次因素为发酵时间、接种量、发酵温度、基质pH 值,即D>C>A>B。
由表3 可知,F值判断可知影响基质中蛋白含量因素的依次顺序为发酵时间、发酵温度、接种量。对于DPPH 自由基清除能力影响因素依次为发酵时间、接种量,发酵温度。其结果与直观分析结果相符合。
固态发酵极差与因素最优解水平见表4。
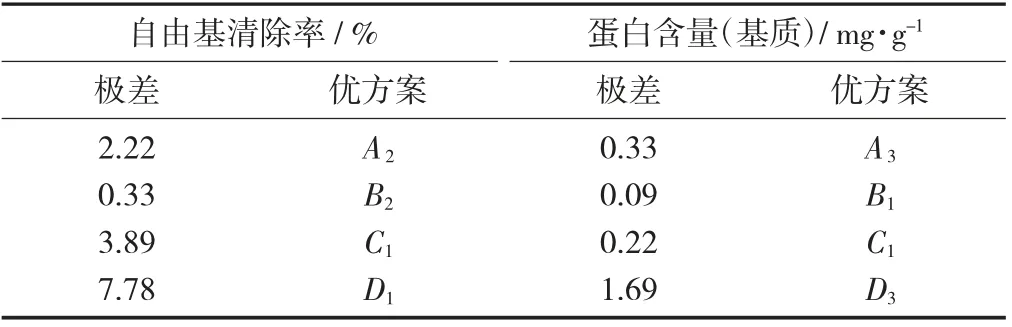
表4 固态发酵极差与因素最优解水平
发酵时间D对两指标的影响:表4 显示发酵时间对两指标来讲极差均是最大,对于基质蛋白含量来讲D3水平为最优,对于自由基清除率来讲D1水平为最优。由单因素结果分析可知在D3水平下其大分子物质水解程度较低,不适合提取抗氧化活性物质。基于两指标在不同时间下多重比较结果分析D2水平适合最优水平。
发酵温度A对于两指标的影响:表4 显示发酵温度对两指标来讲都是第二关键因素,温度低时微生物繁殖和酶分解速度下降,温度过高会破坏微生物和酶的结构不利于活性物质的生成。因此,选择抗氧化水平较高A2为最优发酵条件。
基质pH 值B对两指标的影响:表4 对于两指标来讲因素B都是最弱的影响因素,多重比较结果显示其3 水平下的两指标都没有显著性(p>0.05) 差异。因此,选用B1水平为最佳条件。
通过各因素对基质蛋白含量与DPPH 自由基清除率的综合分析得出最优方案为发酵时间24 h,接种量9%,发酵温度37 ℃,基质pH 值8。
由于正交试验结果不在正交试验设计表中,因此利用最佳参数进行发酵验证,结果为DPPH 自由基清除率80%,基质蛋白含量3.84 mg/g,其中自由基清除率高于所有正交试验结果,基质蛋白含量高于多少结果。因此,认为此发酵组合是合理的。
2.4 发酵产物抗氧化活性探究与感官分析
2.4.1 不同时间下DPPH 自由基清除能力的变化
DPPH 自由基清除能力测定见图6。
由图6 可知,在接种细菌开始发酵后,其基质的抗氧化能力显著提高。未接种的小米固态培养基,随着发酵时间延长其抗氧化能力在不断下降,其中的黄酮、多酚、脂质不断被氧化,使小米的品质不断下降。接种发酵24 h 后其抗氧化能力显著(p<0.05) 高于其他时间。
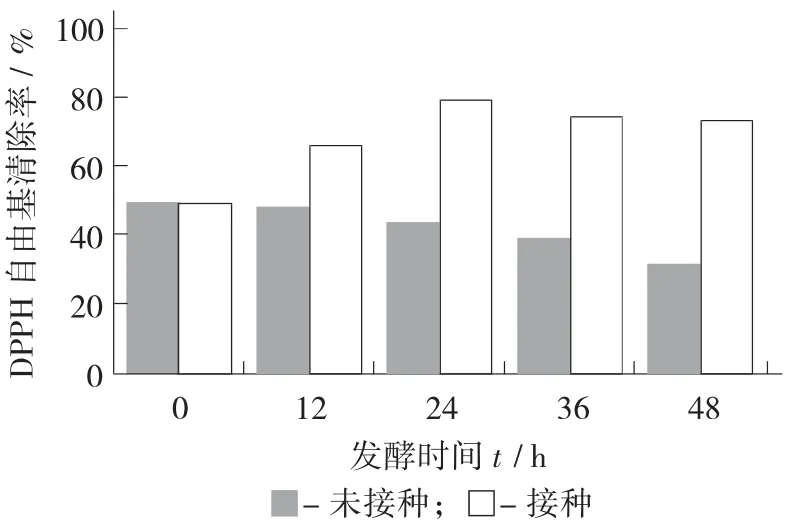
图6 DPPH 自由基清除能力测定
2.4.2 不同时间ABTS+自由基清除能力变化
ABTS+自由基清除能力测定见图7。
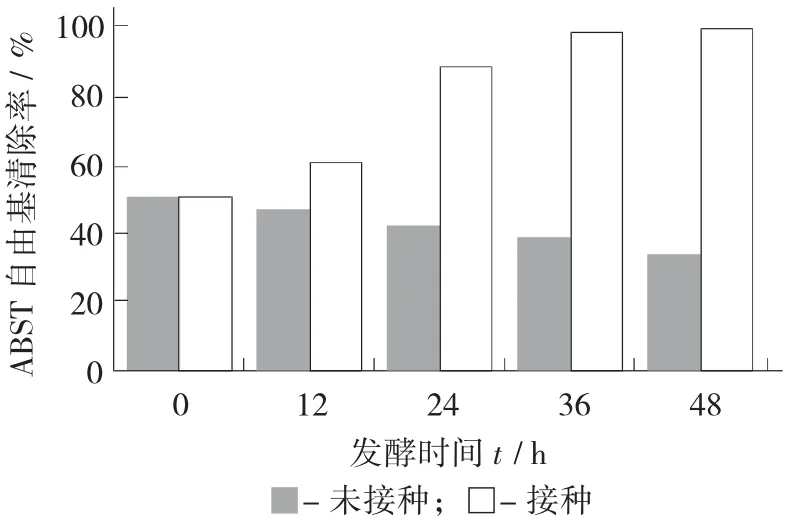
图7 ABTS+自由基清除能力测定
由图7 可知,随着发酵时间延长,接种后其清除ABTS 自由基的能力显著增强(p<0.05)。其在后期自由基清除能力不断增加,表明有其他还原性物质生成,如多糖、多酚。利用发酵获取多糖已经有较多研究[29-30]。通过发酵米糠[9]、桑葚[31]、橙子皮[32]来获取多酚也有报道。
2.4.3 不同时间总还原力的变化
总还原力测定见图8。
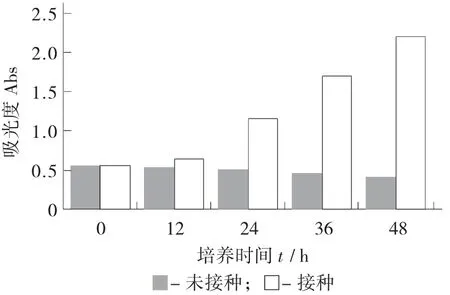
图8 总还原力测定
铁氰化钾法测定总还原力可以直接通过吸光度来判断总还原力的大小,吸光度与还原力呈正相关。由图8 可知,随着发酵时间延长,接种与未接种还原力差距越来越明显。相对于用乙醇溶解DPPH 自由基测定抗氧化能力的大小,总还原力能更好地反映基质的整体还原性。后期在基质蛋白含量显著下降的条件下依然保持较高的抗氧化活性,其原因可能是大分子物质分解为更小的活性物质或者存在发酵产物的协同作用[33]。Liang Zhishan 等人[34]在研究葡萄提取物中发现,其中多酚类化合物存在协同抗氧化作用。在饶胜其等人[35]的研究中,通过纯化的鸡蛋清蛋白酶解肽和大豆蛋白酶解肽具有明显的协同效应。
2.4.4 不同发酵时间的感官评价
感官评价见表5。
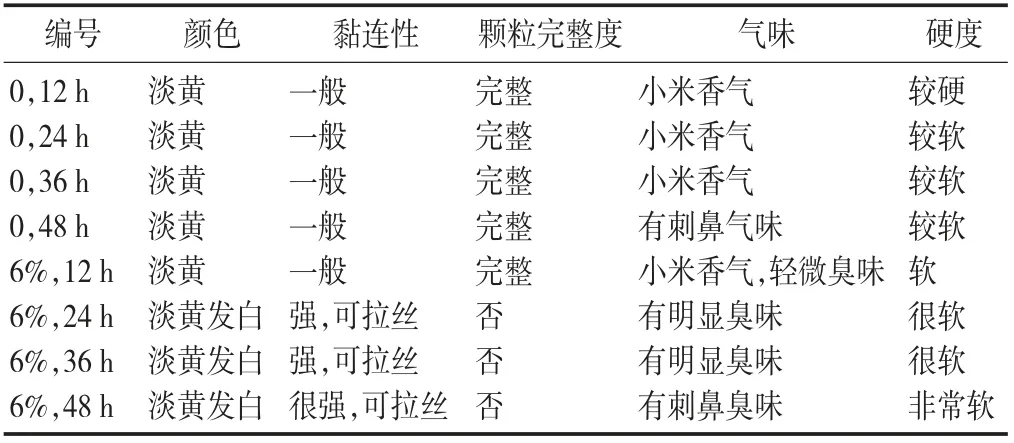
表5 感官评价
由表5 可知,经过灭菌后小米其品质在12 h 内不会发生显著(p>0.05) 变化;在24 h 后其开始快速地腐败变质;在培养箱中保存48 h 后,其有刺鼻的氨气味,其中腐败菌已经开始大量繁殖失去可食用性。接种后的小米基质培养12 h 后其硬度明显变软,证明纳豆菌不止分泌蛋白酶,也会分泌淀粉酶来获取外界多糖为自身生长发育提供碳源。在发酵24 h 后其基质会明显发黏,在对纳豆菌的研究中表明是由于聚谷氨酸的生成[36],在小米的氨基酸组成中谷氨酸含量最为丰富[37],其在发酵过程中作为聚谷氨酸合成的来源有利于聚谷氨酸快速生成,帮助基质更好地保留水分,使细菌能更好地生长发育。
3 结论
试验结果表明,利用纳豆中细来发酵小米具有良好的可行性。以基质中蛋白含量与提取液DPPH自由基率为指标,通过单因素试验优化和正交综合平衡法分析,得出发酵最佳条件为发酵时间24 h,接种量9%,发酵温度37 ℃,基质pH 值8,发酵后基质蛋白含量3.84 mg/g,DPPH 自由基清除能力提高36%,ABTS 自由基清除能力提高38%。同时,在发酵过程中产生的其他产物,如多糖、聚谷氨酸,也为其相关产品生产提供了新的视角。

