水稻NACA基因家族的鉴定及NACA2功能研究
刘永昌,聂祝运,张 斌,袁志辉,何春兰
(湖南科技学院, 化学与生物工程学院/湖南省银杏工程技术研究中心,湖南永州 425199)
新生多肽结合复合体(nascent polypeptide-associated complex,NAC)是由α(NACA)和β(NACB/BTF) 2个亚基组成的异源二聚体,能够保护新生多肽,并引导新生多肽正确定位。结构分析发现,2个亚基的NAC结构域均存在于N端,且三维结构比较相似,但只有NACA的C端存在UBA (ubiquitin-associated) 结构域。另外,某些物种的NACB含有入核信号,而在NACA中没有发现[1]。
目前,已经在丹参、玉米和水稻等植物中相继克隆出NACB/BTF3基因,并对其功能进行了研究。在烟草和小麦中,BTF3基因影响了叶绿体和线粒体的发育,导致植株叶片颜色变黄,叶扭曲[2-4]。在水稻中,过量表达BTF3的转基因株系在叶绿素含量、叶绿体数量、光合速率、叶片大小、株高、节间长等方面显著增加或增强,而 RNAi株系的指标则明显降低或减弱[5]。另外,沉默水稻BTF3使水稻花粉活力明显降低,种子数量减少[6]。除了生长发育,NACB影响植物对逆境胁迫的响应。在拟南芥中过量表达互花米草NACB后,转基因拟南芥叶绿素含量、脯氨酸含量增加,并且离子动态平衡加强,对盐害和干旱有比较强的抵抗力[7]。在小麦中,沉默BTF3降低了植物对冻害和干旱的抵御能力[8]。沉默辣椒BTF3可以导致超敏反应引起的坏死细胞数量减少,同时超敏反应相关基因的表达量下降,烟草花叶病毒的外壳蛋白量增加[9]。过量表达水稻BTF3的转基因水稻对高盐和低温胁迫抗性显著增强,但抗旱性下降,而 RNAi转基因株系的抗性则减弱[10]。综上所述,NACB/BTF3不仅调控了植物的生长发育,而且在植物响应各种胁迫的过程中也发挥了重要作用。
虽然NACA和NACB可以形成异源二聚体,但是二者在细胞内的生物学功能并不相同。NACA可以直接或间接对靶基因进行转录调控,从而影响细胞分化、内质网胁迫、细胞凋亡等生物学过程[11-12]。作为新合成的多肽运出核糖体的通道组分,NACA可以结合到新生多肽链上,调节信号识别颗粒与新生多肽的结合,影响新生多肽转移到内质网腔内[13]。在植物中,关于NACA功能的研究鲜有报道。有研究表明,烟草灰霉病PebC1与NACA同源。PebC1的诱导可以加快小麦的苗期生长速度,并且提高小麦的抗旱性。在番茄中,PebC1的诱导不仅可以提高植株对番茄灰霉病的抵抗能力,并且在PebC1处理后,植株中与抗病调节相关的苯丙氨酸解氨酶、过氧化物酶、多酚氧化酶的活性都有不同程度的增加[14]。蛋白组分析表明,水稻受到盐和低温胁迫时,NACA表达水平下调,但其具体生物学功能及作用机制仍然不清楚[15-16]。以上结果暗示,NACA可能在植物响应非生物胁迫的过程中发挥了重要作用。本研究从水稻中鉴定到5个编码NACA蛋白的基因,并对其进行了生物信息学分析和表达模式的研究。同时,利用转基因拟南芥初步研究了NACA2在植物抗旱过程中的功能,为进一步研究NACA基因在水稻抗逆过程中的生物学功能及作用机制提供参考。
1 材料和方法
1.1 试验材料与处理
试验材料拟南芥(Arabidopsisthaliana)为哥伦比亚野生型,水稻为粳稻品种‘日本晴’(Oryzasalivasubsp keng),农杆菌菌株EHA105、大肠杆菌菌株XL1-blue均由本实验室保存。
选取饱满无霉的水稻种子,去壳,然后用75%酒精消毒1~2 min,再用次氯酸钠溶液消毒45 min,用无菌水冲洗4~5次,将其播种到MS培养基上,置于培养箱中(湿度为28 ℃,光照强度为6 000~8 000 Lx,12 h光照/12h黑暗)培养15 d。将水稻幼苗转移至液体MS培养基中继续培养2 d,然后用含有100 μmol/L JA、100 μmol/L SA、100 μmol/L ABA、300 mmol/L甘露醇和250 mmol/L NaCl的液体MS培养基及4 ℃低温,分别处理0、1、3、6、12和24 h后取样,液氮速冻后保存于-80 ℃冰箱备用。
1.2 试验方法
1.2.1 NACA蛋白的鉴定及生物信息学分析利用拟南芥NACA蛋白序列做探针序列,对Phytozome(https://phytozome-next.jgi.doe.gov/)中的水稻蛋白组数据库进行比对分析,获取基因号、基因组序列、转录产物序列、氨基酸序列。在SMART(http://smart.embl-heidelberg.de/)和NCBI保守结构域(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测NACA蛋白结构域,进一步确定氨基酸序列中是否包含NAC和UBA结构域。利用ExPASy(https://web.expasy.org/protparam/)在线预测NACA蛋白的等电点、分子量和不稳定系数。利用PSORT(HTTP://www.genscript.com/psort.html)预测NACA蛋白的亚细胞定位。利用GSDS(http://gsds.gao-lab.org/)在线分析水稻NACA基因外显子-内含子结构。通过MEME(https://meme-suite.org/meme/)在线分析氨基酸序列中的保守基序,最短基序为5,最长的基序为50,共显示10个保守基序。利用ClustalW(https://www.genome.jp/tools-bin/clustalw)对水稻NACA氨基酸序列进行比对分析,保存为MSF格式,然后利用GeneDoc对比对结果进行编辑。从Phytozome及NCBI数据库中获取脐形紫菜(Porphyraumbilicalis)、大豆 (Glycinemax)、拟南芥(Arabidopsisthaliana)等物种NACA同源蛋白序列,用MEGA6.0软件采用邻接法(Boot strap=1 000)构建系统进化树,分析不同物种NACA的进化关系。
1.2.2NACA的表达模式分析利用MSU-RGAP(http://rice.uga.edu/index.shtml)数据库获取5个NACA基因在不同组织中的表达数据,利用HemI 1.0绘制表达量热图。
利用RNA提取试剂盒提取不同胁迫处理后水稻样品的总RNA,利用反转录试剂盒(聚合美)合成cDNA,保存到-80 ℃备用。实时荧光定量PCR在美国伯乐CFX Connect上进行,利用NACA基因特异引物进行PCR扩增,以Actin基因做内参(表1)。反应体系为10 μL,分别包括1 μL cDNA,上下游引物各0.4 μL,SYBRgreen Mix 5 μL, ddH2O 3.2 μL;反应参数为94 ℃预变性1 min,95 ℃变性15 s,55 ℃退火20 s, 72 ℃延伸30 s, 45个循环。每次实验设置3次重复,采用2-ΔΔCt法分析实验结果,用Excel进行数据分析、绘图。
1.2.3 NACA2的亚细胞定位利用基因特异引物 (表1)克隆NACA2全长的CDS (coding sequences),用同源重组方法克隆到pBWA(V)HS。再利用35S启动子驱动NACA2-GFP在水稻原生质体中表达融合蛋白,以空载体作为对照。将构建好的载体pBWA(V)HS-NACA2-GFP及核定位信号(nucleus localization signal, NLS)融合红色荧光蛋白mkate的载体共同转化水稻原生质体,利用荧光共聚焦显微镜观察荧光信号,进行NACA2亚细胞定位。

表1 引物序列
1.2.4NACA2转基因拟南芥对非生物胁迫的响应拟南芥种子通过10% NaClO消毒15 min,用无菌水清洗4~5次。将消毒后的种子铺在1/2 MS培养基中,4 ℃处理3 d,转移至培养室中(湿度为22 ℃,光照强度为6 000~8 000 Lx,12 h光照/12 h黑暗)。将萌发5 d后幼苗移至1/2 MS及含有150 mmol/L 甘露醇的1/2 MS培养基上,竖直培养,5~7 d后测量主根长。将萌发14 d后幼苗种植到营养土中,1周后开始停止浇水,进行干旱处理。出现干旱表型后开始拍照,复水,称量不同株系地上部分重量。在土壤中生长2周后,剪取不同株系相同位置的叶片放置到称量纸上,每个重复3个叶片,每隔3 h称量1次,计算失水速率。实验数据用Excel处理,每个实验设置3个重复。
2 结果与分析
2.1 水稻NACA基因的鉴定与生物信息分析
通过序列比对和结构域分析发现,水稻中共有5个NACA家族成员,命名为NACA1~NACA5,其中NACA1具有2个转录本。理化性质分析结果表明,NACA基因长度在578~2 759 bp之间,编码蛋白分子量为12 943.14~57 239.89 Da,编码的氨基酸长度为122~516 aa。NACA蛋白的等电点为4.28~8.63,其中NACA4的等电点为8.63,与其他蛋白差异较大。亚细胞定位预测发现,NACA蛋白亚细胞定位均为细胞核、线粒体和细胞质,但是定位在细胞核的可能性最大。蛋白的不稳定系数为48.73~71.82,其中NACA4为71.82,说明NACA蛋白均为不稳定蛋白,容易被降解(表2)。

表2 水稻NACA基因家族成员信息
进化和结构分析表明,NACA1和NACA3亲缘关系最近,NACA2、NACA4和NACA5有较近的进化关系 (图1和图3)。亲缘关系较近的蛋白也含有相似保守基序,基序分布也相似。NACA1和NACA3含有motif1、motif2、motif3、motif7,但不含有motif4。NACA2、NACA4和NACA5中都含有motif1、motif4、motif7 和 motif10 (图1)。为了进一步研究NACA蛋白的结构,对水稻NACA蛋白序列进行比对。结果表明,NACA中含有3个保守区域,位于N端的富含天冬氨酸(D)结构域、位于中间的NAC结构域及位于C端的UBA结构域,其中NACA5与NACA4序列相似度很高,但缺少部分NAC结构域和UBA结构域 (图2)。为了研究NACA蛋白的进化关系,将藻类、苔藓、蕨类和种子植物中一些物种的NACA和水稻NACB构建了系统进化树。结果表明,水稻3个NACB与进化树中所有的NACA分化明显,单独分成一支,说明NACA与NACB的差别不仅在于是否存在UBA结构域,其蛋白序列也存在明显的不同。不同物种中的NACA的分化与物种的进化关系相一致,亲缘关系由远到近分别为藻类 > 苔藓> 蕨类> 种子植物。种子植物中的NACA分为2个亚家族,且每个亚家族中单子叶植物与双子叶植物分化明显 (图3)。

A. NACA基因的基因结构;B. NACA蛋白保守基序分析
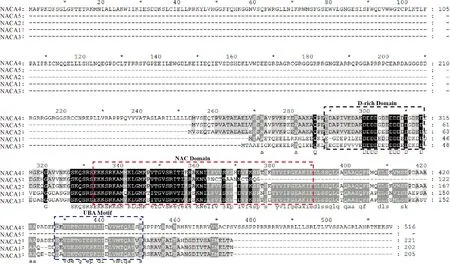
黑框内为富含天冬氨酸结构域;红框内为NAC结构域,蓝框内为UBA结构域

Pu. 脐形紫菜; Bb. 布朗葡萄藻; Cp. 角齿藓; Mp. 伞地钱; Sm. 江南卷柏; Gm. 大豆; At. 拟南芥; Os. 水稻;Sb. 高粱
2.2 NACA基因的组织表达及诱导表达分析
基于MSU-RGAP数据库的组织表达模式分析表明,NACA在水稻多种组织均有表达,且表达有明显差异。NACA1和NACA3基因在水稻各组织中表达水平较高,在花序中的表达量最高,但在叶片、花药、胚乳和授粉后10 d的种子中表达量较低。NACA2基因在水稻叶片、花和茎中有较高的表达量,在茎中的表达量最高,但在其他组织中表达水平较低。NACA4和NACA5基因在多数水稻组织中表达较低,但在茎和幼苗中表达量相对较高 (图4)。

右侧颜色标尺从蓝到红表示基因表达量从低到高。 1-13代表不同类型的水稻组织,分别为20 d的叶片(1)、抽穗后的花(2)、抽穗前的花(3)、愈伤(4)、雌蕊(5)、授粉后25 d A的胚(6)、授粉后5 d的种子(7)、授粉后10 d的种子(8)、圆锥花序(9)、授粉后25 d的胚乳(10)、幼苗(11)、花丝(12)和茎(13)
为了研究NACA基因对非生物胁迫的响应,通过qRT-PCR技术分析了5个NACA基因在JA、SA、低温、ABA、NaCl和甘露醇处理后的表达模式。结果发现,在JA诱导后,NACA1、NACA2和NACA5的表达量先降低,后期略有升高,而NACA3和NACA4表达量变化不大 (图5, A)。在SA诱导后,NACA1的表达水平随处理时间的延长而升高,NACA2的表达量随着处理时间的延长而降低,NACA4表现出降升降的表达趋势,而NACA3和NACA5的表达水平则先升高再降低,分别在处理12 h和1 h达到最高值 (图5, B)。在低温处理后,NACA5表现出升降升降的表达模式,在处理后1和12 h出现高峰,其他基因变化不大 (图5, C)。ABA处理后,NACA1和NACA4基因的表达量持续降低,而NACA1、NACA3和NACA5基因虽然在ABA处理后表达水平持续降低,但在处理24 h时表达量又增加 (图5, D)。NaCl和甘露醇处理后,NACA基因的表达模式与ABA处理类似,都表现出先下降再上升的趋势。NaCl处理后,NACA5的表达量表现为升降升的趋势,处理1 h达到峰值,处理3 h达到最低值,然后升高 (图5, E和F)。

A. 100 μmol/L JA;B. 100 μmol/L SA;C. 4 ℃;D. 100 μmol/L ABA;E. 250 mmol/L NaCl;F. 300 mmol/L 甘露醇。不同小写字母表示不同基因同一时间差异显著(P≤0.05)
2.3 NACA2的亚细胞定位分析
为研究NACA蛋白的亚细胞定位,构建NACA2-GFP融合蛋白表达载体,转化水稻原生质体,利用共聚焦显微镜观察荧光信号。结果显示,GFP荧光信号分布在细胞核和细胞质中,NACA2-GFP融合蛋白的绿色荧光信号也分布在细胞质和细胞核中,与对照相似(图6, A)。为了进一步明确NACA2是否定位在细胞核内,在水稻原生质体中共表达NACA2-GFP与核定位的NLS-mkate融合蛋白,进行共定位。结果表明,NLS-mkate具有明显的核定位,二者在细胞核的部位能够很好的重叠(图 6, B)。由此表明,NACA2蛋白定位于细胞核和细胞质中。

A.NACA2在水稻原生质体中的亚细胞定位;B.NACA2与NLS-mkate在水稻原生质体中的共定位
2.4 过表达NACA2转基因拟南芥抗旱性分析
为了研究NACA2的生物学功能,将其在拟南芥中过量表达,并通过qRT-PCR检测转基因拟南芥中NACA2的表达水平。结果表明,野生型拟南芥中检测不到NACA2的转录产物,但其在转基因株系中的表达量很高 (图7,A)。
为了进一步研究NACA2对植物抗旱性的影响,将纯合的转基因株系和野生型进行干旱处理。干旱处理23 d后,野生型和转基因株系都出现了明显的萎蔫现象。相对于野生型,转基因株系萎蔫程度较轻,颜色比较绿。复水处理后,拟南芥均开始恢复,叶片开始展开。与野生型相比,转基因株系复水速度明显更快,复水时间越长差异越明显 (图7, B)。复水后,转基因株系地上部生物量均比野生型大,野生型为1.63 g,而转基因株系分别为2.59和1.97 g (图5, C)。叶片失水实验表明,NACA2转基因拟南芥的失水速率均比野生型慢。失水12 h后,株系9#的重量下降到原始重量的73.78%,而野生型为 55.57% (图7, D)。另外,在含有甘露醇的培养基上生长1周后,NACA2过表达拟南芥的主根明显长于野生型,说明NACA2过表达增强了拟南芥对渗透胁迫的抗性 (图7, E和F)。

A.NACA2表达分析;B.抗旱实验: 处理23 d(左)和复水5 h(右);C.复水实验;D.失水速率分析,不同小写字母表示不同株系同一时间差异显著(P≤0.05);E、F.甘露醇抗性分析;不同小写字母表示处理间差异显著(P≤0.05)
3 讨 论
相比于NACB,NACA在酵母和动物细胞中研究较多,在植物中的研究非常少,其生物学功能还不清楚。前人从水稻中鉴定了3个NACA基因,即NACA1、NACA2和NACA3,但本研究中还鉴定出了NACA4和NACA5。NACA4和NACA5编码的蛋白序列的相似性较高,但NACA5蛋白序列较短,缺少部分NAC结构域和UBA结构域,可能是基因在复制的过程中出现了缺失。研究发现,NACA和NACB蛋白相似性不高,但他们的三维结构非常类似[17]。相比DNA,NACA同源二聚体的NAC结构域会更强烈地结合RNA,因此NACA被认为是RNA结合蛋白,可能在转录因子与染色质结合中发挥作用[18]。那么,水稻中的NACA能否独立作为转录因子或辅助因子调控下游基因表达?NACA独有的UBA结构域是一个广泛存在于与泛素-蛋白酶体降解系统相关蛋白上的结构域。UBA不参与二聚体的形成,但是可以使二聚体更加稳定[19]。不稳定系数分析发现,水稻NACA的不稳定系数较高,在48.73~71.82之间,属于不稳定蛋白。有研究表明,许多包含UBA结构域的蛋白质能特异地与泛素相互作用,依靠26S蛋白酶体调节蛋白的降解。因此,带有UBA结构域的NACA可能具有独特的生物学功能,如调控了NAC复合体或NACB的稳定性及定位。在水稻中,突变UBA结构域是否会影响NACA自身或NAC复合体的稳定性,最终改变水稻生长发育或响应胁迫的生物学过程?除了NAC和UBA结构域以外,水稻NACA蛋白的N端还存在一段富含天冬氨酸的肽段,但其具体功能还不清楚。SPARC (secreted protein, acidic and rich in cysteine) 是富含半胱氨酸的酸性分泌蛋白,其N端为高度酸性区的结构域,富含天冬氨酸和谷氨酸,能够以较低的亲和力与Ca2+结合[20]。拟南芥细胞分裂素响应调节因子ARRS (Arabidopsisresponse regulators) 的N端也存在一个富含天冬氨酸的信号接收结构域,该结构域包括顺式作用元件,也可以被磷酸化,从而调控其稳定性[21]。多效的转录因子PURα(purine-rich element binding protein alpha) 的C端具有富含谷氨酸和天冬氨酸的结构域,该结构域对于PURα与其他蛋白相互作用非常重要[22]。由此可见,富含天冬氨酸的结构域可能结合金属离子、磷酸基团或与其他蛋白相互作用。因此,通过突变、删除和编辑等手段系统研究NAC、UBA和富含天冬氨酸结构域的功能对于解释NACA蛋白发挥作用的分子机理具有重要的意义。
NAC是一个具有多种功能的蛋白复合体, 包括保护新生肽链、调控新生肽转位进入内质网和线粒体等。酵母和动物细胞中的研究表明,NACA在转录调控中起作用,能与辅激活类蛋白相互作用、激活骨钙素基因、正向调控人红细胞分化、调节肌发生等。有研究表明,烟草灰霉病NACA的同源基因PebC1可以加快小麦的苗期生长速度,并且提高其干旱抗性。在番茄中,PebC1蛋白的诱导不仅可以提高植株对番茄灰霉病的抵抗能力,并且在处理后,番茄植株中和植物抗病调节相关的苯丙氨酸解氨酶、过氧化物酶、多酚氧化酶的活性都有不同程度的增加[14],暗示NACA可能参与细胞应对外界环境胁迫的过程。水稻中,NACA2和NACA5受到高盐、甘露醇、低温、SA、JA处理的显著调控,其中NACA2最为明显。过表达NACA2减慢了拟南芥叶片的失水速率,增强拟南芥对干旱和渗透胁迫的抗性,但NACA基因在水稻响应外界胁迫过程中是否发挥了作用?另外,5个NACA基因具有明显的组织表达特异性,尤其是NACA1、NACA2和NACA3在花、花序、种子和胚乳中的表达量较高。最近研究表明,拟南芥NACA5负调控了花粉管的伸长[18]。在水稻中,编码β亚基的Osj10gBTF3影响叶绿体蛋白的输入,从而调控了花粉的发育[23]。以上结果暗示,NACA基因可能在调控水稻生殖生长的过程中起作用。本研究对水稻NACA基因的表达模式进行分析,发现不同的基因具有明显的组织和诱导表达模式,进一步研究发现NACA2基因调控了拟南芥对干旱和渗透胁迫的抗性。在后续研究中,通过过表达、抑制表达和基因编辑等手段深入研究NACA基因在水稻生长发育和抗逆过程中的生物学功能和作用机制,可以为丰富水稻抗逆的分子机制及抗逆育种提供了参考。

