miR398和miR408 对UV-B胁迫下拟南芥幼苗的影响
陕永杰,张美萍,冀丽蓉,李丹,张莉,沈振国
1.山西师范大学地理科学学院,山西 临汾,041000;2.山西师范大学生命科学学院,山西 临汾,041000;3.南京农业大学生命科学学院,江苏 南京,210094
MicroRNAs (miRNAs)是一类参与 mRNA 转录后调控的非编码单链小 RNA,在植物器官形成、发育与分化信号通路及基因表达中均有重要作用[1].逆境胁迫可诱导某些 miRNA 表达并在多种胁迫中发挥重要的调控作用[2,3].Sunkar等发现,拟南芥幼苗的 CSD1 和 CSD2 在高浓度Cu2+和高浓度 Fe3+下的表达水平受miR398调控,消除氧化基团,减轻植物受胁迫的损伤[3~5].miR408 对低温、干旱、重金属等多种非生物胁迫均有响应[6,7].miR398 和miR408 虽可对植物遭遇的多种胁迫产生应答,但其应答机制有待研究.
近年来,随着氯氟烃化合物等大量使用,臭氧层加速损耗,臭氧层的减少导致到达地表面的UV-B(波长 280 nm~320 nm)辐射增加[8].研究表明,增强UV-B 辐射影响了植物的生长发育、生理生化过程、细胞活动、分子调控机制等均产生显著变化[9~11].UV-B辐射引起的光氧化会对光合系统造成损伤,引起光抑制[12~14].UV-B 辐射对PSⅡ的影响要远大于对PSⅠ的影响[15,16],损伤了捕光系统和耗散保护机制,破坏了植物的光合系统,使其光合效率下降[17].UV-B胁迫下,膜脂过氧化及清除自由基的能力加剧.为应对胁迫,植物形成了一系列防御保护机制[18].Jia等在欧洲大叶杨中研究了24个miRNA发现,在 UV-B 辐射下,13个miRNA上调表达,11个下调表达[19,20].本研究通过研究miR398 和miR408 对 UV-B 辐射胁迫的响应,为作物育种提供依据.
1 材料与方法
1.1 材料
1.1.1 材料及培养 选用哥伦比亚(Columbia-0)生态型野生拟南芥作为对照组,过表达miR398 和过表达miR408 拟南芥均购于拟南芥种子资源库.用1 %的次氯酸钠进行种子消毒,无菌水清洗,播种于MS培养基上,低温(4 ℃)48 h,23 ℃光照培养箱中培养,湿度为70 %,光照时间为 16 h,暗处理8 h,待拟南芥长出两片真叶时移栽到土壤基质(泥炭土∶蛭石∶珍珠岩=1∶1∶1)中,进行实验处理.
1.1.2 材料处理设置 共设置四个处理组,分别是正常光照下野生型拟南芥组(WT),过表达miR398/miR408 拟南芥组(miR398/miR408),UV-B 辐射下的野生型拟南芥组(WT-UVB),UV-B辐射下的过表达miR398/miR408 拟南芥组(miR398-UVB/miR408-UVB).光照强度为 2 000 Lx,培养温度23 ℃,湿度为70 %,UV-B 辐射剂量为 10.08 kJ·m-2d-1,紫外灯光规格30 W,297 nm(南京华强生产),各实验处理组设置如表1.

表1 各实验处理组的设置Tab.1 Setup of each experimental treatment group
1.2 方法
1.2.1 光合系统指标测定 移栽土壤培养 20 d 时进行指标测定,参考高俊凤的方法[21],将各处理组的植物放在黑色罩中暗适应 30 min,选择正常生长的叶片,在不离体的条件下用叶夹夹住叶片,测定初始荧光F0,最大荧光Fm,按公式Fv=Fm-F0为可变荧光Fv,Fv/Fm为 PSⅡ最大光化学效率,再测得Fm′、F0′、Fs,根据计算公式测得:非光化学淬灭(NPQ)及光化学淬灭系数qP,公式如下
Fv/Fm=(Fm-F0)/Fm

1.2.2 超氧化物歧化酶(SOD)活性测定 采用氮蓝四唑光还原法测定SOD酶活性.称取 0.5 g 叶片,加入 2 mL 预冷的提取介质于冰浴中研磨成浆液,定容至10 mL,取 5 mL提取液 4 ℃,10 000 r/min 离心 15 min,提取上清液即为 SOD 粗提取液,测定560 nm 处的吸光度.
1.2.3 谷胱甘肽(GSH)含量的测定 采用 DINB 显色法测定 GSH 含量,取 0.5 g 新鲜植物叶片,加入 5 mL 5 % TCA,充分研磨均匀,15 000 r/min 离心 15 min,取上清液 1 mL,加入 5 mL 磷酸缓冲液(pH=7.7,0.15 mmol/L),加入 30 μL DTNB,反应后,以 5 % TCA 为空白,于412 nm测定吸光度.
1.2.4 丙二醛(MDA)含量的测定 依照张志良的方法[22],称取叶片 0.3 g,加入 2 mL 0.05 mol·L-1磷酸缓冲液,迅速研磨成浆液,加入5 mL 0.5 %硫代巴比妥酸提取液,沸水浴中沸腾 10 min,冷却,离心,测定532 nm、600 nm、450 nm 处吸光度.
1.2.5 数据统计与分析 采用 SPSS 17.0 与 Origin 软件对实验数据进行 LSD 和 DUNCAN 显著性分析,并作图.测定的试验数据均选用P<0.05,从最高到最低标记 a、b、c、d.
2 结果
2.1 增强 UV-B 辐射对拟南芥各处理组叶绿素荧光动力学参数的影响
Fv/Fm表示 PSⅡ原初光能转化效率[23],由图 1A 可知,正常生长情况下,野生型植株Fv/Fm高于过表达miR398 拟南芥,差异不显著(P>0.05).UV-B 辐射处理后,野生型拟南芥叶绿素荧光动力学参数Fv/Fm显著下调 10.19%(P<0.05),过表达miR398 拟南芥显著下调 16.18 % (P<0.05).表明UV-B 显著降低了拟南芥的原初光能转化效率,而miR398 的过表达更大程度上降低了植株原初光能转化效率,损害植株生长.由图 1B可知,正常光照下,野生型植株Fv/Fm高于过表达miR408 拟南芥,但差异不显著(P>0.05).UV-B 辐射处理后,过表达miR408 拟南芥显著下调 12.71%(P<0.05).表明 UV-B显著降低了拟南芥的原初光能转化效率,过表达miR408 进一步降低了植株的原初光能转化效率,影响了光合能力,损害植株生长.
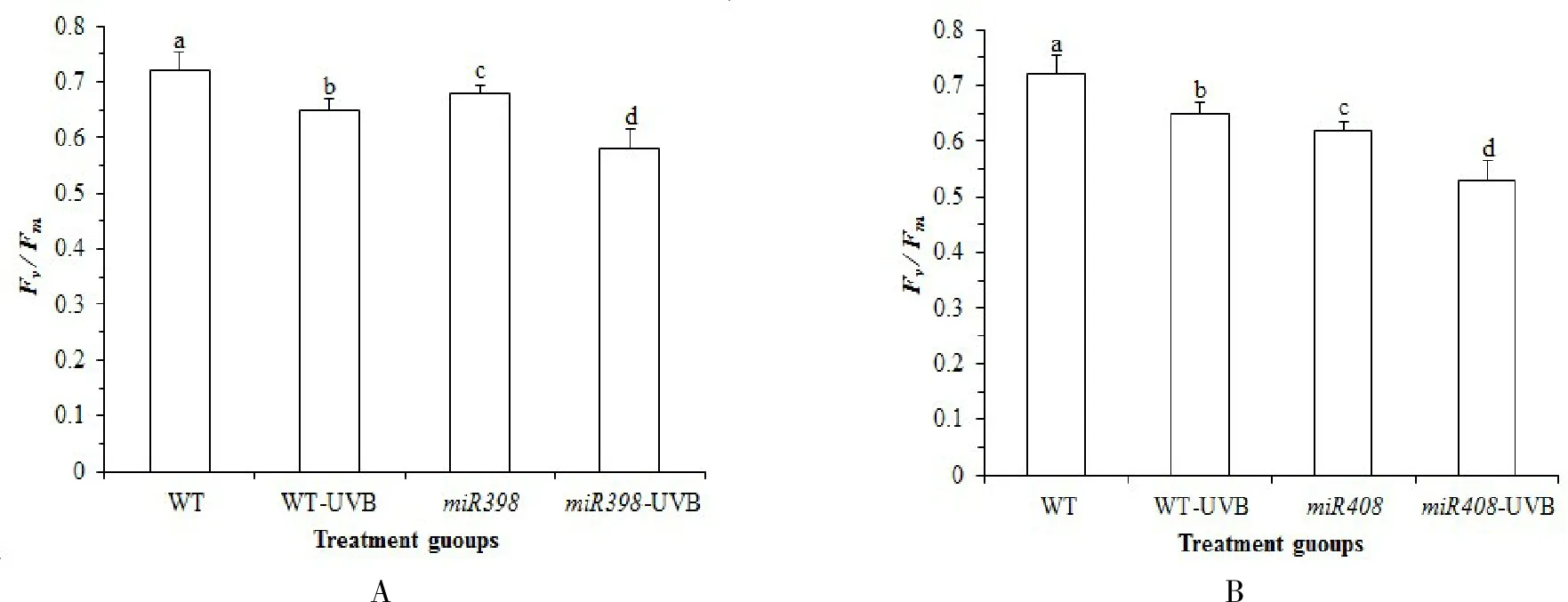
图1 拟南芥各处理组光合参数 Fv/Fm 变化Fig.1 Changes of photosynthetic parameters Fv/Fm in Arabidopsis treatment groups
qN非光化学淬灭表示的是植物耗散过剩光能转化为热能的能力[24],由图 2A 可知,正常光照下,野生型植株qN值低于过表达miR398 拟南芥,但差异不显著(P>0.05).UV-B 辐射处理后,野生型拟南芥qN值显著上升 11.42%(P<0.05),过表达miR398 拟南芥显著上升18.67%(P<0.05).表明在 UV-B 胁迫诱导下,miR398 基因调控拟南芥响应辐射,过表达miR398 拟南芥耗散过剩光能为热能的能力更强,不利于植株生长.由图 2B 可知,正常光照下,野生型植株qN值低于过表达miR408 拟南芥,差异不显著(P>0.05).UV-B 辐射处理后,过表达miR408 拟南芥显著上升 19.88%(P<0.05).表明在 UV-B 胁迫诱导下,过表达miR408 拟南芥耗散过剩光能为热能的能力更强,影响植株生长.

图2 拟南芥各处理组光合参数 qN 的变化Fig.2 Changes of photosynthetic parameters qN in Arabidopsis treatment groups
qP光化学淬灭反映光系统Ⅱ (PSⅡ)原初电子受体QA的还原状态,qP越大,表明 PSⅡ电子传递活性越大[25].由图 3A可知,正常光照下,野生型植株qP值高于过表达miR398 拟南芥(P>0.05).UV-B 辐射处理后,野生型拟南芥qP值显著下降 12.26%(P<0.05),过表达miR398 拟南芥显著下降 17.90%(P<0.05).表明 UV-B 胁迫会降低拟南芥的 PSⅡ电子传递活性,而过表达miR398拟南芥进一步降低 PSⅡ电子传递活性,影响植株生长.由图 3B 可知,正常光照下,野生型植株qP值高于过表达miR408 拟南芥,差异显著(P<0.05).UV-B 辐射处理后,野生型拟南芥qN值显著下降 12.26%(P<0.05),而过表达miR408 拟南芥显著下降 27.46%(P<0.05).表明在 UV-B 胁迫会降低拟南芥的 PSⅡ电子传递活性,而过表达miR408 基因的拟南芥进一步降低 PSⅡ电子传递活性,光合效率降低,影响植株生长.
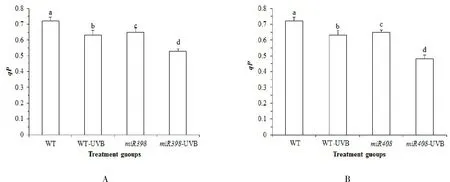
图3 拟南芥各处理组光合参数 qP 的变化Fig.3 Changes of photosynthetic parameters qP in Arabidopsis treatment groups
以上结果表明,UV-B 胁迫叶绿素荧光动力学参数Fv/Fm、qP数值降低、qN数值升高,降低光合效率,而过表达miR398 和miR408 降低 UV-B 胁迫下的叶绿素荧光动力学参数Fv/Fm、qP数值、增加qN数值,降低光合作用效率,影响了植株生长发育.
2.2 增强 UV-B 辐射对拟南芥各处理组中抗氧化酶活性的影响
植物遭遇胁迫时,植物体调动抗氧化酶类(SOD酶、CAT酶、POD酶等的活性)和抗氧化物质(GSH、AsA 等)含量清除活性氧及氧自由基等,从而降低胁迫造成的细胞损伤.植物的防御能力与抗氧化能力具相关性.由图 4A 可知,正常光照下,野生型植株 SOD 酶活性高于过表达miR398 拟南芥(P<0.05).UV-B 辐射处理后,野生型拟南芥 SOD 酶活性显著下降22.42 % (P<0.05),过表达miR398 拟南芥显著下降 48.97 % (P<0.05).表明 UV-B 胁迫会导致拟南芥 SOD 酶活性降低,而表达miR398 基因的拟南芥进一步降低 SOD 酶活性,从而 影响植物自我修复,对生长造成影响.由图 4B 可知,正常光照下,野生型植株 SOD 酶活性高于过表达miR408 拟南芥,差异显著(P<0.05).过表达miR408 拟南芥显著下降 54.23 % (P<0.05). 表明 UV-B 胁迫会导致拟南芥 SOD 酶活性降低,而过表达miR408 基因拟南芥进一步降低 SOD 酶活性降低,从而影响植物自我修复,影响植物生长.
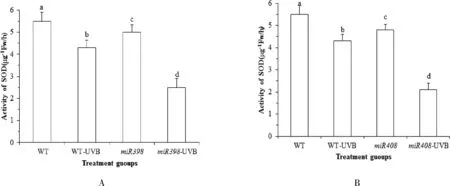
图4 拟南芥各处理组 SOD 酶活性的变化Fig.4 Changes of SOD content in Arabidopsis treatment groups
由图 5A 可知,正常光照下,野生型植株 GSH 含量高于过表达miR398 拟南芥(P<0.05). UV-B 辐射处理后,野生型拟南芥 GSH 含量显著下降 42.86 % (P<0.05),过表达miR398 拟南芥显著下降 50 % (P<0.05).表明 UV-B 胁迫会导致拟南芥 GSH 含量减少,而表达miR398 基因的拟南芥进一步降低 GSH 含量,细胞清除活性氧自由基的能力下降,降低植物防御能力.由图 5B 可知,野生型植株 GSH 含量高于过表达miR408 拟南芥(P<0.05).UV-B 辐射处理后,野生型拟南芥 GSH 含量显著下降 42.86 % (P<0.05),而过表达miR408 拟南芥显著下降 47.62 % (P<0.05).表明 UV-B 胁迫会导致拟南芥 GSH 含量减少,而过表达miR408拟南芥降低 GSH 含量,细胞清除活性氧自由基的能力下降,氧自由基的积累不利于植物的生长.
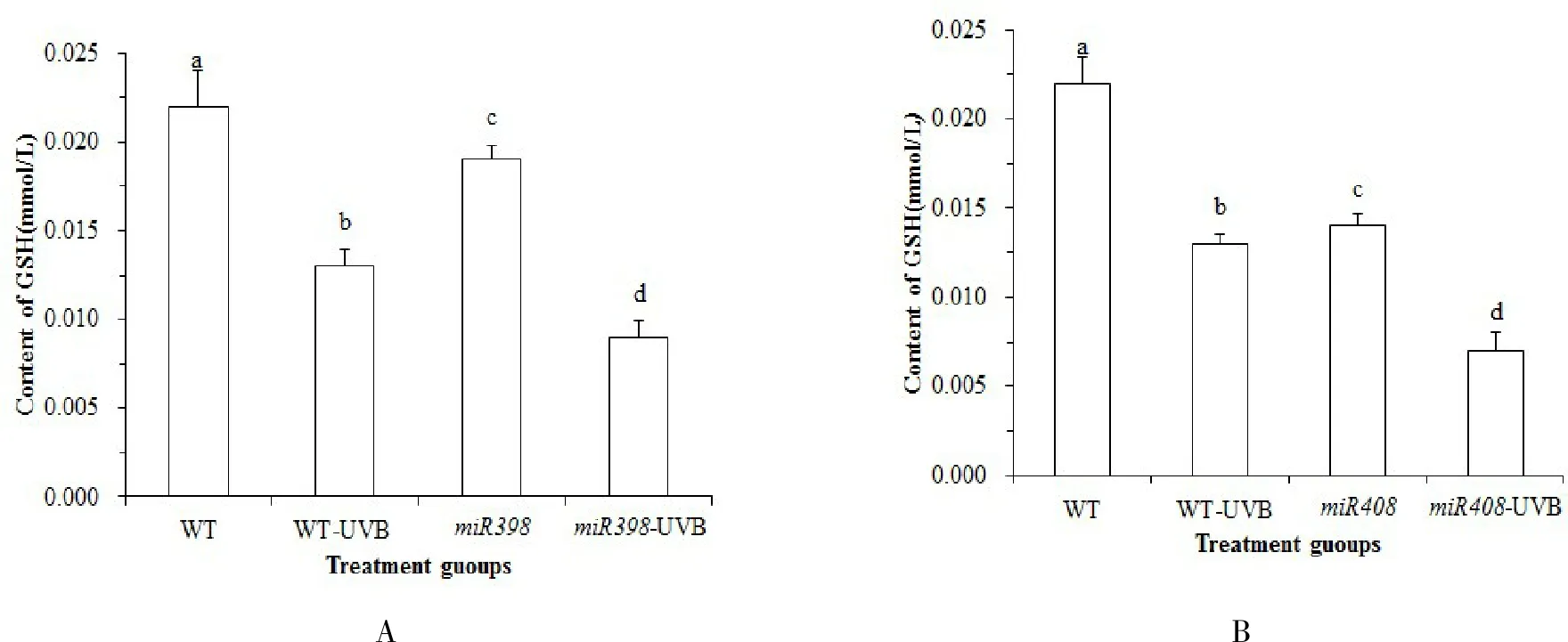
图5 拟南芥各处理组 GSH 含量的变化Fig.5 Changes of GSH content in Arabidopsis treatment groups
2.3 增强 UV-B 辐射对拟南芥各处理组中丙二醛含量的影响
植物在逆境胁迫下受到损害,这与活性氧积累导致植物膜脂的过氧化作用相关,而作为膜脂过氧化产物之一 MDA,其含量的变化可以反映膜系统受损程度.由图 6A 可知,正常光照下,野生型植株与过表达miR398 拟南芥中 MDA 含量无显著差异(P>0.05).UV-B 辐射处理后,野生型拟南芥 MDA 含量显著上升 6.71 % (P<0.05),过表达miR398 拟南芥显著上升 12.41% (P<0.05).表明 UV-B 胁迫导致拟南芥 MDA 含量升高,膜脂过氧化程度加深,而过表达miR408 拟南芥增加 MDA含量,损伤细胞膜.由图6B 可知,正常光照下,野生型植株低于过表达miR408 拟南芥中 MDA 含量(P<0.05).UV-B 辐射处理后,野生型拟南芥 MDA 含量显著上升 8.28 % (P<0.05),过表达miR408 拟南芥显著上升 65.52 % (P<0.05).表明 UV-B 胁迫会导致拟南芥 MDA 含量升高,活性氧积累,膜脂过氧化程度加深,而过表达miR408 拟南芥的 MDA 含量增加,MDA大量积累对植物造成不可修复的伤害.
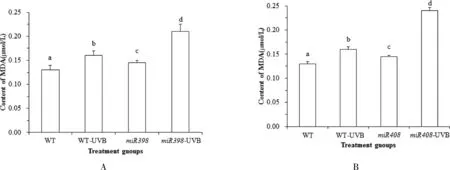
图6 拟南芥各处理组 MDA 含量的变化Fig.6 Changes of MDA content in Arabidopsis treatment groups
结果表明,UV-B 胁迫造成了拟南芥幼苗的 SOD酶活性、GSH 含量降低,MDA 含量上升,活性氧积累,而过表达miR398 和miR408 会进一步增加 UV-B 胁迫下的活性氧含量,降低植物清除氧自由基的能力,影响植物抵抗辐射逆境胁迫,损害植株生长发育过程.
3 讨论与结论
近年来,由于臭氧层减薄导致到达地表的 UV-B 辐射增强影响了植物正常生长,使得农作物产量减少[26].增强UV-B 辐射对植物的光合能力下降、抗氧化系统及 DNA 造成不同程度的损伤.强烈的紫外辐射还可破坏植物叶片中的叶绿体超微结构,光合色素合成受到抑制,最终导致光合速率的下降,影响植物生长发育[27].研究发现,受 UV-B 辐射胁迫的野生型拟南芥与正常光下的拟南芥相比,叶绿素的荧光动力学参数Fv/Fm值下降,光能转化率降低,qN非光化学淬灭系数升高,植物耗散过剩光能转化为热能的能力增强,qP造成 PSⅡ电子传递活性下降,这表明 UV-B 胁迫严重影响植物的光合作用过程,光合速率下降.此外,在 UV-B 胁迫等非生物胁迫下,植物体会产生大量活性氧,活性氧对细胞组织和生物大分子具有攻击性,少量活性氧可以作为激起植物胁迫响应和防御反应的信号分子,但过量活性氧容易造成细胞损伤.本研究发现,受 UV-B 辐射胁迫的野生型拟南芥与正常日光下的拟南芥相比,植物体内 SOD 酶活性降低,GSH 含量降低,过氧化产物 MDA 含量上升.这表明 UV-B 胁迫使得 SOD 酶活性降低和 GSH 含量减少,植物体内清除氧自由基的能力下降,造成了拟南芥体内活性氧的积累,最终导致膜脂过氧化程度加深,损伤细胞膜,影响植物生长.前人研究发现 UV-B 辐射胁迫通过对植株体中光受体的影响,致使光信号导入细胞核[28],在相关作用元件下 miRNAs 表达发生改变,影响了植物的生长发育及器官形成等[29,30].此过程中,miRNAs 的表达模式响应了 UV-B 辐射胁迫.miR398 和miR408 受多种逆境胁迫诱导并参与多种胁迫的调控,如干旱、高盐、重金属胁迫等[3~5,7].
本研究发现miR398 和miR408 均响应 UV-B 辐射胁迫.过表达miR398 和miR408 会进一步降低 UV-B 胁迫下的叶绿素荧光动力学参数Fv/Fm、qP、增加qN,降低光合作用效率,影响植株生长发育.此外,过表达miR398 和miR408 拟南芥增加 UV-B 胁迫下活性氧含量,降低植物清除氧自由基的能力,影响植物抵抗辐射逆境胁迫,损害植株生长发育过程.这表明过表达miR398 和miR408 的拟南芥植株抗逆性更差,但miR398 和miR408对 UV-B 胁迫应答机制还不完善,有待进一步研究.

