三疣梭子蟹(Portunus trituberculatus)foxl2基因功能初探及相关miRNA分析
张梦倩,张景琰,葛红星,刘萍, ,李健, ,孟宪亮, 4*
( 1. 江苏海洋大学 江苏省海洋生物技术重点实验室,江苏 连云港 222005;2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室,山东 青岛 266071;3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237;4. 中国水产科学研究院黄海水产研究所 农业农村部水生动物基因组学重点实验室,山东 青岛 266071)
1 引言
foxl2(forkhead box protein L2)是Forkhead转录因子超家族的一员,是哺乳动物卵巢发育最早的标志性启动基因[1],也是第一个被认定在卵巢发育中发挥重要作用的常染色体基因[2]。2001年,Crisponi等[3]在对睑裂狭小综合征伴随卵巢早衰患者致病基因的定位研究中,首次发现foxl2编码基因与卵巢发育相关,研究结果显示,所有被检测的卵巢早衰患者的foxl2基因都发生了突变。通过观察foxl2基因突变或缺失对小鼠卵巢的影响,进一步确认了foxl2基因在卵巢发育中的重要作用。通过基因敲除的方法,发现foxl2缺失的纯合子(foxl2-/-)雌鼠的卵巢呈现小而不规则状态,并且其中没有初级卵泡的形成,卵巢发生退化,没有生育能力[4-6];foxl2的突变也会造成卵巢发育的异常,卵巢中的卵泡数量会减少,卵巢出现早衰[7]。在非哺乳类脊椎动物中,foxl2基因与卵巢发育的密切相关性也已被证实[8-11]。Shi等[12]研究了牙鲆foxl2基因的多态性与其卵巢发育之间的相关性,发现foxl2单一位点的突变可以造成牙鲆卵巢指数的变化。foxl2在脊椎动物卵巢发育中不可或缺的作用使其成为研究卵巢发育分子调控机制非常重要的候选基因[7,13]。
对脊椎动物中的研究发现,foxl2的表达受到microRNA(miRNA)的调控[14]。miRNA是一类平均长度为22 bp的内源性单链非编码RNA,能够与靶基因的3′非编码区域(Untranslated Region, UTR)特异性结合,抑制翻译或降解其mRNA,从转录后水平对靶基因表达进行负调控,在动物的生长、发育、生殖等过程中都发挥重要作用[15]。研究表明,miR-133b可以靶向调控小鼠foxl2的表达,进而调节其卵巢发育过程[16]。近些年,miRNA对卵巢发育的调控作用已成为甲壳动物生殖生物学研究的新热点。研究表明,miR-9能够通过调控ERK信号通路关键基因进而调节拟穴青蟹(Scylla paramamosain)的卵巢发育[17]。此外,miRNA还参与了切除眼柄诱导三疣梭子蟹卵巢成熟的过程。
目前,在无脊椎动物中有关foxl2的研究刚刚起步,仅在海胆(Strongylocentrotus purpuratus)、太平洋牡蛎(Crassostrea gigas)、栉孔扇贝(Chlamys farreri)、中华绒螯蟹(Eriocheir sinensis)、拟穴青蟹等少数物种中获得了相应foxl2基因的cDNA序列。在对栉孔扇贝的研究发现,干扰foxl2表达后,卵巢发育相关基因的表达显著下调。而在拟穴青蟹中,敲降foxl2后,卵黄蛋白原基因(vtg)的表达显著上调[18]。上述研究表明,该基因在贝类和甲壳类卵巢发育中均发挥作用,但其功能可能存在差异。鉴于其在卵巢发育中具有重要作用,开展foxl2表达调控研究可能会为研发生殖调控技术提供重要参考。然而,有关无脊椎动物foxl2表达调控的研究较为罕见。
三疣梭子蟹(Portunus trituberculatus)隶属于甲壳亚门(Crustacea),十足目(Decapoda),梭子蟹科(Portunidae),梭子蟹属(Portunus),广泛分布于中国、韩国、日本等河口和沿海水域,是我国重要的海水养殖种类。近些年,梭子蟹养殖产业发展迅速,2018年养殖产量已达11.38×104t[19]。然而,由于对三疣梭子蟹生殖调控的认知不足,未能建立起高效的生殖调控技术,高质量苗种的产量无法满足需求,严重限制了养殖产业的可持续发展。因此,亟需深入开展三疣梭子蟹生殖调控机理研究。本研究克隆了三疣梭子蟹foxl2(Ptfoxl2)基因的cDNA全长序列;分析了其在不同组织、不同发育时期以及切除眼柄后的表达模式;研究了干扰该基因表达对vtg基因表达的影响;预测了靶向foxl2的miRNA,并在细胞水平进行了验证;分析了miRNA在不同发育时期以及切除眼柄后的表达特征。研究结果有助于深入理解三疣梭子蟹生殖调控机制,为研发生殖调控新技术提供参考。
2 材料与方法
2.1 实验材料
实验所用三疣梭子蟹取自山东省昌邑市海丰水产养殖有限责任公司昌邑实验基地。选取附肢完整且无明显伤痕的雌性三疣梭子蟹,体重为52~261 g。在实验室条件下暂养7 d。水温为(20±2)℃、盐度为31±1、pH为7.6±0.3,持续充氧。每天17:00投喂鲜活菲律宾蛤仔,8:00清除箱底排泄物及食物残渣后更换1/3~1/2等温度的新鲜海水。
2.2 Ptfoxl2 cDNA全长克隆
根据三疣梭子蟹性腺转录组数据中foxl2基因片段序列[20],使用Primer 5.0软件设计foxl23′和5′特异性引物(表1)。利用Trizol试剂提取三疣梭子蟹组织总RNA,采用Nanodrop微量分光光度计和琼脂糖凝胶电泳检测RNA质量以及完整性。按照SMART RACE Amplification Kits说明书,利用cDNA 末端快速扩增(Rapid Amplification of cDNA Ends,RACE)所需的cDNA模板,使用Advantage 2 PCR Kit进行3′和5′末端扩增。PCR产物经琼脂糖凝胶电泳、凝胶回收试剂盒得到扩增的目的片段,用pMD18-T载体连接所得目的片段,并转入DH5α感受态细胞中,涂板过夜培养,菌落检测后进行测序分析。

表1 实验所用引物的序列Table 1 The sequences of the primers used in this study
2.3 序列分析及系统进化分析
利用VecScreen(http://www.ncbi.nlm.nih.gov/tools/vecscreen/)去除载体序列,由Contig express软件进行序 列 拼 接、ORFFinder(https://www.ncbi.nlm. nih.gov/orffinder/)进行开放阅读框(Open Reading Frame,ORF)预测及氨基酸翻译。利用ExPASy(http://web.expasy.org/compute_pi/)进行分子量及等电点的预测,利用Interpro Scan(http://www.ebi.ac.uk/interpro/scan.html)进行蛋白质功能结构域分析。使用Bioedit软件对三疣梭子蟹foxl2氨基酸序列与从GenBank中下载的其他物种的foxl2氨基酸序列进行比对。
2.4 Ptfoxl2基因的表达分析
2020年9月至2021年1月,收集三疣梭子蟹卵巢发育不同时期的样本。将梭子蟹在实验室条件下暂养7 d。将样本卵巢组织分为两份,一份保存于液氮中,另一份采用4%多聚甲醛固定。参考吴旭干等[21]对卵巢组织分期方法,在显微镜下观察三疣梭子蟹样品的组织学特征,并将卵巢分为5个时期。
根据三疣梭子蟹foxl2序列设计特异性引物(表1),参照AG SYBR Green Pro Taq HS qPCR试剂盒说明书对三疣梭子蟹不同组织、不同发育时期foxl2基因相对表达量进行分析。反应体系(20 μL):10 μL SYBR Green Pro Taq HS Premix II (2×)、0.4 μL ROX Reference Dye II、0.8 μL 10 μmol/L的 正 反 向 引 物、6.0 μL DEPC水和2.0 μL cDNA稀释液。反应程序:95℃ 30 s;95℃ 5 s、60℃ 34 s,40个循环。foxl2相对表达量采用2-ΔΔCt法进行计算。
2.5 切除眼柄实验
实验选用处于卵巢III-IV期三疣梭子蟹雌蟹为实验动物,切除眼柄方法采用烧红镊子紧捏眼柄基部3 s。将切除双侧眼柄后的三疣梭子蟹养殖于室内循环水系统,为防止其打斗,每个10 L的养殖缸内仅放置1只梭子蟹。切除眼柄后1 d、3 d、6 d分别取3只三疣梭子蟹,解剖收集卵巢组织,样品均在液氮中速冻,并保存于-80℃超低温冰箱用于后续基因表达分析。
2.6 RNA干扰实验
采用New England Biolabs公司的HiScribe T7 High Yield RNA Synthesis试剂盒合成RNA干扰实验(RNA interference,RNAi)所需的Ptfoxl2dsRNA,所用引物序列见表1。该实验以处于卵巢快速发育期(III-IV期)的雌蟹(体重为(206.7±5.8)g)为实验动物,以注射绿色荧光蛋白(GFP)dsRNA的个体为对照组,以注射Ptfoxl2dsRNA的个体为干扰组。GFP dsRNA和Ptfoxl2dsRNA的注射剂量均为2 μg/g体重,注射部位为第三步足基部。注射24 h和48 h后,对照组和干扰组分别取3个个体,解剖收集卵巢组织,液氮速冻,保存于-80℃超低温冰箱用于后续基因表达分析。
2.7 Ptfoxl2相关miRNA预测和验证
通过miRanda和RNAhybrid软件预测潜在靶向Ptfoxl23′UTR区域的miRNA。通过双荧光素酶报告基因检测实验,对预测miRNA对Ptfoxl2的调控作用进行验证。将miRNA类似物和阴性对照类似物(由通用生物股份有限公司合成),与包含有野生型和突变型miRNA结合位点3′UTR序列的pmirGLO质粒,分别共转染到293T细胞中。转染48 h后,使用Dual-Luciferase Reporter Assay System(Promega)测定萤火虫荧光素酶和海肾荧光素酶活性相对值。
2.8 Ptfoxl2相关miRNA的表达分析
利用miRcute miRNA提取分离试剂盒(天根生化科技有限公司)提取三疣梭子蟹不同组织、不同发育时期及切除眼柄后卵巢组织的miRNA,使用miRcute增强型miRNA cDNA第一链合成试剂盒(天根生化科技有限公司)进行反转录,采用miRcute增强型miRNA荧光定量检测试剂盒(天根生化科技有限公司)检测miRNA在三疣梭子蟹不同组织、不同时期以及切除眼柄后的相对表达量。反应体系(20 μL):10 μL 2×miRcute Plus miRNA PreMix、0.4 μL正 反 向引物、2.0 μL miRNA第一链 cDNA、7.2 μL ddH2O。反应程序:95℃ 15 s;95℃ 20 s、60℃ 34 s,40个循环。反应完成后相对表达量采用2-ΔΔCt法计算。
2.9 统计学分析
采用SPSS19.0软件进行数据统计分析。两组之间比较应用独立样本t检验,多组之间比较应用单因素方差分析。以p<0.05为差异有统计学意义。
3 结果与分析
3.1 Ptfoxl2基因cDNA全长序列分析和系统进化分析
序列分析表明,Ptfoxl2基因cDNA全长2 502 bp(OK413951),3′端和5′端基因片段长度分别为211 bp和701 bp,包含1 590 bp的开放阅读框,共编码529个氨基酸(图1)。在线分析发现,Ptfoxl2基因包含1个Forkhead结构域(228~323 aa)。通过BLAST同源性比对分析,发现三疣梭子蟹Ptfoxl2氨基酸序列与拟穴青蟹Ptfoxl2的同源性最高,为96%;与中华绒螯蟹、斑节对虾(Penaeus monodon)的同源性分别为86%、85%,且都含有Forkhead结构域(图2)。

图1 Ptfoxl2基因cDNA全长序列以及推导的氨基酸序列Fig. 1 Nucleotide sequence and deduced amino acid sequence of Ptfoxl2 gene
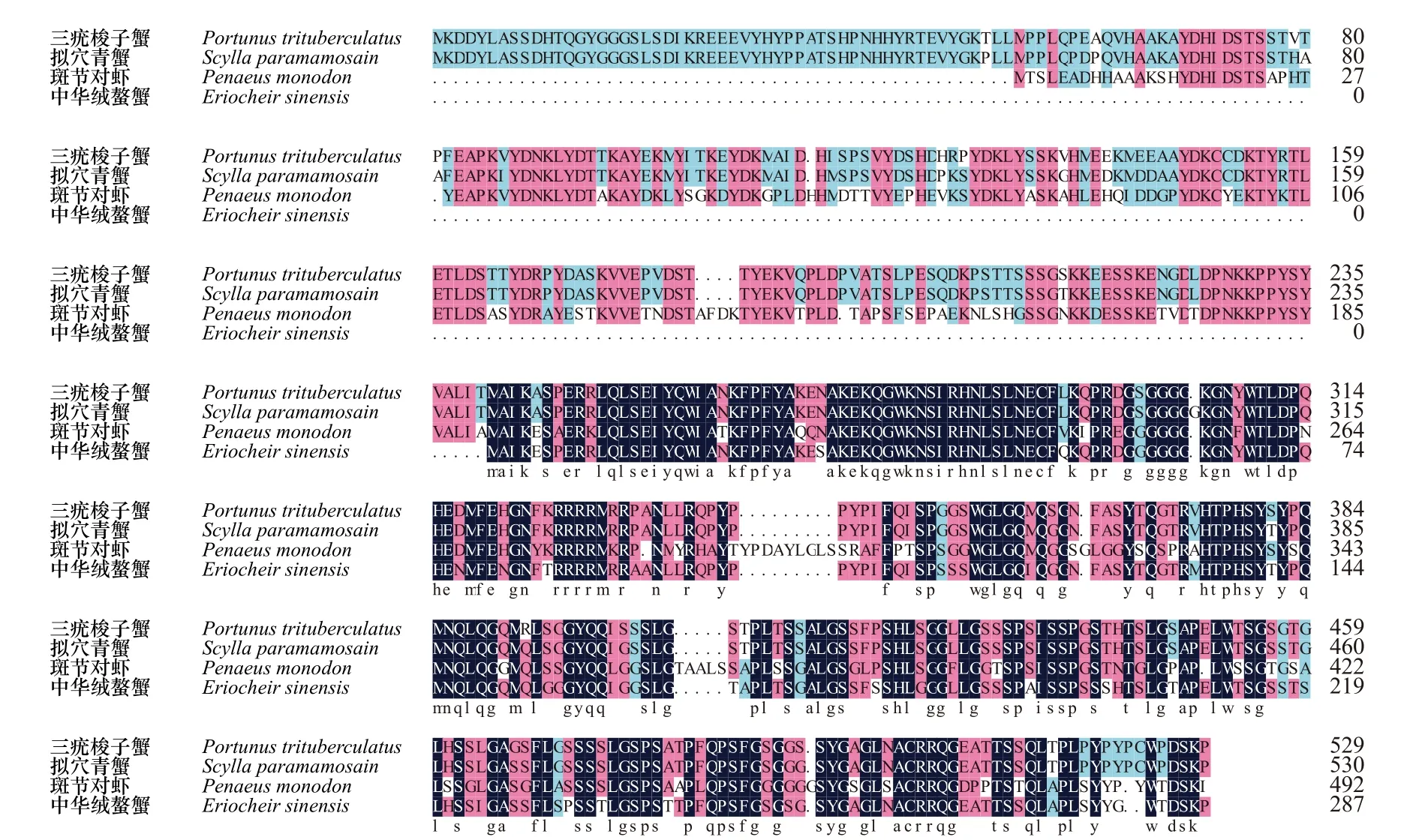
图2 4种甲壳动物foxl2氨基酸序列多重比对Fig. 2 Multiple alignments of the amino acid sequences of foxl2 in four crustacean species
3.2 Ptfoxl2基因表达分析结果
利用Real-time PCR技术,分析了foxl2基因在三疣梭子蟹不同组织的表达分布特征。结果显示,Ptfoxl2在所有被测组织中均有表达,其在卵巢组织中的表达量最高(p<0.05),其次为脑神经节、肝胰腺、胃、胸神经节等组织,在血淋巴中的表达量最低(图3A)。通过对Ptfoxl2在卵巢发育不同时期的表达分析发现,该基因在不同时期的表达存在显著差异(p<0.05),其在V期卵巢组织表达量最高,其次为III期、IV期,在II期卵巢中表达量最低(图3B)。切除眼柄后Ptfoxl2表达分析结果表明,切除眼柄后第1天、第3天、第6天,该基因在卵巢组织的表达量均显著下降(p<0.05)(图3C)。
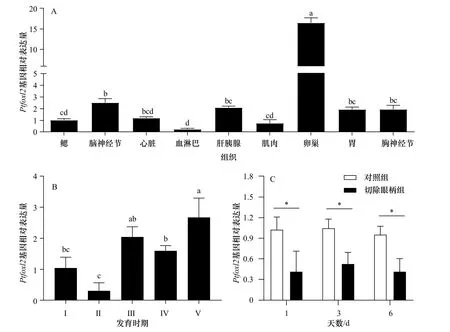
图3 Ptfoxl2基因在三疣梭子蟹不同组织(A)、不同卵巢发育时期(B)以及切除眼柄后(C)的表达Fig. 3 The expression of Ptfoxl2 in different tissues (A), in different ovarian developmental stages (B) and after eyestalk ablation (C)
3.3 Ptfoxl2干扰实验结果
与注射GFP dsRNA组三疣梭子蟹相比,注射Ptfoxl2dsRNA的个体在24 h和48 h后,卵巢Ptfoxl2的表达均出现了显著下调(p<0.05)(图4A),干扰效率分别为60.24%和53.15%。qRT-PCR结果显示,注射Ptfoxl2dsRNA组vtg基因的表达显著上调(p<0.05)(图4B)。
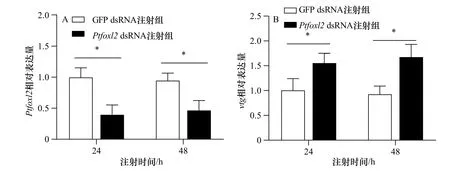
图4 注射Ptfoxl2 dsRNA 和GFP dsRNA后卵巢Ptfoxl2(A)和vtg(B)基因的表达Fig. 4 Relative expression of Ptfoxl2 (A) and vtg (B) in ovary after injecting Ptfoxl2 dsRNA and GFP dsRNA
3.4 Ptfoxl2相关miRNA的预测和双荧光素酶报告基因检测实验验证
生物信息学预测结果显示,miR-9以及本实验在前期研究中新识别到的2个miRNA—novel-52和novel-68可能与Ptfoxl23′UTR结合。通过双荧光素酶报告基因检测实验,对miRNA与Ptfoxl2靶向调控作用进行了验证(图5)。结果显示,共转染novel-52类似物和pmirGLO-Ptfoxl2-3′UTR组以及共转染novel-68类似物和pmirGLO-Ptfoxl2-3′UTR组萤火虫相对荧光素酶活性未出现显著变化(p>0.05),而共转染miR-9类似物和pmirGLO-Ptfoxl2-3′UTR组萤火虫荧光素酶和海肾荧光素酶活性比值显著降低(p<0.05),表明miR-9能够与Ptfoxl2基因3′UTR靶向结合。
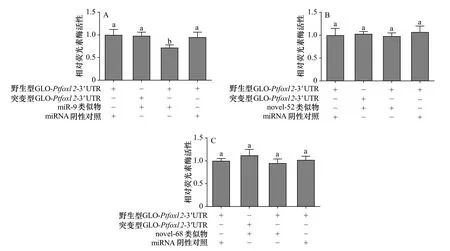
图5 共转染野生型和突变型质粒和miRNA类似物后荧光素酶的相对活性Fig. 5 Luciferase activity of the reporter plasmid containing wild-type or mutant target site after co-transfection of plasmid and miRNA mimics
3.5 Ptfoxl2相关miRNA的表达分析结果
组织表达分布结果显示,miR-9在三疣梭子蟹各组织中均有表达,其在鳃、卵巢和胃中的表达量显著高于其他组织(p<0.05),其次为肌肉、胸神经节,脑神经节中的表达量最低(图6A)。miR-9在不同发育时期卵巢组织中的表达量存在显著差异(p<0.05),随着卵巢发育其表达量先上升后下降,在IV期达到最高,在V期表达量出现显著降低(图6B)。切除眼柄后,卵巢组织中miR-9的表达量出现显著变化(p<0.05),在第1天表达量出现显著上调,在第3天达到最高值,在第6天开始降低(图6C)。

图6 miR-9在三疣梭子蟹不同组织(A)、不同卵巢发育时期(B)以及切除眼柄后(C)的表达Fig. 6 The expression of miR-9 in different tissues (A), in different ovarian developmental stages (B) and after eyestalk ablation (C)
4 讨论
本研究克隆了三疣梭子蟹foxl2基因cDNA全长序列,预测氨基酸序列包含1个高度保守的Forkhead结构域和1个核定位信号序列。同源性分析显示,Ptfoxl2与其他蟹类foxl2序列具有较高的同源性,其中与拟穴青蟹同源性高达96%,提示Ptfoxl2可能与拟穴青蟹foxl2(Spfoxl2)功能具有相似性。但是,Ptfoxl2与Spfoxl2组织表达分布存在差异[18]。虽然Ptfoxl2与Spfoxl2都在卵巢组织中高表达,但Ptfoxl2在所检测的组织中均有表达,而Spfoxl2仅在卵巢、精巢和肝胰腺中表达,表明Ptfoxl2的功能可能具有多效性。
大量研究发现,foxl2在脊椎动物卵巢颗粒细胞分化、卵巢发育和功能维持等方面具有重要作用。目前,foxl2基因序列已在数种无脊椎动物中克隆获得,但针对其功能的研究却鲜有报道。Liu等[22]发现,foxl2在栉孔扇贝中的表达呈明显的性别二态性,在卵巢中的表达远高于精巢,推测该基因在卵巢发育中发挥作用。Wei等[23]发现,海湾扇贝幼贝中foxl2的表达与雌激素的水平呈正相关,推测该基因通过调控雌激素水平,进而调节性腺分化过程。在对中华绒螯蟹的研究发现,foxl2在卵巢成熟期表达量显著上调,与DDX20和FTZ-F1结合,抑制卵巢中vtg基因的表达。在不同组织中的表达分析结果显示,Ptfoxl2在卵巢组织中的表达量最高,显著高于其他组织,暗示其可能参与了三疣梭子蟹卵巢发育调控过程。该基因在卵巢发育过程中的表达模式与中华绒螯蟹相似,同样在卵巢近成熟期和成熟期表达量显著升高。该时期卵黄发生以外源性卵黄合成为主,即在肝胰腺内合成,通过血淋巴转运到卵巢组织,而卵巢内的卵黄合成减少。此外,干扰Ptfoxl2表达后,卵巢组织vtg基因的表达显著上调,这与拟穴青蟹foxl2干扰实验结果一致[18]。上述结果表明,foxl2可能在三疣梭子蟹卵巢发育中发挥重要作用,能够显著抑制内源性卵黄合成。
迄今,关于甲壳动物foxl2表达调控的研究还未见报道。切除眼柄是生产中常用的刺激甲壳类性腺成熟的方法,此方法通常认为是通过去除眼柄中X-器官窦腺复合体分泌的性腺抑制激素(GIH)来刺激性腺成熟,但是切除眼柄会损伤亲体,且会造成卵质量下降、孵化率降低等问题[24]。近些年,为了探寻替代眼柄切除的促熟新方法,国内外研究者针对切除眼柄诱导性腺发育的分子机制开展了较为深入的研究。已有研究表明,切除眼柄诱导卵巢成熟是一个涉及多种分子和信号通路的复杂过程。Uawisetwathana等[25]发现,切除斑节对虾眼柄能够激活性腺激素释放激素信号通路、孕酮介导的卵母细胞成熟等信号通路。本实验室前期研究发现,切除眼柄后,三疣梭子蟹Cdk7、Cyclin H等基因表达均出现显著上调,表明切除眼柄能够激活成熟促进因子(Maturation-Promoting Factor,MPF),从而促进卵母细胞成熟分裂[26-27]。此外,切除眼柄会促进三疣梭子蟹甲基法尼酯合成相关蛋白的表达,激活钙离子信号通路[28]。本研究中,三疣梭子蟹卵巢foxl2基因的表达在切除眼柄后第1天、第3天、第6天均出现了显著下调。因此,我们推测Ptfoxl2受眼柄神经内分泌因子的调控,参与了切除眼柄诱导卵巢成熟的过程。切除眼柄能够抑制foxl2的表达,进而促进卵黄合成。
近些年,miRNA已被证实在甲壳动物卵巢发育中发挥重要作用。Song等[29]发现,miR-2和miR-133通过调控Cyclin B的表达,控制中华绒螯蟹卵母细胞成熟过程。Jia等[30]对拟穴青蟹的研究表明,miR-277参与眼柄中卵巢发育相关重要神经肽—卵黄抑制激素的表达调控。目前,miRNA是否参与了甲壳动物foxl2基因的表达调控仍未知。本研究利用生物信息学方法预测了其靶基因,并通过双荧光素酶报告基因检测实验,从细胞水平进行了验证。结果显示,miR-9能够与Ptfoxl23′UTR靶向结合。分析显示,miR-9在鳃、肝胰腺组织和胃中表达量较高,但在这3个组织间无显著差异,表明miR-9可能具有多种功能。同一miRNA可能调控多个靶基因,其在不同组织中可能也发挥不同的作用[31]。在卵巢V期(成熟期),miR-9表达量显著下调,而Ptfoxl2表达则显著上调。此外,切除眼柄后,卵巢miR-9的表达显著出现上调,而Ptfoxl2表达趋势与之相反,进一步表明,miR-9能够从转录后水平调控Ptfoxl2的表达。
5 结论
本研究克隆得到Ptfoxl2基因cDNA全长序列,分析了该基因在不同组织、不同发育时期卵巢组织以及切除眼柄后的表达模式,研究了干扰其表达对卵巢组织vtg基因表达的影响,初步证实Ptfoxl2参与三疣梭子蟹卵巢发育调控,能够抑制内源性卵黄合成。预测了靶向Ptfoxl2的miRNA,并在细胞水平进行了验证。结合miR-9在卵巢发育不同时期以及切除眼柄后的表达分析,首次证实miRNA(miR-9)能够从转录后水平调控Ptfoxl2的表达。研究结果为深入开展三疣梭子蟹卵巢发育调控机制,研发生殖调控新技术提供了重要参考。

