CYP2C19、GPIa、ABCB1基因检测在伴发糖尿病的卒中患者抗血小板治疗作用
冯艳 袁丽品 祁亚伟 李学
缺血性脑卒中属于脑血管疾病,多由遗传或环境因素影响,其主要因缺血缺氧引起脑组织性坏死产生病变,常与脂质沉积、过氧化造成的动脉粥样硬化有关,对神经功能产生一定的破坏作用[1⁃2]。该类患者病情较为复杂,主要临床症状为头晕、吐字不清、四肢麻木等[3]。以往研究表明,缺血性脑卒中患者多伴有糖尿病,且糖尿病患者引发脑梗死的风险是正常患者的2~4 倍,患者往往预后不佳,当患者血糖水平上升之后,脑组织神经损伤加剧,从而影响其认知功能[4⁃5]。阿司匹林与氯吡格雷为抗血小板治疗的常用药物,能够有效降低缺血性脑卒中患者的复发,但部分患者存在阿司匹林不耐受的情况,此时多应用氯吡格雷治疗,其疗效明显且发生不良反应的概率较少,受到临床的推崇[6⁃7]。但有些患者使用氯吡格雷之后发现无抗血小板的变化,这种情况叫做氯吡格雷抵抗现象,因改善效果不明显会引起缺血性事件的发生,但目前关于其发生的机制尚未明确,主要与遗传学因素及非遗传性因素相关,其中遗传因素包括基因多态性[8]。CYP2C19、GPIa、ABCB1基因均被证实与氯吡格雷代谢异常有关,目前,关于探究人细胞色素P450 酶等位基因(CYP2C19)基因型与该类患者抗血小板治疗效果的研究存在[9],但血小板膜糖蛋白Ia(Platelet Membrane Glycoprotein Ia,GPIa)、多药耐药性蛋白(ATP⁃binding cassette sub⁃family B member 1,ABCB1)基因检测与抗血小板疗效的研究稀少。本研究通过临床资料分析,旨在为指导伴发糖尿病的缺血性脑卒中患者使用氯吡格雷个体化用药提供科学依据。报告如下。
1 资料与方法
1.1 一般资料
将河南省人民医院神经内科2019年2月至2021年1月收治的108 例伴发糖尿病的卒中患者作为研究对象,其中男性65 例、女性43 例,平均年龄(60.38±3.97)岁,42 例有吸烟史,21 例有饮酒史。纳入标准:①脑卒中标准参考全国第五届脑血管病学术会议制定的标准[10],糖尿病依据WHO标准(1999)诊断;②经影像学确诊;③脑出血、脑梗死后未发生出血现象;④临床资料完整;⑤符合《赫尔辛基宣言》的伦理审查标准;⑥既往无相关用药史。排除标准:①合并严重的肾、肝疾病;②合并脑部肿瘤及其他恶性肿瘤;③合并神经系统相关疾病;④合并凝血功能异常;⑤合并脑部静脉血栓;⑥使用其他影响本研究药物效果的治疗。所有患者或其家属均知情且签署同意书。
1.2 方法
1.2.1 检测基因型
通过聚合酶链式反应技术检测患者CYP2C19、GPIa、ABCB1基因型,利用基因检测试剂盒(勇石生物科技(重庆)有限公司)并采用荧光探针法检测基因突变位点,通过荧光标记的表达进行基因型的判别。CYP2C19基因位点:①*1/*1(636GG,681GG);②*1/*2(636GG,681GA);③*1/3(636GA,681GG);④*2/*2(636GG,681AA);⑤*2/*3(636GA,681GA)⑥*3/*3(636AA,681GG)。依据基因位点分为慢代谢型(④⑤⑥)、中代谢型(②③)与快代谢型(①),见图1。GPIa基因位点为A1166C,依据基因位点分为TC 型与CC 型。ABCB1基因位点为C3435T,依据基因位点分为野生型与突变型。依据CYP2C19、GPIa、ABCB1基因的突变数量分为A 组(未出现基因突变)、B 组(存在至少一个基因突变)与C 组(所有基因均发生突变)。
图1 CYP2C19 基因图Figure 1 CYP2C19 gene map
1.2.2 TEG 检测
TEG 采用健朗JLY6000(国产)血栓弹力图仪(安徽健朗医疗器械有限公司,皖械注准20212220046)及配套试剂检测患者血小板纤维蛋白凝块强度,通过花生四烯酸(AA)、二磷酸腺苷(ADP)通道作用于阿司匹林及氯吡格雷。首先采用高岭土对凝血酶进行激活,而后通过该通道表现患者血小板纤维蛋白凝块功能(MA凝血酶)。AA/ADP 激活剂能够激活未受到药物抑制的血小板、纤维蛋白,得到未受药物影响的血小板及纤维蛋白功能(MAADP(AA))。因A 激活剂单纯激活纤维蛋白故得到纤维蛋白原功能(MA纤维蛋白原)。以上三个值用于评价患者药物使用后抑制率。抗血小板药物抑制率=ADP(AA)抑制率=[MA凝血酶-MAADP(AA)]/(MA凝血酶-MA纤维蛋白原)×100%。
1.2.3 神经功能检测
采用美国国立卫生研究院卒中量表(NIH Stroke Scale,NIHSS)[11]及改良Rankin 评分(Modi⁃fied Rankin Scale,mRS)表[12]对患者神经功能缺损情况及预后进行评分。①NIHSS 量表评价方式:采用NIHSS 量表评估患者神经功能,总分0~42 分,0~1 分代表正常或接近正常;1~4 分代表轻度卒中;5~15 分代表中度卒中;16~20 分代表中/重度卒中;21~42 分代表重度卒中。②mRS 量表评价方式:患者状况分为:0 级:无症状;1 级:有症状,但无明显功能障碍,不影响日常生活和工作;2 级:轻度残疾,无法完成病前一切活动,能独立行走;3 级:中度残疾,日常生活需一定帮助,能独立行走;4 级:中重度残疾,无法独立行走,日常生活需帮助;5 级:重度残疾,卧床,大小便失禁,日常生活完全依赖他人。
1.3 统计学处理
采用SPSS 22.0 统计软件进行数据分析,计数资料用n(%)表示,进行χ2检验;计量资料用(±s)表示,行t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 CYP2C19、GPIa、ABCB1 不同基因型检测情况
基因检测结果显示,按照CYP2C19基因型对108 例患者进行分组,其中慢代谢型、中代谢型及快代谢型患者分别有18、48、42 例;按照GPIa基因型分组,其中TC 型48 例、CC 型60 例;按照ABCB1基因型分组,其中野生型39 例、突变型69 例。见图2。
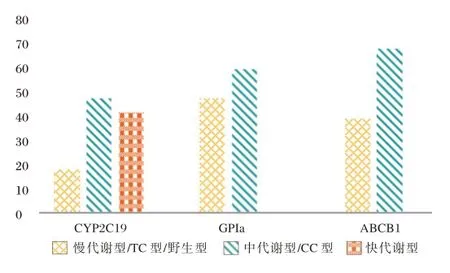
图2 CYP2C19、GPIa、ABCB1 不同基因型检测情况Figure 2 The detection of different genotypes of CYP2C19,GPIa,ABCB1
2.2 不同基因型患者抗血小板药物抑制率、MAADP、神经功能水平情况比较
不同CYP2C19、GPIa、ABCB1基因型患者抗血小板药物抑制率、MAADP、神经功能水平的差异无统计学意义(P>0.05)。见表1。
表1 不同基因型患者抗血小板药物抑制率、MAADP、神经功能水平情况比较[n(%),(±s)]Table 1 Comparison of antiplatelet drug inhibition rate,MAADP and neurological function level in patients with different genotypes 结果[n(%),(±s)]
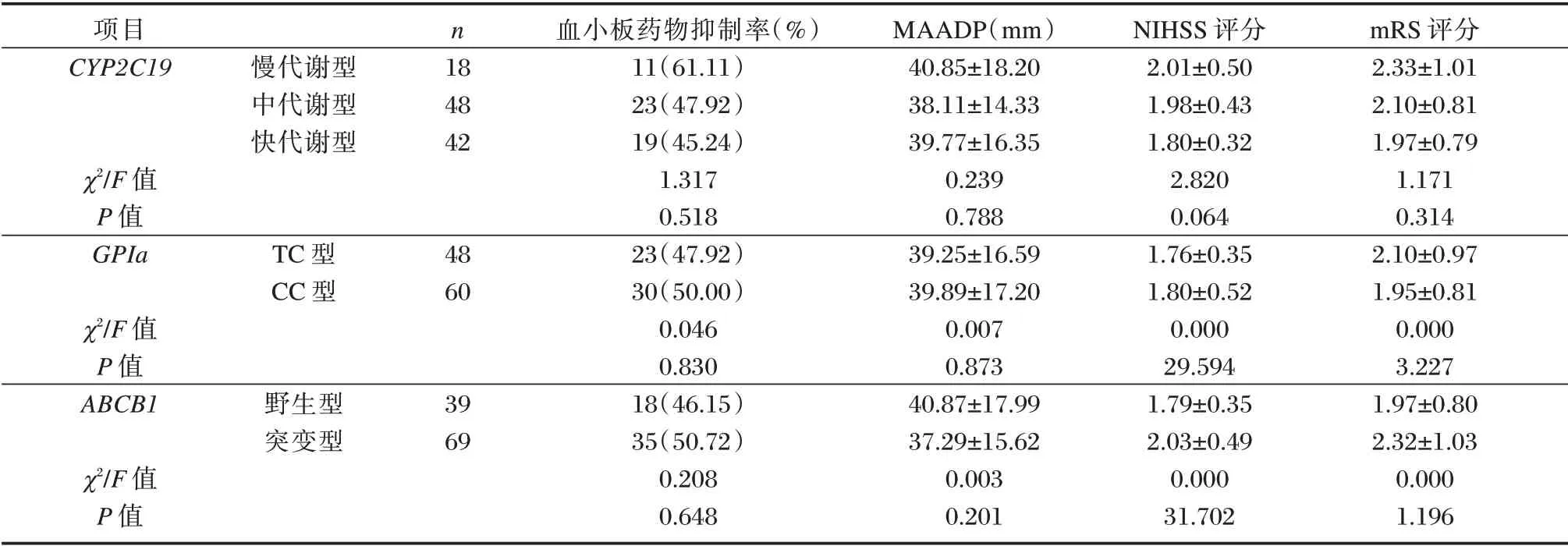
表1 不同基因型患者抗血小板药物抑制率、MAADP、神经功能水平情况比较[n(%),(±s)]Table 1 Comparison of antiplatelet drug inhibition rate,MAADP and neurological function level in patients with different genotypes 结果[n(%),(±s)]
项目CYP2C19 χ2/F 值P 值GPIa χ2/F 值P 值ABCB1 χ2/F 值P 值慢代谢型中代谢型快代谢型TC 型CC 型野生型突变型n 18 48 42 48 60 39 69血小板药物抑制率(%)11(61.11)23(47.92)19(45.24)1.317 0.518 23(47.92)30(50.00)0.046 0.830 18(46.15)35(50.72)0.208 0.648 MAADP(mm)40.85±18.20 38.11±14.33 39.77±16.35 0.239 0.788 39.25±16.59 39.89±17.20 0.007 0.873 40.87±17.99 37.29±15.62 0.003 0.201 NIHSS 评分2.01±0.50 1.98±0.43 1.80±0.32 2.820 0.064 1.76±0.35 1.80±0.52 0.000 29.594 1.79±0.35 2.03±0.49 0.000 31.702 mRS 评分2.33±1.01 2.10±0.81 1.97±0.79 1.171 0.314 2.10±0.97 1.95±0.81 0.000 3.227 1.97±0.80 2.32±1.03 0.000 1.196
2.3 不同突变基因数量患者分组情况
依据患者检测的基因突变数量将其分为A、B、C 组,其中A 组19 例、B 组48 例、C 组41 例。见图3。
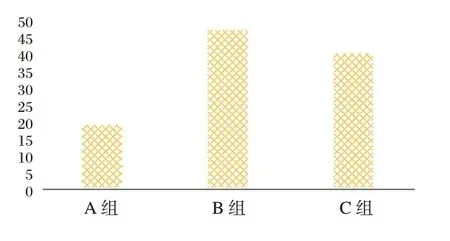
图3 不同突变基因数量患者分组情况Figure 3 Grouping of patients with different numbers of mutant genes
2.4 不同突变基因数量患者抗血小板药物抑制率、MAADP、神经功能水平情况比较
不同突变基因数量患者抗血小板药物抑制率、MAADP、神经功能水平的差异无统计学意义(P>0.05)。见表2。
表2 不同组别抗血小板药物抑制率、MAADP、神经功能水平[n(%),(±s)]Table 2 Antiplatelet drug inhibition rate,MAADP,neurological function in different groups[n(%),(±s)]
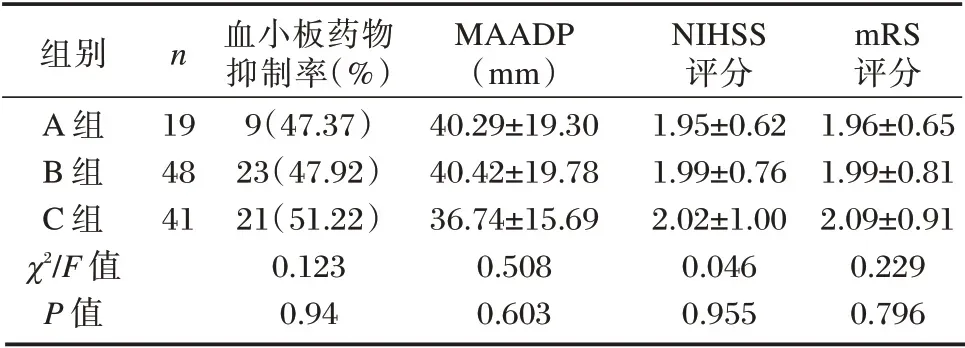
表2 不同组别抗血小板药物抑制率、MAADP、神经功能水平[n(%),(±s)]Table 2 Antiplatelet drug inhibition rate,MAADP,neurological function in different groups[n(%),(±s)]
组别A 组B 组C 组χ2/F 值P 值n 19 48 41血小板药物抑制率(%)9(47.37)23(47.92)21(51.22)0.123 0.94 MAADP(mm)40.29±19.30 40.42±19.78 36.74±15.69 0.508 0.603 NIHSS评分1.95±0.62 1.99±0.76 2.02±1.00 0.046 0.955 mRS评分1.96±0.65 1.99±0.81 2.09±0.91 0.229 0.796
3 讨论
缺血性脑卒中是我国脑卒中一种主要的亚型,现已成为影响我国老年人的重要健康问题。氯吡格雷作为噻吩吡啶类抗血小板治疗的主要药物,能够有效降低缺血性脑卒中患者的发生概率,但不同的患者个人机体情况不一致,导致氯吡格雷的效果不同。氯吡格雷抵抗指的是使用药物之后产生低反应或未发生反应,5%以上的患者易出现药物抵抗,而药物抵抗与缺血性脑卒中的复发有关。CYP2C19、GPIa、ABCB1是氯吡格雷代谢异常的相关基因,其中CYP2C19基因突变经证实与药物生物转化酶的活性程度有关[13],GPIa 基因突变与血小板聚集有关[14],ABCB1基因突变与药物引起的肠道吸收水平下降有关[15],以上三者的变化均与氯吡格雷治疗后血小板功能及神经功能密切相关,因此,与氯吡格雷代谢有关的基因多态性受到关注。国外一项研究表明[16],急性冠脉综合征患者采用阿司匹林结合氯吡格雷治疗后,1年随访结果显示,CYP2C19同工酶与氯吡格雷生物学活性相关性密切,是其关键的代谢酶之一,且CYP2C19的活性与其基因的多态性有关,研究发现CYP2C19的基因型的差异并不会影响患者预后的情况,这与本研究结果一致,本研究结果表明,不同CYP2C19基因型患者的抗血小板药物抑制率、MAADP、神经功能的差异不显著,这可能是由于氯吡格雷能够有效发挥抗血小板的作用,且不需要依赖CYP2C19 系统转化成为活性代谢物,故该药物的治疗效果与CYP2C19基因型的差异无关。GPIa 是一种重要的胶原蛋白受体,其对血小板活化具有一定的影响,当GPIa 与胶原相结合之后会导致患者产生血栓,以往研究显示GPIa 携带807T 等位基因或与患者动脉粥样硬化相关,本研究结果提示其不同的基因型对氯吡格雷的疗效无影响,但其具体作用机制目前尚未明确。李笑笑等[17]研究结果显示,ABCB1基因多态性对急性动脉粥样硬化脑梗死患者氯吡格雷疗效无影响,此结论亦与本研究结果相似,本研究中得出,不同的ABCB1基因型亦不会对氯吡格雷疗效产生影响,这可能是因为:对氯吡格雷药物代谢产生影响的因素多且复杂,临床对于其并未了解透彻,可能还有众多尚未发现的关键因素其作用,另外,评价血小板功能的方式繁杂,每种方式的检测机制和影响因素也不一样,故可能导致研究的结果不一致,本研究虽表现不同基因型的CYP2C19、GPIa、ABCB1对氯吡格雷疗效、神经功能影响差异不显著,但缺乏对患者的长期跟踪研究,关于其远期效果还有待进一步研究。
综上所述,对于采用氯吡格雷治疗的伴发糖尿病的缺血性脑卒中患者而言,不同CYP2C19、GPIa与ABCB1基因型之间的血小板抑制率及神经功能水平差异无显著性,但关于其长期影响还需进一步探究。另外,本研究存在一些不足之处,例如只是单中心的回顾性分析,缺乏一些实验的设计性与前瞻性,在今后的研究中将会进一步改进,使研究结果更具有说服力。

