局部应用氨甲环酸对股骨转子间骨折PFNA-Ⅱ内固定术围术期失血影响的临床研究*
周述清,叶 健△,杨博文,张孝华,秦贵勇,王成光
1.重庆市江津区中心医院骨二科,重庆 402260;2.重庆市合川区人民医院骨科,重庆 401520
随着人口老龄化的加剧,老年髋部骨折的发病率逐年上升,其中30%~50%为股骨转子间骨折(ITF),研究显示伤后1个月内的病死率为8.7%~13.3%,伤后12个月内的死亡率为14%~36%[1-2]。ITF高死亡率的主要原因在于坠积性肺炎、下肢深静脉血栓(DVT)、褥疮等卧床并发症[2-3]。亚洲型股骨近端防旋髓内钉(PFNA-Ⅱ)内固定因其更适合亚洲人群,已成为我国此类骨折治疗的主要手术方式[4],但术后隐性失血量大。在快速康复(ERAS)理念指导下,采用多模式联合血液管理方法能有效减少围术期失血量[5-7]。应用氨甲环酸(TXA)可减少术后隐性失血,降低输血率,且不增加DVT发生风险[8],有学者将其用于髋部骨折手术,通过静脉或局部应用TXA在减少PFNA-Ⅱ术后出血方面显示了良好的效果和安全性[9]。本研究探讨了局部应用TXA对ITF术中、术后失血的影响,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2017年10月至2019年6月重庆市江津区中心医院行PFNA-Ⅱ内固定治疗的102例老年ITF患者为研究对象,其中男36例,女66例;年龄66~97岁,平均(77.9±10.3)岁。纳入标准:(1)经影像学检查确诊为单侧股骨转子间闭合性骨折;(2)伤前有完全行走能力;(3)无股骨头坏死等髋部疾病及髋部手术史。排除标准:(1)陈旧性骨折;(2)伴有严重的凝血功能障碍,或伴有其他血液系统疾病;(3)近期或正在使用抗凝药物如华法林等;(4)有支架植入、房颤、血栓病史;(5)有严重精神疾病或长期卧床。按照随机数字表法将102例患者分为观察组与对照组,每组51例。两组患者在性别构成、年龄、体质量指数(BMI)、受伤原因、术前血红蛋白(Hb)、术前血细胞比容(Hct)、术前凝血酶原时间、活化部分凝血酶原时间、纤维蛋白原、术前双下肢血管B超、受伤至手术时间等方面比较,差异无统计学意义(P>0.05),见表1。患者或家属均签署知情同意书。本研究获重庆市江津区中心医院医学伦理委员会批准。
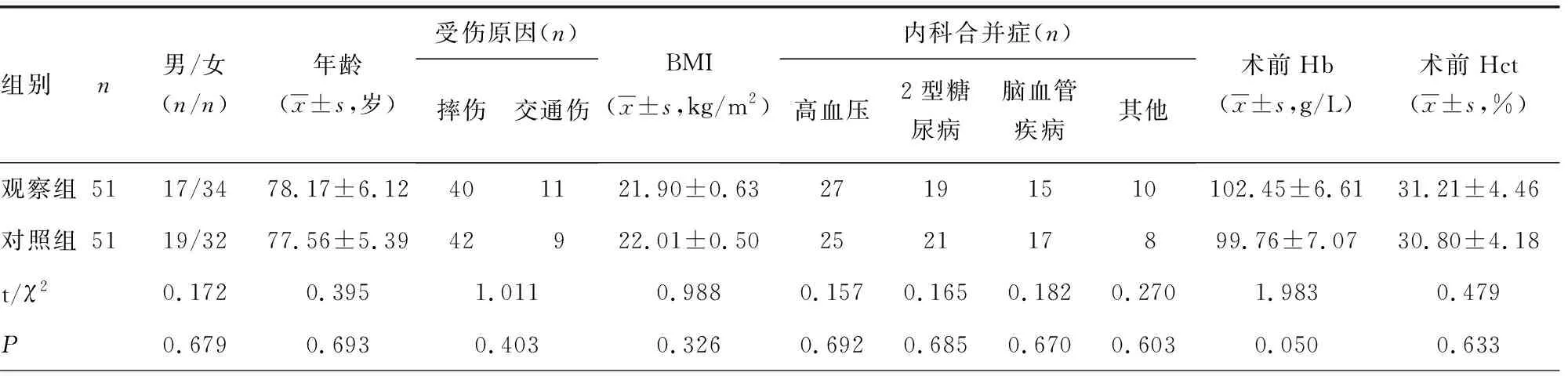
表1 两组患者一般资料比较
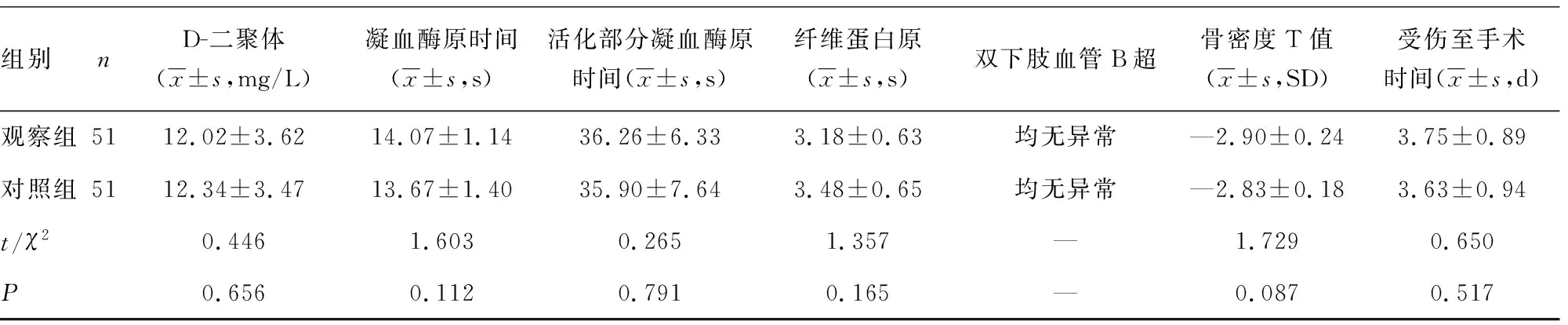
组别nD-二聚体(x±s,mg/L)凝血酶原时间(x±s,s)活化部分凝血酶原时间(x±s,s)纤维蛋白原(x±s,s)双下肢血管B超骨密度T值(x±s,SD)受伤至手术时间(x±s,d)观察组5112.02±3.6214.07±1.1436.26±6.333.18±0.63均无异常—2.90±0.243.75±0.89对照组5112.34±3.4713.67±1.4035.90±7.643.48±0.65均无异常—2.83±0.183.63±0.94t/χ2 0.4461.6030.2651.357—1.7290.650P0.6560.1120.7910.165—0.0870.517
1.2治疗方法 入院后患肢行皮肤牵引,常规进行患髋X线片、骨密度、CT等检查。争取在伤后48 h内实施手术。围术期输血标准:Hb≤80 g/L。采用喉罩全身麻醉联合神经阻滞麻醉。手术采用侧卧位,徒手牵引闭合复位,于大转子顶点偏内侧钻入导针,C型臂X光机透视正侧位确认导针位置良好,扩髓后,依据术前分组给予髓腔内TXA干预,轻轻插入PFNAⅡ主钉使其尾端平大转子顶点。螺旋刀在正位片上位于股骨颈中下1/3,侧位片上位于股骨颈正中,并注意控制尖顶距(TAD)为20~30 mm。冲洗伤口,观察组局部应用TXA,手术扩髓后置入主钉前应用TXA 2 g (50 mL),其中30 mL注入髓腔,关闭切口前将其余20 mL于骨折断端周围及切口边缘注射浸润;对照组不使用TXA。缝合伤口。术后给予帕瑞昔布联合曲马多镇痛,术后12 h开始抗凝并常规抗骨质疏松治疗,鼓励患者尽早离床扶助行器非负重活动。定期门诊随访,观察骨折愈合情况,指导患者康复锻炼。
1.3观察指标 记录患者身高、BMI、血常规指标、凝血功能指标、手术时间、术中失血量、输血量、术后当天胃肠道反应、术后切口愈合、血栓相关并发症等情况。应用Gross方程计算红细胞容积,依据术前术后血常规等数据,计算围术期显性失血量及隐性失血量。

2 结 果
2.1两组围术期各项指标比较 观察组隐性失血量、总失血量、输血量明显少于对照组,差异有统计学意义(P<0.05)。观察组输血率、术后Hb下降最大值明显低于对照组,差异有统计学意义(P<0.05)。见表2。
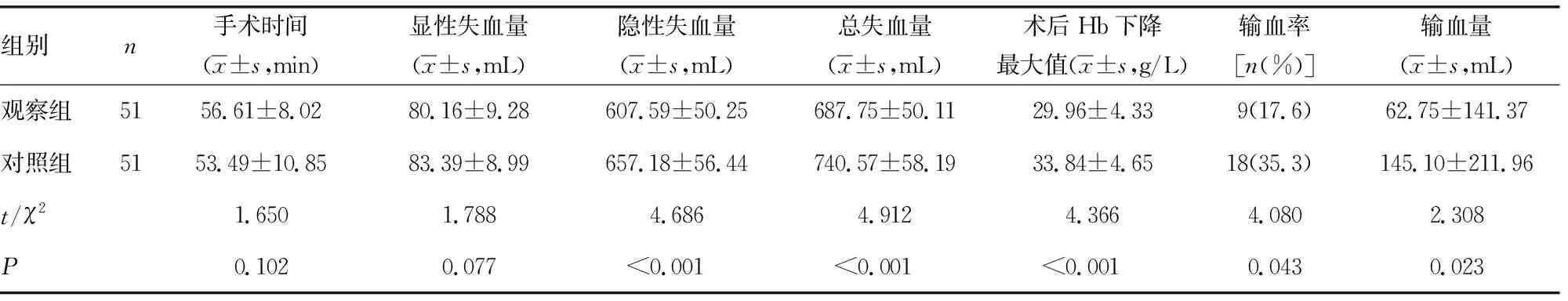
表2 围术期各项指标比较
2.2两组术后各项指标比较 观察组术后非负重下床活动时间明显短于对照组,差异有统计学意义(P<0.05)。两组术后各项并发症发生率及术后3个月内死亡率比较,差异无统计学意义(P>0.05)。见表3。
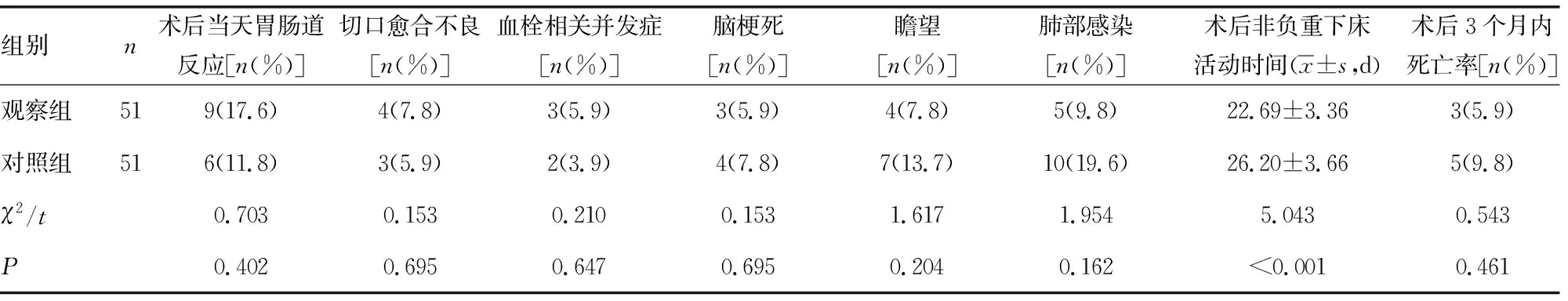
表3 两组术后各项指标比较
3 讨 论
近年来,ITF患者的数量逐年增加[1-2],伤后长时间卧床、活动受限使患者易并发坠积性肺炎、深静脉血栓、褥疮等并发症[1-3]。及时手术干预有助于患者病情恢复。PFNA-Ⅱ内固定治疗ITF已成为临床医生的首选,手术操作便捷、手术切口小、固定牢固[4],但术后患者隐性失血量大,FOSS等[10]报道546例老年ITF患者行髓内固定,发现术后隐性失血量为547~1 473 mL。
如果不及时纠正患者贫血,可能延长伤口愈合时间和住院时间,增加术后肺水肿和脑水肿的发生风险,并导致其他问题。因此,如何减少围术期失血是促进ITF患者术后快速康复的关键。采用多模式联合血液管理方法能够减少此类患者的输血量,如控制性降压、局部冷敷、自体血回输,以及使用凝血剂、红细胞生成素、抗纤溶药物等[11]。这些方法虽然有效,但仍存在许多缺陷。
TXA是氨基酸赖氨酸的合成衍生物[8],通过与Kringle结构域结合,竞争性地抑制纤溶酶原对纤溶酶蛋白的活化。TXA的使用方法上,以往多倾向于静脉滴注,但近年来研究报道TXA局部应用在髋膝关节置换手术中更具有优势[12]。ITF髓内与髓外固定比较,髓内固定术后Hb丢失严重,PFNA-Ⅱ内固定术后隐性失血考虑主要因髓腔内操作,组织间隙渗出引起,TXA局部应用是否更有利于减少术中及术后失血尚不明确。
本研究术中在置入主钉前将30 mL TXA注入髓腔,关闭切口前将另外20 mL TXA于骨折断端及切口边缘注射浸润,相比笔者此前的研究中将100 mL TXA注入髓腔和切口内浸泡,能够避免TXA外溢,注射浸润覆盖的范围更广泛,使TXA能充分有效利用。本研究结果显示,观察组术中显性失血量与对照组比较,差异无统计学意义(P>0.05)。进一步分析发现,对照组患者术后Hb下降最大值出现在术后第3~5天,说明在术后早期手术创面内存在持续慢性失血。观察组术后Hb下降最大值出现在术后第2~3天,隐性失血量、总失血量、输血量均少于对照组,输血率亦明显低于对照组,说明局部应用TXA能有效减少手术创面术后持续慢性失血,局部应用TXA更具有靶向性,能很快提升手术区域的药物浓度,及时发挥止血作用,减少术中髓腔内操作及术后纤溶亢进引起的失血。
近年来对TXA止血作用的研究报道较多,其通过抑制纤维蛋白溶解、减慢血凝块的降解速度来达到止血目的,止血效果明确,不增加蛋白质的纤维合成,不改变患者的凝血功能,不会升高深静脉血栓形成的概率[8-9,12]。但其存在其他不良反应和潜在风险,笔者在前期的临床应用中发现,静脉应用TXA过程中,不少患者有明显胃肠道反应,表现为恶心、呕吐,术后长时间进食差,导致患者营养不良,影响术后恢复。周燕燕等[13]在对TXA在关节置换手术中的应用研究中发现,胃肠道反应的发生率高达46.7%,建议控制静脉滴注TXA速度和浓度。有研究报道,在心脏手术中大剂量应用TXA可引起继发性大出血、癫痫等不良事件[14]。MCLEAN等[15]报道高浓度的TXA对体外肌腱、滑膜和软骨等软组织的细胞可产生毒性。ITF患者局部应用TXA是否会存在上述不良反应尚未见报道。
本研究中,两组患者在手术后当天均有恶心、呕吐等胃肠道反应,但两组间比较,差异无统计学意义(P>0.05)。说明局部应用TXA,药物集中于创面周围,不会在短时间内进入循环系统,延缓了药物代谢,不会进一步引起其他不适。两组患者均有切口红肿、渗液等切口愈合不良情况发生,但组间差异无统计学意义(P>0.05),说明局部应用TXA并不会影响切口愈合。本研究中所有患者术后均未发生肺栓塞,术后第7天的超声筛查也未发现下肢深静脉血栓,此时TXA早已代谢,说明应用TXA并未增加ITF患者静脉血栓相关并发症发生风险。观察组术后第4周的超声筛查共发现3例血栓相关并发症,局部应用TXA患者术后非负重下床活动时间更早,尽早离床活动有利于减少下肢深静脉血栓形成,ITF患者术后卧床期间虽允许适当活动,且抗凝治疗直到术后2周,但仍有发生深静脉血栓风险。此外,两组患者术后脑梗死、瞻望、肺部感染等并发症发生率,以及术后3个月内死亡率比较,差异无统计学意义(P>0.05),但上述并发症的发生可能和贫血相关,需进一步进行大样本的研究。
综上所述,ITF PFNA-Ⅱ内固定术中采用髓腔内灌注,骨折断端及切口周围浸润注射TXA的方法可行,能有效减少术后隐性失血量,不增加术后发生血栓性疾病的风险,且术后相关并发症发生率低,更有利于患者恢复,尽早离床活动,符合ERAS理念。

