以不明原因消瘦为首发临床表现的多发性骨髓瘤1例*
王宗慧,吴 涛,毛东锋,薛 锋,刘文慧,鱼玲玲,白 海
中国人民解放军联勤保障部队第九四〇医院全军血液病中心,甘肃兰州 730050
多发性骨髓瘤(MM)是血液系统最常见的恶性肿瘤之一,是浆细胞过度增殖所引起的一种恶性增殖性疾病,骨髓中克隆性浆细胞异常增生,并分泌单克隆免疫球蛋白或其片段(M蛋白),常见的临床表现有骨骼破坏、感染、贫血、高钙血症、肾功能损伤、高黏滞综合征、出血倾向、淀粉样变性和雷诺现象、髓外浸润等。而以不明原因消瘦为首发临床表现的MM不多见,近期本院血液病中心收治1例以不明原因消瘦为首发临床表现的MM,现报道如下。
1 临床资料
患者,男,49岁,因“体质量进行性下降2个月”于2018年7月11日入院。患者于2018年5月初无明显诱因出现体质量进行性下降(2个月下降约7.5 kg),未见骨痛、发热,无鼻衄及牙龈出血,无多饮、多尿,无咳嗽、咳痰,无腹痛、腹泻,无心悸、多汗、脾气暴躁等不适症状,未予以重视。后因症状进行性加重,于2018年7月10日就诊于当地某三甲医院,门诊尿常规检查示:尿蛋白+,尿隐血+。肝肾功能检查示:总蛋白147.8 g/L,球蛋白 118.9 g/L。2018年7月11日至本院就诊,血常规检查示:白细胞不分类,血红蛋白(Hb) 95 g/L,平均红细胞体积(MCV)105.9 fL,血小板计数(PLT)239×109/L。尿常规检查示:尿隐血+、尿蛋白+。免疫全项示:免疫球蛋白(Ig)G 10 100 mg/dL。腹部超声示:脾大(脾门处厚4.2 cm,肋下触及)。生化全项示:估算的肾小球滤过率75.82 mL/min、β2微球蛋白8.63 mg/L、总蛋白140.1 g/L、清蛋白26.7 g/L、球蛋白113.4 g/L、钙2.06 mmol/L、磷1.69 mmol/L、钠130.2 mmol/L、肌酐100.0 μmol/L。24 h尿蛋白定量示:尿总蛋白2 581.5 mg/24 h。外周血细胞形态示:成熟红细胞部分呈缗钱状排列,细胞形态及分类未见异常。骨髓细胞学检查示:骨髓有核细胞增生极度活跃,浆细胞比例升高,原始浆细胞+幼稚浆细胞占30.4%,可见多核浆细胞。免疫分型示:异常浆细胞占有核细胞的12%,表达CD38、CD56、CD138、cKappa,部分表达CD27。染色体核型未见异常。荧光原位杂交(FISH)示:MM预后基因筛查阴性。血清游离轻链检查示:游离轻链κ 1 005 mg/L,游离轻链λ 7.54 mg/L,游离轻链κ/λ 133.289。血清蛋白电泳示:球蛋白82.0 g/L、γ区带74.1%、β区带2.8%、α2区带3.2%、α1区带1.4%、清蛋白18.5%。免疫固定电泳示:IgG阳性、κ轻链阳性。尿游离轻链示:游离轻链κ>4 850 mg/L,游离轻链λ 10.5 mg/L,游离轻链κ/λ>462。诊断为“MM IgG型 κ轻链阳性 Ⅲ期 A组”。给予PAD方案(注射用硼替佐米 2.4 mg,第1、4、8、11天皮下注射;脂质体多柔吡星40 mg,第1天静脉滴注;地塞米松注射液40 mg,第1~4天,第8~11天静脉滴注化疗),第一个疗程结束后,复查骨髓细胞形态学提示完全缓解骨髓象,体质量较前增加2 kg,予以PAD方案重复治疗一个疗程,复查骨髓细胞形态学提示完全缓解,体质量较前增加5 kg。2018年8月21日、9月22日、10月24日给予PAD方案巩固治疗,疗程顺利。复查骨髓细胞形态学示:MM治疗后骨髓象完全缓解。免疫固定电泳:阴性。血常规正常。于2018年12月6—10日进行细胞因子动员,2018年12月10—11日进行自体干细胞采集、冻存,计数单个核细胞(MNC)12.78×108/kg,CD45+CD34+细胞为18.4×106/kg。12月13日转入无菌间开始进行马法兰(第1天150 mg;第2天200 mg)单药预处理。2018年12月17日复苏、回输自体干细胞,活细胞占90%,MNC为11.5×108/kg,CD45+CD34+细胞为16.56×106/kg。常规给予保肝、止血、输成分血、刺激因子等对症支持治疗。5 d后复查白细胞计数(WBC)<0.5×109/L、PLT<20×109/L。根据移植指南,中性粒细胞>0.5×109/L提示粒细胞植活,9 d后复查WBC 3.11×109/L,中性粒细胞2.14×109/L。10 d后病情平稳转出无菌间。移植后病情稳定,复查骨髓细胞形态学呈持续缓解状态。2021年8月25日复查免疫固定电泳:阴性。Ig检测示:IgG为974 mg/dL(正常参考范围为860~1 740 mg/dL),目前患者病情平稳,口服沙利度胺片每次100 mg,1 d 1次维持治疗中,本院血液病中心门诊随访中,患者疾病治疗后体质量随时间(12个月内)变化趋势见图1。
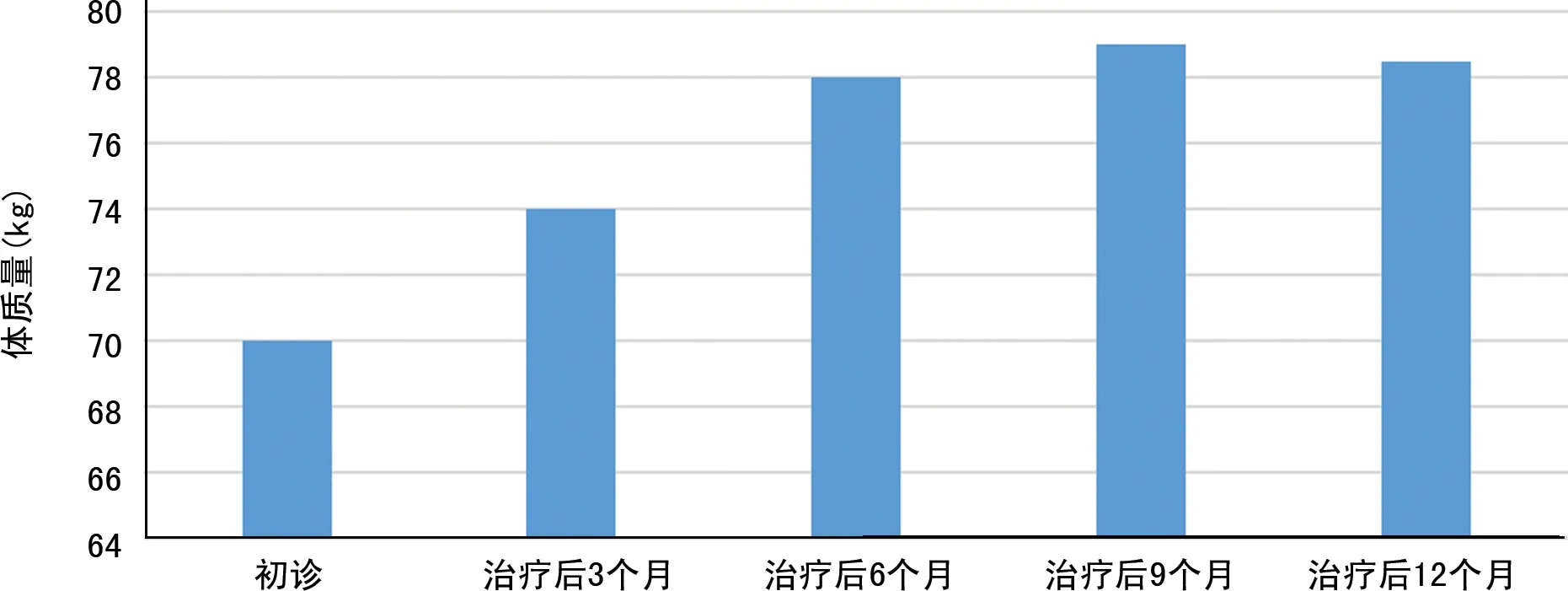
图1 患者治疗后体质量随时间(12个月内)变化趋势
2 讨 论
MM是浆细胞异常增殖引起的恶性肿瘤,主要以骨髓内浆细胞恶性增殖并浸润髓外软组织为主要表现,当出现多发性神经病变时,主要表现出双侧对称性远端感觉障碍及运动障碍。MM的发病率为2/100 000~3/100 000,男女发病率比约为1.60∶1.00,多数患者发病年龄>40岁,病因暂不明确,但有报道显示可能MM发病与遗传、环境因素、化学物质、病毒感染、慢性炎症及抗原刺激等密切相关。按照血清M蛋白成分的不同可将本病分为IgG、IgA、IgM、IgD、IgE型、轻链型、非分泌型及双克隆免疫球蛋白型8种类型。骨髓细胞形态学检查及组织病理活检是该病诊断的金标准。临床确诊难点在于症状无特异性,以及医师需对骨髓穿刺检查进行必要性评估,部分患者对骨髓穿刺存在不同程度的畏惧,不接受该检查。MM的诊断标准:(1)骨髓细胞形态学提示骨髓中克隆性浆细胞≥10%,或者是骨髓活检为浆细胞瘤。(2)骨髓细胞形态学提示骨髓中克隆性浆细胞≥60%。(3)受累/非受累血清游离轻链的比值≥100。(4)影像学检查显示一处以上局灶性的病变。(5)高钙血症,血钙>2.75 mmol/L。(6)出现肾功能不全,血肌酐>177 μmol/L。(7)贫血,Hb低于正常值下限的20 g/L,或者<100 g/L。(8)出现骨病。骨病是通过X线片、CT、PET-CT发现一处或多处溶骨性的骨损伤。满足第1点及第2~8点中的任何一点可以诊断[1]。
该患者以“体质量进行性下降(2个月下降约7.5 kg)”为首发临床表现就诊,首先考虑该患者是否为非器质性病变所致,了解该患者每天通过饮食所摄入的总量较之前是否有所减少,了解近期营养成分是否发生变化,其中多摄入的有效成分是否减少,如患者近期是否由于减肥,采取少吃或者不吃的方法来使体质量下降,是否有通过体能训练来消耗脂肪等能量物质,是否有生活、工作、运动等规律、强度的变化,通过分析以上因素了解、排除了非器质性病变导致的体质量减低。其次考虑患者器质性病变所导致的消瘦,以及内分泌及代谢疾病所导致的进行性消瘦。查免疫全项提示:IgG 10 100 mg/dL(正常参考范围为860~1 740 mg/dL)。生化全项示:β2微球蛋白8.63 mg/L(正常参考范围为1.01~2.97 mg/L),此时高度怀疑为浆细胞疾病。最后通过询问病史、体检、分析临床表现,以及血常规、生化全项、免疫全项、外周血细胞形态、骨髓细胞形态学检查、免疫分型、染色体核型、FISH等辅助检查综合考虑为血液系统疾病中的“MM IgG型κ轻链阳性Ⅲ期A组”,此类患者早期除有骨痛、溶血、贫血等症状外,还以排出蛋白尿为主要特征,此类患者若早期不查明蛋白尿的性质,极易按肾病诊治而造成误诊,失去早期治疗的时机。因此,此类患者出现蛋白尿时,应做M蛋白鉴定、血蛋白电泳、尿蛋白电泳、免疫固定电泳排查,提高轻链型MM的检出率,为患者赢得最佳的治疗时机[2]。当患者以不明原因消瘦来院就诊时,最先考虑有无结核、消化道溃疡等常见疾病,通过检验去验证猜想,当各种检验指标暂不支持临床医生想法时,再从当前的检查结果中去寻找不常见疾病,如肿瘤、风湿免疫系统疾病等。
MM早期症状存在多样性、隐匿性、无特异性的特点,患者可能就诊于临床各个科室,既往研究发现MM误诊率达55.13%[3]。临床报道MM可能以贫血、乏力、肾损伤等非特异性症状为首发表现[4]。无症状或无进展的MM可以3个月复查一次;对有症状的MM应采用系统治疗,包括诱导、巩固治疗(含干细胞移植)及维持治疗。早期无症状的MM是否应该在确诊后就进行化疗,或者等到出现症状后再进行化疗,还存在争议。有研究报道,MM导致总三碘甲腺原氨酸(TT3)水平明显升高,容易被误诊为甲状腺疾病[5]。大多数患者表现为不明原因的骨痛,对于因瘤细胞破坏骨质引起病理性骨折或椎体压缩性骨折者,需要进行骨固定手术或骨水泥治疗。全面充分地评估患者病情对MM治疗尤为重要,需对患者进行全面的病史采集、体格检查,以及对骨髓瘤相关器官功能损伤的表现进行系统的检查,评估患者当前的身体功能状况,明确患者是生化复发,还是临床或活动后复发,还需了解早期治疗后的疾病缓解程度及缓解持续时间,治疗过程中有无特殊不良反应及相关药物不良反应,是否适合造血干细胞移植等[6]。

