肺部超声、血清SP-A对重症细菌性肺炎患者预后的预测价值
张 鑫
天津市中医药大学第一附属医院急症科,天津 300000
重症细菌性肺炎是一种呼吸内科常见的疾病,可进展为急性呼吸窘迫综合征、多器官功能不全综合征等,病死率较高[1]。影像学检查是诊断和评估细菌性肺炎的基本手段,但由于重症患者病情限制,患者常无法完成CT、胸部X线片等影像学检查。超声检查可在床旁、无创、便捷地实施,近年来在重症医学领域被广泛应用,但能否准确评估重症细菌性肺炎患者病情及预测预后尚不明确。血清肺表面活性蛋白A(SP-A)不仅能降低肺泡表面张力,防止因肺容量过低引起肺部组织塌陷,还具有增强巨噬细胞吞噬力与杀伤力的抗感染免疫功能,在先天性免疫防御中发挥着重要作用[2-3]。何文怡[4]的研究报道显示,肺炎动物模型血清SP-A水平低于健康对照,并与肺部组织病理变化有关,通过腹腔注射SP-A蛋白溶液可明显抑制小鼠肺组织炎性反应和病理变化。本研究探讨了肺部超声(LUS)评分、血清SP-A与重症细菌性肺炎患者急性生理和慢性健康状况评分Ⅱ(APACHEⅡ评分)、多器官功能障碍综合征(MODS)评分的相关性及联合预测价值,旨在为临床评估重症细菌性肺炎病情,预测预后提供参考,现报道如下。
1 资料与方法
1.1一般资料 选择2019年1月至2021年2月天津市中医药大学第一附属医院收治的60例重症细菌性肺炎患者为研究对象,根据发病后28 d预后情况分为死亡组(16例)、生存组(44例)。纳入标准:符合重症肺炎诊断标准[5]患者;病原学培养显示细菌阳性患者。排除标准:肺结核患者;肺栓塞患者;妊娠期、哺乳期女性;恶性肿瘤患者;非感染性间质性肺病患者;自身免疫疾病患者;血液系统疾病患者;合并其他病原体感染患者。本研究获得天津市中医药大学第一附属医院医学伦理委员会批准,患者及家属对本研究充分知情,并自愿签署知情同意书。
1.2方法
1.2.1资料收集 收集患者年龄、性别、体质量指数、饮酒史、吸烟史,以及糖尿病史、高血压史、高脂血症史、冠心病史等资料,采用双人双录法,保证数据的准确性。
1.2.2超声检测 所有研究对象于治疗前采用便捷性超声诊断仪(美国索诺声公司SonositeTurbo)检查,扫查前、中、后、下胸壁侧等12个区域,超声诊断仪上存储图像,并进行LUS评分:(1)正常通气区域出现肺滑动征及A线或独立的B线(<3根),标记为N;(2)中度肺组织失气化,出现多条间隔清晰的B线,记为B1;(3)重度肺组织失气化,出现密集融合的B线,记为B2;(4)肺实变,肺出现类似肝样组织结构及气管充气征,记为C;(5)合并胸腔积液时,记为C/P。其中N、B1、B2依次记为0、1、2分,C或C/P记为3分,LUS总分为12个区域累加之和[6]。
1.2.3血清SP-A检测及病情评估 治疗前采集患者外周静脉血5 mL,采用酶联免疫吸附试验检测SP-A水平,试剂盒购于上海信裕生物科技有限公司。采用APACHEⅡ[7]、MODS评分[8]评估患者病情程度。
1.3观察指标 (1)比较两组基线资料、SP-A、APACHEⅡ评分、MODS评分。(2)比较两组LUS评分。(3)分析LUS评分、SP-A水平与APACHEⅡ、MODS评分的相关性。(4)分析重症细菌性肺炎预后的影响因素。(5)分析单独LUS评分、SP-A检测及二者联合预测重症细菌性肺炎预后的价值。
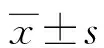
2 结 果
2.1两组基线资料、血清SP-A与APACHEⅡ、MODS评分比较 两组年龄、性别、体质量指数,有饮酒史、吸烟史、高血压史、高脂血症史、冠心病史患者比例比较,差异无统计学意义(P>0.05);死亡组有糖尿病史患者比例及APACHEⅡ、MODS评分高于生存组,SP-A水平低于生存组,差异有统计学意义(P<0.05)。见表1。
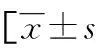
表1 两组基线资料、血清SP-A与APACHEⅡ、MODS评分比较或n/n或n(%)]

组别n高血压史高脂血症史冠心病史SP-A(ng/mL)APACHEⅡ评分(分)MODS评分(分)死亡组164(25.00)5(31.25)2(12.50)15.07±3.4322.41±4.086.18±1.22生存组4412(27.27)9(20.45)8(18.18)18.24±3.3918.32±3.174.05±1.26t/χ20.0240.2800.0173.1934.0865.838P0.8780.5970.8960.002<0.001<0.001
2.2两组LUS评分比较 死亡组LUS评分为(22.75±4.18)分,生存组LUS评分为(18.63±4.09)分,死亡组LUS评分明显高于生存组,差异有统计学意义(t=3.431,P=0.001)。
2.3LUS评分、SP-A水平与APACHEⅡ、MODS评分的相关性分析 重症细菌性肺炎患者的LUS评分与APACHEⅡ、MODS评分呈正相关(r=0.484、0.537,P<0.001),SP-A水平与APACHEⅡ、MODS评分呈负相关(r=-0.446、-0.596,P<0.001)。
2.4重症细菌性肺炎预后的Cox回归分析 以重症细菌性肺炎患者预后情况为因变量:生存赋值1,死亡赋值2。纳入两组比较差异有统计学意义的指标作为自变量:无糖尿病史赋值0,有糖尿病史赋值1;APACHEⅡ评分、MODS评分、LUS评分、SP-A低于两组均值赋值1,高于两组均值赋值2(两组APACHEⅡ评分、MODS评分、LUS评分、SP-A均值依次为19.41分、4.62分、19.73分、17.39 ng/mL)。Cox回归分析结果显示,将糖尿病、APACHEⅡ评分、MODS评分控制后,LUS评分、SP-A水平仍与预后有关,LUS评分高于两组均值者死亡风险是低于两组均值者的2.844倍,SP-A水平高于两组均值者死亡风险是低于两组均值者的0.814倍(P<0.05)。见表2。
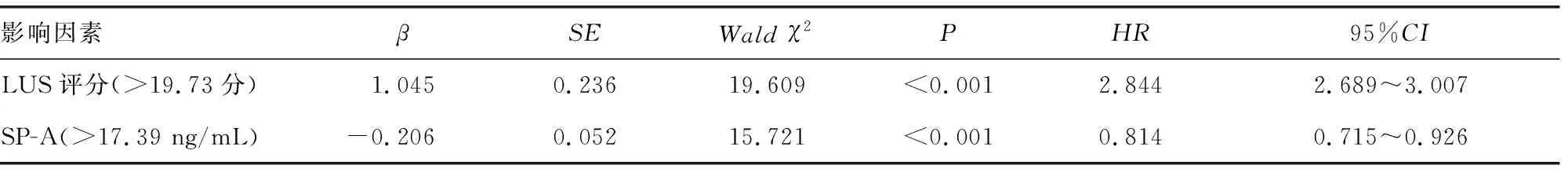
表2 重症细菌性肺炎预后的Cox回归分析
2.5LUS评分、SP-A预测重症细菌性肺炎预后的ROC曲线分析 以死亡组为阳性样本,以存活组为阴性样本,绘制各项指标预测患者死亡的ROC曲线,并采用SPSS22.0软件构建LUS评分联合SP-A的ROC曲线,结果显示,LUS评分联合SP-A预测死亡的曲线下面积(AUC)最大,见表3、图1。
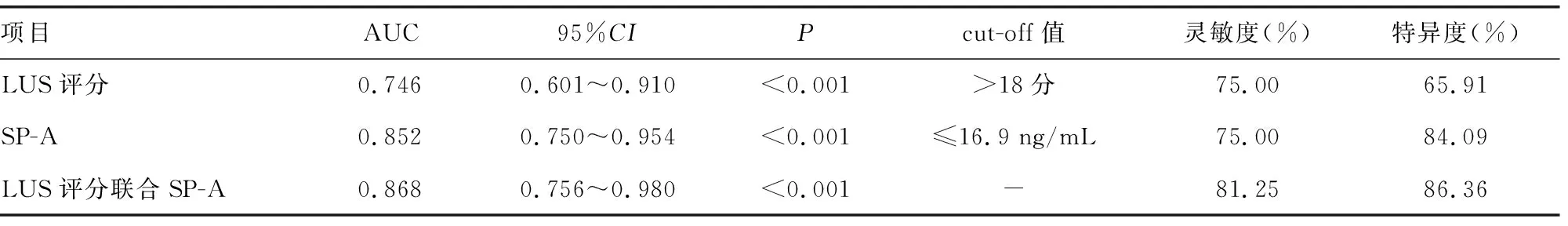
表3 LUS评分、SP-A单独及联合预测重症细菌性肺炎预后的效能
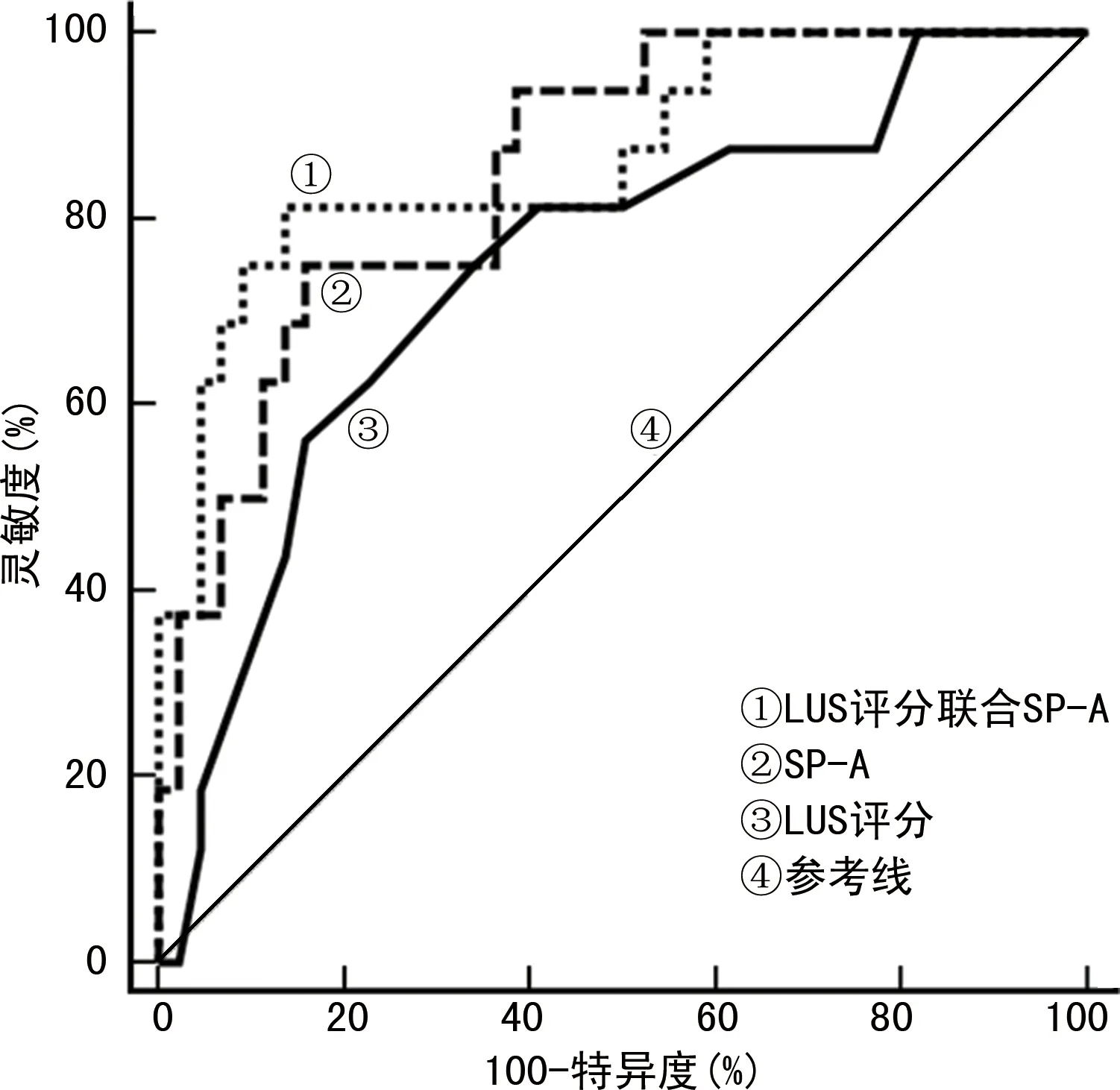
图1 LUS评分、SP-A预测重症细菌性肺炎预后的ROC曲线
3 讨 论
超声是临床最常使用的影像学检查之一,具有安全、准确、方便等优点。肺是一个气液共存的组织,表现为气体上升,液体下降,行超声检查时,正常肺组织可显示胸膜线、蝙蝠征、肺滑动征,肺组织会完全反射超声波,产生A线或少量B线等伪像[9]。而当肺部存在炎性反应时,肺内气体和液体比例发生变化,肺组织呈不同程度的失气化时,超声检查会出现不同结果,如肺实变出现支气管充气征与类似肝样组织结构,边界模糊、低回声区域;重度肺失气化出现密集融合的B线;中度肺失气化出现多条距离清楚的B线。因此,通过超声检查评估肺炎病情严重程度具有可行性[10]。
本研究结果显示,与生存组比较,死亡组LUS评分较高,与王倩倩等[11]报道结果相似。本研究应用Cox回归分析显示,控制混杂因素后,LUS评分仍与预后有关,提示LUS评分可作为评估预后的一种方法。LUS评分是基于肺部12分区评估的,是目前较为全面观察肺部通气、病变等情况的评分法,数分钟内即可完成检查。重症细菌性肺炎患者肺泡塌陷、肺容积减少、顺应性降低等越明显,LUS评分越高,病情越严重,因此,LUS评分还与APACHEⅡ、MODS评分相关。黄允省等[12]报道,LUS评分预测重症肺炎患者死亡的AUC为0.819,cut-off值为22分,灵敏度为75.00%,特异度为77.27%,本研究ROC曲线分析获得的具体数值与之不同,是样本量不同造成的,但也提示LUS评分在预测重症细菌性肺炎预后方面具有一定的参考价值。但LUS评分也存在一定局限性,如易受肥胖、腹部脂肪等影响,对距离胸膜较远的肺部中心病变可能无法探查到,因此,不能单独依靠LUS评分对肺炎患者病情、预后进行评估,需联合其他手段。
SP-A是C型凝集素家族成员,是一种多聚体胶原糖蛋白,存在于肺泡表面活性物质中,在维持肺稳态中发挥重要作用[13-14]。本研究结果显示,死亡组SP-A水平低于生存组,SP-A水平高于两组均值者死亡风险是低于两组均值者的0.814倍,提示SP-A水平升高对重症细菌性肺炎患者预后具有保护作用。SP-A水平与APACHEⅡ评分、MODS评分呈负相关,也证实SP-A水平升高与病情缓解有关。老年重症肺炎患者治疗后SP-A水平较治疗前明显升高,并伴有病情改善,证实了SP-A在重症肺炎中具有保护因子作用[15]。SP-A能减少组胺的合成与释放,调控肺泡中中性粒细胞、巨噬细胞的增殖与活化,抑制肺部炎性反应,同时还能诱导免疫球蛋白分泌,增强机体免疫功能,促进机体对细菌的防御和清除能力[16-17]。另外,本研究结果还显示,LUS评分联合SP-A预测患者死亡的AUC大于单独的LUS评分、SP-A,表明LUS评分、血清SP-A联合预测患者预后的价值更高,能提高预测的准确性。因此,建议条件允许时,对重症细菌性肺炎患者均进行LUS评分和血清SP-A检测,从而为临床提供更可靠的参考。
综上所述,LUS评分、血清SP-A与重症细菌性肺炎病情严重程度及预后有关,这两项指标联合检测可作为评估病情和预测预后的一个有效方案,为重症细菌性肺炎的临床诊疗提供重要参考信息。

