子宫腺肌症相关月经过多行子宫内膜去除术后半年再次出血
黄睿,邓姗
(1.厦门大学附属第一医院妇产科,厦门 361003;2.中国医学科学院 北京协和医学院 北京协和医院妇科内分泌与生殖中心,国家妇产疾病临床医学研究中心,北京 100730)
病例资料
患者,38岁,G2P1,主因“月经不规律2年余,子宫内膜去除术后半年,间断阴道大量出血6天”入院。
既往月经规律,5 d/27~29 d,量中,伴痛经(VAS 2分)。2019年1月因阴道出血就诊当地行诊刮术,病理提示“子宫内膜不规则增生,局部息肉样生长”,术后口服甲羟孕酮3周期,用药期间月经规律,量多;之后停药月经周期10 d/21~22 d,量多,伴痛经(VAS 4分)。2020年6月于经期第7天再次出现阴道大量出血伴血块,持续3 h,就诊外院,查子宫内膜厚11 mm,再次行诊刮术,病理示“增殖期改变,局灶不规则增生并息肉样生长”。2020年7月放置曼月乐,1个月后因曼月乐下移复位1次,1个月后再次下移给予取出。2020年9月给予口服优思明1月余,经量较前减少,因血压高停药,停药后再次出现月经量增多。
2020年11月就诊北京协和医院,盆腔常规磁共振成像(MRI):子宫形态、大小未见明显异常,子宫底部肌层信号欠均匀,似见小结节状稍短T2信号影,后壁局部结合带增厚,内缘毛糙见点状长T2信号影分布;内膜增厚,最厚处约1.7 cm,结合带完整;宫颈见多发囊状长T2信号影;双侧附件区未见明显异常信号(图1)。考虑无生育要求,择期行宫腔镜下子宫内膜息肉切除+子宫内膜去除术。术中探宫腔深8 cm,镜下可见宫腔内膜不均匀增厚,后壁多发息肉样赘生物,大小约1 cm×0.8 cm,采用STORZ22Fr等离子双极电切镜设备依次切除内膜,深达浅肌层,宫腔创面双极球形电极依次电凝一遍,反复检查无渗血(图2)。术后病理回报:(子宫内膜及浅肌层)增殖期子宫内膜及浅层的平滑肌壁组织,少许子宫内膜腺体及间质在肌层内生长,不除外伴有腺肌症的可能;(子宫内膜息肉)符合子宫内膜息肉。术后半年月经量明显减少,褐色,护垫量,7~10 d可干净。

A.矢状面:子宫形态、大小未见明显异常,子宫底部肌层信号欠均匀,似见小结节状稍短T2信号影;B.横断面:后壁局部结合带增厚,内缘毛糙见点状长T2信号影分布;C.冠状面:内膜增厚,最厚处约1.7 cm,结合带完整,宫颈见多发囊状长T2信号影。图1 盆腔常规MRI
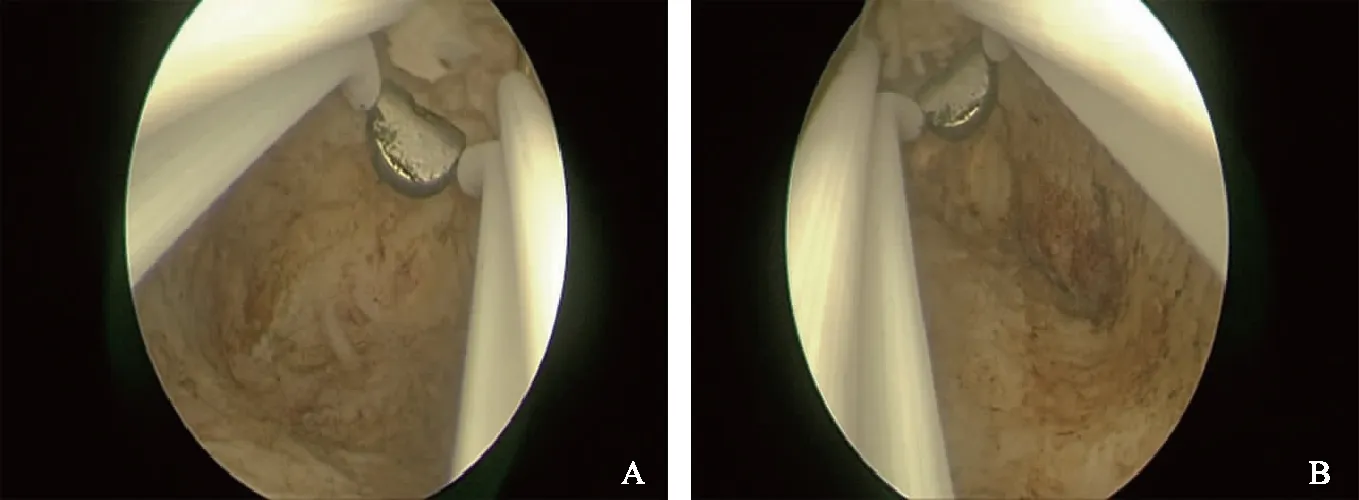
A:右侧宫角;B:左侧宫角。图2 宫腔镜下EA术后影像
本次入院前末次月经(LMP)2021年6月12日,量少;18日阴道出血增多,口服妥塞敏后阴道出血量较前减少,淋漓不尽至6月24日中午再次阴道大量出血。急诊外院查凝血功能正常,血红蛋白(HB)154 g/L,超声提示宫颈多发纳囊、阴道内积血,给予止血、促进子宫收缩等对症支持治疗后阴道出血短期内减少,后又有反复。考虑患者年纪尚轻,即便没有生育要求直接切除子宫也非首选,建议考虑子宫动脉栓塞治疗,但患者及家属经介入科会诊后,仍决定行子宫切除术。
入院后查CA125 22 U/ml;激素水平:黄体生成素(LH)39.7 U/L、卵泡刺激素(FSH)19.22 U/L、雌二醇(E2)565 pmol/L、孕酮(P)5.78 nmol/L、睾酮(T)2.22 nmol/L、泌乳素(PRL)0.60 nmol/L,考虑为排卵期改变;复查MRI大致同前,仅宫颈管杂乱纳囊较前增多(图3)。等待手术期间(月经周期第14天)再次阴道出血,量约200 ml,给予静点缩宫素、氨甲环酸止血、阴道放置米索前列醇1片,之后阴道出血逐渐减少;急查血常规提示HB 116 g/L。2 h后再次阴道出血,量约300 ml。妇科检查:阴道见较多凝血块,宫颈肥大,下唇糜烂、充血明显,组织糟脆,表面见约0.3 cm的破口,有活动性出血,宫颈口未见血液流出;行宫颈活检术,填塞纱球止血。为尽快手术,追查TCT、HPV均阴性,宫颈活检排除宫颈病变,遂行腹腔镜下全子宫+双侧输卵管切除术。术中见子宫增大如孕6周;左侧卵巢表面可见一枚黑色囊肿,直径约0.5 cm,左输卵管外观未见明显异常;右侧卵巢可见一枚血体,直径约2 cm,右输卵管可见一枚马氏囊肿,直径约1 cm,带蒂,余外观未见明显异常;子宫直肠窝及宫骶韧带封闭,直肠前壁与子宫后壁及左侧宫骶韧带致密粘连;乙状结肠与侧盆壁粘连(图4A)。术后剖探标本可见肌壁间出血点(图4B、C),病理示“增殖期子宫内膜,慢性宫颈及宫颈内膜炎,双卵管系膜囊肿,左卵巢黄体囊肿”。

A:矢状面;B:横断面;C:冠状面;子宫影像学特征大致同前,仅宫颈管内纳囊较前增多。图3 第二次盆腔常规MRI

A.术中盆腔所见:子宫轻度增大,后壁下段与直肠紧密粘连,符合子宫腺肌症和深部子宫内膜异位症的表现;B.子宫剖面宫腔外观:子宫肌壁间可见肌瘤和囊腔,亦符合子宫腺肌症改变,宫腔形态可分辨,未见明显内膜再生;C.子宫颈剖面外观:宫颈的充血外观消失。图4 术中盆腔所见及切除子宫大体标本病例警示
一、子宫内膜去除术(EA)治疗失败的原因、预测及处理
EA是通过手术破坏或切除子宫内膜至基底层来治疗药物治疗无效的顽固性异常子宫出血(AUB)的方法,以减少月经量甚至闭经为目的。EA的热效应作用于子宫内膜主要造成子宫内膜坏死、致密纤维化、玻璃样变和血管改变等组织学变化。研究发现EA术后1年闭经率约37%~38%,术后2~5年约48%~53%[1]。与公认的治疗月经过多最好的药物治疗方式——左炔诺孕酮宫内缓释系统(曼月乐)相比,在患者满意度、改善生活质量方面无显著差异,通常用于曼月乐治疗失败的患者[2]。
EA的术后并发症主要表现为延迟性并发症,包括以下3种情况:持续或复发性阴道出血,周期性盆腔疼痛以及无法充分评估子宫内膜[3]。周期性盆腔疼痛应该是EA热效应造成的广泛的子宫内瘢痕形成和粘连,随后导致子宫挛缩和/或部分宫腔闭塞引起的,当功能性内膜残留或再生时将导致腹痛、出血甚至妊娠的发生。尤其是既往有输卵管结扎术史的女性,EA术后出现周期性盆腔痛的发生率高达10%,所谓“子宫内膜去除术-输卵管绝育术后综合征(PATSS)”与宫角部位的内膜出血并双向梗阻相关[4]。宫腔结构破坏也会影响对内膜性质的评估,于是存在一定对漏诊内膜恶性病变的顾虑,但毕竟属于少见情况,而且不是本文关注的焦点,暂不展开讨论。
持续或复发性阴道出血是由于子宫内膜破坏不充分,存在深层子宫腺肌症或新发疾病的出现(如黏膜下肌瘤、壁间肌瘤甚至弥漫性子宫平滑肌瘤病,子宫内膜息肉,子宫内膜增生或肿瘤)[5]。子宫腺肌症不是EA的禁忌证,但也经常是治疗效果不满意的合并因素之一。一项纳入816例EA术后患者随访5年的回顾性研究显示,术前超声提示子宫腺肌症的女性,后期需要行子宫切除术或重复子宫内膜切除术的风险增加至1.7倍[6],而且当子宫内膜腺体距内膜切除边缘≤4~5 mm时,术后再发疼痛的可能性也更大。2010年Meenakshi等[7]的病理研究报道了子宫腺肌症中血管受累的现象,即在子宫肌层血管通道中可见腺体及间质成分,血管受累很可能是子宫腺肌病所致异常子宫出血的重要发病机制之一,其发生增加了向周围血管衍生的可能性,而腺肌症的病灶往往是弥漫性的,不止局限于浅肌层,所以EA术后复发也就更容易理解了。此外,年龄也与EA失败率有联系,<45岁的女性治疗失败的风险及再手术干预率比年龄大的女性更高,后续再次EA或子宫切除术的风险是≥45岁女性的两倍多[HR=2.6,95%CI(1.3,5.1)][6]。另外,既往有输卵管结扎史、痛经史、肥胖、合并大的黏膜下肌瘤、子宫畸形、镇痛麻醉深度、子宫内膜异位症也是EA失败的危险因素[8-9],从多角度都提示了子宫腺肌症的特殊性。
为了提高EA治疗的疗效,首先应在术前了解患者既往的子宫手术史,利用超声或MRI检查充分评估宫腔情况,了解宫腔大小、形态,是否合并有息肉、纵隔、黏膜下肌瘤或子宫腺肌症的情况,并获取内膜病理排除恶变;其次术中注意宫角、宫底、宫颈管内膜的去除是否充分,同时也应考虑宫腔粘连导致的远期腹痛、宫腔积血的可能。EA失效的后续治疗方案包括观察、药物治疗、再次EA和子宫切除术,如宫腔过大或合并子宫腺肌症的患者可在EA同时放置曼月乐环[10]或术后配合使用孕激素来提高短期闭经率[11];如复发出血,可尝试再次EA来改善出血[12]或者行子宫动脉栓塞或子宫切除术。由于内膜和浅肌层已经被切除,内膜的雌孕激素受体也大部分缺失或表达不足,所以EA术后的患者往往对低剂量激素治疗反应欠佳[13]。
二、一代EA与二代EA在止血效果和术后复发方面的比较
一代EA即在宫腔镜直视下使用电外科器械如环形电极、气化电极、滚球去除内膜,二代EA即应用一次性能源器械如双极射频(Novasure)、热球(ThermaChoice)、冷冻(Her Option)、热水循环(Hydro ThermAblator)、微波(Microwave)以及热能与双极射频联合技术(Minerva)破坏内膜。
一代EA通常使用全身麻醉,需要手术医生达到四级宫腔镜手术能力,手术时间更长且一些手术并发症风险增加(如灌注液体超负荷),但手术费用相对低。二代EA可使用局麻在门诊或日间手术室完成,手术操作程序化,时间更短,但涉及使用一次性设备,费用更高,而且不适用于子宫严重屈曲、宫腔形态异常、合并有黏膜下肌瘤或重复EA治疗的患者。所有类型EA术后的总体再手术率为17%~25%[14]。
虽然两种手术方式的疗效与各自的热效应深度密切相关,但术后内膜组织病理学的变化大致相似。有前瞻性随机研究将子宫内膜滚球消融与切除术后组织病理学和形态学变化进行比较,两组均表现为宫腔内膜完全萎缩、部分粘附或闭塞和纤维化,部分灶性子宫内膜再生的区域主要位于宫底、宫角和输卵管开口处[15]。而随着EA术后时间的延长,最初的治疗后内膜分层变化(腔内坏死,下层的纤维化,再至正常肌层以及纤维层和肌层之间的血管改变及散在炎症)在术后一年以上几乎不再可见,而替换为相对正常的子宫内膜,这种内膜组织的再生可能是出血症状复发的主要原因[16]。
EA的结果是宫腔内瘢痕形成,当出现宫腔部分粘连并在闭塞后方发生内膜再生及出血时可导致宫腔积血及腹痛。Cochrance数据库研究数据表明:一代EA与二代EA宫腔积血发生率分别为2.4%和0.9%,一代略高于二代;但术后1年和2~5年的闭经率结果相近,分别为37% vs. 38%[OR=0.9,95%CI(0.6,1.4)]和53% vs. 48%[OR=1.3,95%CI(0.6,2.9)];患者满意度也相当,术后1年和术后2~5年的患者满意度分别为91% vs. 88%[OR=1.2,95%CI(0.9,1.7)]和93% vs. 87%[OR=1.4,95%CI(0.6,3.5)];因AUB接受再次治疗(含子宫切除的各种手术)的比例相近[21% vs. 25%,OR=0.9,95%CI(0.6,1.4)],其中子宫切除术的比例也相近[14% vs. 19%,OR=0.8,95%CI(0.5,1.3)][17]。
针对两种最常用的二代EA,即子宫内膜射频治疗仪(诺舒,Navosure)和热球方法,Karpathiou等[16]的研究显示,两组患者EA术后再行子宫切除术时其平均年龄相近,分别为44.5岁及42岁,从EA到子宫切除术的时间分别为2~24个月(平均8.8月)和2~60个月(平均23.2月),热球更优于诺舒(P=0.01)。
综上,EA是治疗月经过多且无生育要求女性的有效治疗措施,但需要临床医生术前充分评估及告知远期风险,选择合适的患者及EA方式;EA术前切除已存在的宫腔内病变如子宫肌瘤、息肉等,重视子宫腺肌症,术后密切随诊,尤其是出现远期并发症的重要人群,必要时需联合其他治疗方案提高EA的有效性,降低子宫切除率。

