HLA-G及其亚型在人卵丘细胞中的表达
尚进,孙书雅,彭红梅,王辉,马慜悦,程延飞,孔娜娜,姚元庆,6*
(1.中国人民解放军总医院研究生院,北京 100853;2.香港大学李嘉诚医学院妇产科系,香港;3.中国人民解放军总医院第一医学中心妇产科,北京 100853;4.深圳市生育调控重点实验室,香港大学-深圳医院生殖医学中心,深圳 518053;5.中国人民解放军总医院第六医学中心妇产科,北京 100048;6.中国人民解放军总医院第七医学中心妇产科,北京 100010)
人类白细胞抗原-G(human leucocyte antigen G,HLA-G)属于非经典的主要组织相容性复合物Ⅰ类(major histocompatibility complex,MHC-Ⅰ)分子,选择性高表达于侵入子宫蜕膜的绒毛外滋养细胞中。HLA-G基因位于人染色体6号短臂远侧6p21.3,全长6.0 kb,基因编码8个外显子和7个内含子。其转录产物经选择性剪切产生7种mRNA异构体,分别编码4种膜结合型HLA-G(membrane-bound HLA-G,mHLA-G),即HLA-G1~HLA-G4,以及3种可溶型HLA-G(soluble HLA-G,sHLA-G),即HLA-G5~HLA-G7。
卵母细胞的成熟过程离不开它和卵丘细胞(cumulus cells,CCs)之间的双向作用[1-2]。在卵泡内,卵母细胞被颗粒细胞(granulosa cells,GCs)群体包围,在卵泡形成过程中,GCs群体分化为壁层颗粒细胞和卵丘细胞。壁层颗粒细胞排列在卵泡壁上,CCs更接近卵母细胞。成熟的卵冠丘复合物(cumulus-oocyte complex,COCs)由次级卵母细胞和周围的CCs组成,CCs具有高度特异性的跨带胞质突触,穿透透明带并在其顶端与卵母细胞形成缝隙连接,这种密切的联系使CCs能够发挥重要作用,支持卵母细胞的成熟,并向卵母细胞传递内分泌和其他环境信号[3]。
以往研究提示,体外受精-胚胎移植(IVF-ET)周期中患者的卵泡液内检测到可溶型HLA-G(sHLA-G)[4]。Dumesic等[5]也证明成熟的COCs培养上清内可检测到sHLA-G,可能是优质卵母细胞成熟的标志,有助于选择最佳受精卵以减少培养和移植的胚胎数量。卵泡液以及COCs上清液中的HLA-G很可能来源于最接近卵母细胞的卵丘细胞,通过其特异的免疫作用调节卵母细胞的发育成熟,并可能影响胚胎的发育着床。本研究旨在检测人卵丘细胞HLA-G分子及其各亚型的表达,探究HLA-G分子在卵泡发育和卵子成熟中的可能作用。
资料与方法
一、研究对象
收集2019年12月至2020年3月于解放军总医院第一医学中心行辅助生殖技术助孕治疗的不孕症患者的卵丘细胞。
纳入标准:(1)获取的卵细胞全部行卵胞浆内单精子注射-胚胎移植(ICSI-ET);(2)女性患者卵巢功能正常(因输卵管因素或男方因素行辅助生殖治疗)。
排除标准:(1)女性患者卵巢功能异常:卵巢功能低下或多囊卵巢综合征;(2)已知的子宫纵膈、宫腔粘连或宫腔畸形患者;(3)直径在4 cm以上的子宫肌瘤,或粘膜下肌瘤,或严重突向宫腔的肌壁间肌瘤等可能影响着床和胚胎发育者;(4)染色体异常、免疫性不孕、子宫内膜炎、遗传疾病、其他系统慢性疾病、其他严重器质性疾病等。
共收集10例符合标准的不孕症患者的卵丘细胞。所有样本均在征得患者知情同意下进行采集,其使用和处理均按中国人民解放军总医院伦理委员会相关管理监督条例及标准进行,取得伦理委员会决议(第S2019-296-01号)同意。
二、主要试剂和仪器
1.试剂:人卵丘细胞培养用DMEM/F12培养基(Gibco,美国);免疫荧光染色用Triton X-100、BSA(北京碧云天)、DAPI(Sigma,美国);微滴式数字PCR中AMPure XP Beads(Beckman,美国)、KAPA library amplification kit(Thermo,美国)、QubitTMdsDNA HS Assay Kit(Invitrogen,美国)。
2.仪器:CO2细胞培养箱(Thermo,美国);激光共聚焦显微镜(Zeiss,德国);微滴式数字PCR仪(Bio-Rad,美国);Qubit(Thermo,美国)。
三、研究方法
1.样本收集:收集符合纳入标准的患者的卵丘细胞。取卵完成后,将收集到的COCs加入透明质酸酶,卵丘细胞与卵母细胞分离,将卵母细胞放回培养箱,收集剩余的卵丘细胞,加入含有10%胎牛血清的培养液混匀。将混匀后的细胞悬液离心,弃除上清液,加入适量PBS,再次离心后,弃上清。收集沉淀的卵丘细胞,一部分保存于PCR管中,加入PBS保存于-80℃,留待微滴式数字PCR(ddPCR)检测;另一部分加入含10%胎牛血清的DMEM/F12培养液,并将细胞悬液转移至激光共聚焦培养皿中,置于37℃、5%CO2培养箱中培养24 h,留作免疫荧光共聚焦染色。
2.卵丘细胞内HLA-G的免疫荧光染色:显微镜下观察卵丘细胞生长情况,若细胞呈梭形贴壁生长,密度均匀,则可开始进行免疫荧光染色。(1)细胞固定透化:PBS洗涤卵丘细胞后,室温下4%多聚甲醛固定细胞,再次PBS洗涤。含有0.2%Triton X-100的PBS孵育样品,弃Triton,PBS洗涤细胞。(2)封闭和免疫染色:1%BSA-PBS孵育细胞后吸去液体风干。1%BSA-PBS稀释一抗(1∶100)。共聚焦皿中滴加一抗(阴性对照为不含一抗的稀释液),4℃冰箱孵育过夜。室温静置30 min复温,倒出溶液,将细胞在PBS中清洗3次。加入1%BSA-PBS 稀释的二抗(1∶500),黑暗中PBS清洗细胞3次,滴加DNA染色剂(DAPI)上避光孵育细胞,再次用PBS清洗细胞2次。于激光共聚焦显微镜下观察卵丘细胞内HLA-G分子的表达及其所在位置分布,并进行图像采集。
3.微滴式数字PCR(ddPCR)测定卵丘细胞内HLA-G mRNA水平:(1)逆转录:参照kit说明程序配置逆转录体系,直接裂解细胞、进行mRNA逆转录,所得的cDNA溶液置于-20℃保存。利用AMPure XP beads和磁力架重复纯化2次,室温风干去掉残留乙醇。加入Low-TE Buffer留取上清液纯化后cDNA待用。(2)第一步PCR:进行第1轮 PCR反应,向PCR反应溶液中加入DNase/RNase-free water和AMPure XP beads,再次行DNA纯化,吸取上清液待用。(3)Qubit定量:取Qubit assay tubes分别标记#1、#2以及待检测的样本编号,同时将Qubit dsDNA HS Standard #1及Qubit dsDNA HS Standard #2涡旋混匀离心。将Qubit dsDNA HS Reagent以Qubit dsDNA HS Buffer按1∶200稀释,配成Qubit检测工作液。向Qubit assay tubes#1和#2中分别加入Qubit检测工作液,向其余标记样本编号的离心管中分别加入Qubit检测工作液。再向标记#1、#2的离心管中加入对应的Qubit dsDNA HS Standard #1及Qubit dsDNA HS Standard #2;向标记各样本编号的离心管中加入对应DNA样本,混匀后离心,将各样本离心管分别置于Qubit 2.0 Fluorometer中读数,计算样本浓度。(4)EvaGreen-ddPCR定量:按照Qubit定量结果将样品梯度稀释至2 pg/μl,在伯乐液滴生成仪中生成液滴,转移至96孔板,置于封膜仪封膜。再次运行PCR程序,将完成扩增的PCR板置于QX200阅读仪中,进行液滴信号阅读。
基因引物序列:在第1轮PCR中,正向引物位于外显子1,反向引物跨越外显子5和6,从而可以扩增出所有的HLA-G mRNA亚型。在第2轮ddPCR中,设计了跨越相邻两个外显子之间的引物,以分别区分每个HLA-G mRNA亚型,即G1、G2、G3、G4、G5、G6和G7。另外设计了一套引物,用于同时扩增HLA-G的所有亚型(Pan HLA-G)。引物序列见表1。

表1 扩增HLA-G mRNA亚型的PCR引物
四、统计学方法

结 果
一、HLA-G在卵丘细胞中的表达分布
利用免疫荧光染色技术,通过激光共聚焦显微镜观察,结果显示:HLA-G蛋白于人卵丘细胞细胞膜和细胞浆内均有分布(图1)。

蓝色为卵丘细胞核DAPI染色;绿色为HLA-G染色;Merge为两种波长荧光叠加结果。图1 激光共聚焦显微镜下人卵丘细胞内HLA-G的表达
二、ddPCR检测卵丘细胞中HLA-G 各亚型mRNA表达差异
ddPCR检测人卵丘细胞内HLA-G各亚型绝对定量表达水平。结果显示,HLA-G3表达量最多,HLA-G4次之,HLA-G6表达量最少。其中HLA-G3和HLA-G4与其他各亚型相比均有显著差异(P<0.05);膜结合型HLA-G总体表达量显著高于可溶型HLA-G(P<0.001)(表2,图2)。
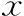
表2 ddPCR检测人卵丘细胞中HLA-G亚型绝对定量表达水平(-±s)

A:HLA-G各亚型表达水平。与其他亚型比较,*P<0.05;B:膜结合型HLA-G与可溶型HLA-G表达水平。与可溶型比较,#P<0.001。图2 ddPCR检测卵丘细胞中HLA-G亚型表达
讨 论
成功妊娠有两个关键因素:一是母体对胎儿的免疫耐受,二是早期胚胎的发育和着床。尽管近年来辅助生殖技术的发展迅速,但临床妊娠率却难以达到显著提高。对于卵母细胞的优选目前存在诸多方法:(1)评估卵丘细胞产生的类固醇激素[6];(2)形态良好和不良的卵母细胞之间的线粒体分布和ATP水平[7];(3)卵泡的血管形成[8];(4)测量膜完整性[9];(5)营养物质摄取[10]。这些技术中大部分具有侵入性,需要特定仪器和丰富经验的操作者,并且与卵母细胞和胚胎的质量相关性较低,存在许多局限性。寻找合适的生物标志物来评估高质量的卵母细胞以及胚胎具有很高的必要性。
卵丘细胞及其分泌物的检测作为间接评估卵母细胞质量的手段具有可行性。卵母细胞与相邻的卵丘细胞之间的双向信号交换对卵母细胞的能力获得、早期胚胎发育和卵丘的扩张具有重要意义,卵母细胞和卵丘细胞之间的代谢合作已经被确定为卵母细胞成熟的决定因素[11-12]。卵丘细胞在排卵后仍与卵母细胞保持松散联系,在卵母细胞离开卵巢的过程中继续支持卵母细胞[13]。此外,卵母细胞周围卵丘细胞的质量在胚胎着床过程中也起着重要作用,研究表明卵丘细胞表达血管内皮生长因子和前列腺素也可调节胚胎着床过程中的血管生成等过程[14]。
免疫微环境对卵母细胞发育质量有着重要影响。正常女性卵子中的颗粒细胞表达MHC Ⅰ和Ⅱ类分子,而在自身免疫性卵巢衰竭患者中观察到负责免疫反应的激活MHC Ⅱ类抗原调节增加[15]。Rizzo等[4]在卵泡液中检测到可溶型HLA-G(sHLA-G)的浓度高于其他人体体液,Borgatti等[16]也发现sHLA-G可能是优质卵母细胞成熟的标志物。因此,卵泡液内HLA-G分子的产生可能与抑制自身免疫反应的机制相关,维持卵泡免疫微环境的细胞因子平衡状态,影响卵母细胞质量,从而间接影响胚胎发育着床过程。而卵泡液中sHLA-G极可能来源于最接近卵母细胞的卵丘细胞。最新研究通过相对定量PCR和免疫印记技术证实了卵丘细胞中确实存在HLA-G的表达[17],但对于HLA-G亚型的表达情况还未见相关研究报道。
本研究利用共聚焦免疫荧光技术和微滴式数字PCR技术检测卵丘细胞的细胞膜及细胞质中HLA-G分子的表达,并发现了HLA-G各亚型在卵丘细胞内的表达水平差异。不同于传统的相对荧光定量PCR(RT-PCR)法,数字PCR是无需标准曲线的绝对定量检测,具有更高的检测灵敏度和数据精密度[18],能更直观精确地比较出HLA-G各亚型的表达量。我们的研究发现,HLA-G3及HLA-G4表达水平显著高于其他亚型,二者均为膜结合型,而各可溶型HLA-G表达普遍低于膜结合型HLA-G。因此HLA-G3和HLA-G4可能在卵丘细胞中发挥更为主要的作用。
绒毛和蜕膜HLA-G亚型的表达不尽相同。HLA-G3、HLA-G4和HLA-G7 mRNA在胎盘中很少存在,HLA-G5存在于整个胎盘中以及绒毛膜、蜕膜和母血中,可识别HLA-G2/-G6的抗体显示,在胎盘绒毛远端的绒毛外滋养层细胞、浸润蜕膜的滋养层细胞和一些绒毛膜滋养层细胞可见其表达[19]。HLA-G1与β2-微球蛋白结合的HLA-G5和HLA-G2/G6仅存在于细胞滋养层柱的前缘和蜕膜中的细胞滋养层细胞[20];HLA-G5在滋养层细胞亚群中普遍存在,可以作为游离重链由细胞滋养层前体干细胞和胎盘细胞滋养层产生,或与轻链β2-微球蛋白结合,由绒毛外细胞滋养层细胞产生[20]。
不同于母-胎界面,卵丘细胞表达的HLA-G亚型主要为HLA-G3和HLA-G4,其在卵丘细胞中的作用机制还有待于进一步探索。本实验研究了HLA-G及其亚型在卵丘细胞中的表达,为了解HLA-G在卵母细胞生殖发育中的作用提供了新的发现。

