血清TGF-β1、Apelin、CYP19A1水平与PCOS内分泌异常间的关系分析
蔡玉,刁海丹
(大连市第三人民医院妇科,大连 116033)
多囊卵巢综合征(PCOS)是造成育龄女性不孕的常见临床病因[1-2]。目前PCOS尚无特异性治疗方式,疾病致病机制也尚不清楚[3-4]。有研究数据表示,PCOS患者血清炎症因子水平异常升高,推测炎症反应可能推动PCOS发展[5-6]。转化生长因子-β1(TGF-β1)是常见的炎症因子,同时参与了卵泡的生长发育[7]。Apelin是一种多肽物质,广泛分布在人体多种组织及器官内,能抑制胰岛素分泌[8]。雄性激素分泌水平过高是PCOS的主要病理特征之一,而细胞色素P450 19A1(aromatase,CYP19A1)参与了雄性激素的分泌及代谢过程[9]。研究PCOS患者血清CYP19A1水平与内分泌之间的关系,有助于疾病机制的探究。本文就血清TGF-β1、Apelin、CYP19A1与PCOS的关系进行研究,以期为PCOS的诊断、发病机制提供参考依据。
资料与方法
一、研究对象
将大连市第三人民医院妇科2018年1月至2021年1月期间收治的育龄期PCOS患者纳为PCOS组。
PCOS患者符合中华医学会妇产科学分会内分泌学组《多囊卵巢综合征的诊断和治疗专家共识》[10]中相关诊断标准,即:(1)无排卵或稀发排卵;(2)雄激素水平升高或(和)高雄激素血症;(3)B超下检测提示卵巢多囊性改变。符合以上三条中任意两条,并排除合并分泌雄性激素肿瘤等其他因素所致的雄性激素升高者,即可确诊。
筛选同期健康体检合格的同龄、月经周期规律、卵巢储备功能正常、无内分泌疾病及自身免疫性疾病的健康育龄女性为对照组。
两组排除标准:排除子宫及卵巢器质性病变者、卵巢储备功能下降或卵巢早衰者、输卵管积水者、合并其他急慢性疾病者。
本研究经医院伦理委员会批准,参与者知情且同意(伦理批号:201706257)。
二、方法
1.内分泌及代谢指标检测:包括血清基础性激素指标[基础促黄体生成素(bLH),基础促卵泡激素(bFSH),基础睾酮(bT),基础泌乳素(bPRL)和基础雌二醇(bE2)],空腹血糖(FPG)、空腹胰岛素水平(FINS),胰岛素抵抗指数(HOMA-IR)、血脂[胆固醇(TG)、三脂甘油(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)]。测量患者身高体重,计算体质量指数(BMI)。对于月经规律以及月经稀发者,血清基础性激素检查时间为孕激素撤退出血第2~5天,闭经者可在任意时间检查。采集被研究者清晨空腹静脉血,采用化学发光法检测基础性激素水平。FPG及FINS水平检测分别采用口服葡萄糖耐量试验(OGTT)以及胰岛素释放试验(IRT)检验。HOMA-IR=FPG(mmol/L)×FINS(mIU/L)/22.5。脂质代谢指标于月经周期任意时间进行,采用化学免疫分析仪进行检测。
2.血清TGF-β1、Apelin、CYP19A1水平检测:采集外周静脉血6 ml,3 000 r/min快速离心15 min,分离上层血清,均分为3份,分别用于检测血清TGF-β1、Apelin、CYP19A1水平。TGF-β1采用酶联免疫吸附法(ELISA)检测,试剂盒购自武汉纯度生物科技有限公司。Apelin采用发射免疫法检测,试剂盒购自美国Phoneix Pharmaceutical公司。CYP19A1采用ELISA法检测,试剂盒购自武汉华联科生物技术有限公司。
3.分组:根据PCOS组患者是否满足血清T水平≥2.64 nmol/L,或满足雄激素性脱发、痤疮、多毛中任何一项分为高雄激素/非高雄激素亚组;根据2007年中国成人血脂代谢异常防控指南[11]中相关标准,满足以下4项中任意一项既可诊断为血脂代谢异常:TG≥6.22 mol/L、TC≥2.27 mmol/L、LDL-C≥4.14 mmol/L、HDL-C<1.04 mmol/L,将PCOS组患者分为脂质代谢正常/异常亚组;根据是否满足BMI≥25 kg/m2,将PCOS组患者分为肥胖/非肥胖亚组;根据是否满足HOMA-IR≥2.69,将PCOS组患者分为胰岛素抵抗(IR)/非胰岛素抵抗(NIR)亚组。
三、统计学方法

结 果
一、PCOS组与对照组一般情况、基础内分泌及代谢情况比较
PCOS组患者年龄为(28.41±3.15)岁,BMI为(22.69±4.03)kg/m2;对照组年龄为(29.11±3.36)岁,BMI为(22.41±3.37)kg/m2;两组间年龄及BMI无显著性差异(P>0.05)。
但PCOS组的bLH、bLH/FSH、bT、FINS、HOMA-IR、TC、TG、LDL-C均显著高于对照组(P<0.05),bFSH水平显著低于对照组(P<0.05),两组间bPRL、bE2、FPG以及HDL-C水平无显著性差异(P>0.05)(表1)。
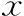
表1 PCOS组与对照组基础内分泌及代谢情况比较(-±s)
二、PCOS组与对照组血清TGF-β1、Apelin、CYP19A1水平比较
PCOS组血清TGF-β1、Apelin、CYP19A1水平均显著高于对照组(P<0.05)(表2)。
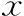
表2 PCOS组与对照组血清TGF-β1、Apelin、CYP19A1水平比较(-±s)
三、PCOS患者各亚组间血清TGF-β1、Apelin、CYP19A1水平比较
1.高雄激素与非高雄激素亚组:高雄激素亚组血清CYP19A1水平显著高于非高雄激素亚组(P<0.05);两组间血清TGF-β1、Apelin水平无显著性差异(P>0.05)(表3)。
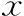
表3 高雄激素与非高雄激素亚组血清TGF-β1、Apelin、CYP19A1水平比较(-±s)
2.脂质代谢正常与异常亚组:脂质代谢异常亚组血清TGF-β1水平显著高于脂质代谢正常亚组(P<0.05);两组间血清Apelin、CYP19A1水平无显著性差异(P>0.05)(表4)。
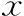
表4 脂质代谢正常与脂质代谢异常亚组血清TGF-β1、Apelin、CYP19A1水平比较(-±s)
3.肥胖与非肥胖亚组:肥胖亚组血清TGF-β1、Apelin水平均显著高于非肥胖亚组(P<0.05);两组血清CYP19A1水平无显著性差异(P>0.05)(表5)。
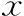
表5 肥胖与非肥胖亚组血清TGF-β1、Apelin、CYP19A1水平比较(-±s)
4.IR与NIR亚组:IR亚组血清TGF-β1、Apelin水平均显著高于NIR亚组(P<0.05);两组间血清CYP19A1水平无显著性差异(P>0.05)(表6)。
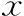
表6 IR与NIR亚组血清TGF-β1、Apelin、CYP19A1水平比较(-±s)
四、PCOS患者血清TGF-β1、Apelin、CYP19A1水平之间的相关性分析
Pearson相关性分析提示,PCOS患者血清CYP19A1与TGF-β1、Apelin均呈弱正相关(P<0.05),但TGF-β1与Apelin之间无显著相关性(P>0.05)(表7)。

表7 PCOS患者血清TGF-β1、Apelin、CYP19A1水平之间的相关性分析
讨 论
PCOS不仅会引起排卵障碍、月经不调等生殖问题,患者所存在的内分泌障碍也逐渐获得临床关注。本研究将80例PCOS患者与70例健康同龄孕龄女性进行对比,结果发现,PCOS组bLH、bLH/FSH、bT、FINS、HOMA-OR、TC、TG、LDL-C水平均显著高于对照组,bFSH水平显著低于健康对照组。提示PCOS患者在性激素、糖代谢、脂代谢、IR等多个方面呈现异常。有研究表示,PCOS患者出现肥胖、IR、脂代谢紊乱等内分泌异常问题的概率远高于正常同龄女性[12]。PCOS不仅仅影响到患者的生殖健康,还影响到患者内分泌。
TGF-β1主要表达在初级卵泡卵母细胞、颗粒细胞等,Ewens等[13]研究发现,TGF-β1等位基因的表达情况与PCOS伴IR患者间存在相关性。同时TGF-β1也是常见的炎症因子,参与各种急慢性炎症疾病的发展。本文研究发现,PCOS组患者血清TGF-β1水平显著高于健康对照组,且在脂质代谢异常、肥胖以及存在IR的PCOS患者中的水平均高于其对照亚组,提示血清TGF-β1与PCOS患者肥胖、脂质代谢紊乱以及IR等内分泌紊乱情况具有相关性。
Apelin是孤独G蛋白偶联受体APJ受体的内源性配体,能调节免疫与胰岛素分泌,参与了高血压、心脏病等心血管疾病的发生与发展。有研究表示,Apelin与脂联素的性质相似,能参与脂质代谢,并证实Apelin可通过PKC以及PI3K途径直接调节胰岛素[14]。本研究发现,PCOS组患者血清Apelin水平显著高于健康对照组,且伴有肥胖以及IR的PCOS患者血清Apelin水平也显著高于其对照亚组,提示血清Apelin可能参与PCOS患者肥胖以及IR进程。
临床数据显示,大概有50%~70%的PCOS患者存在高雄激素血症,高雄激素血症与IR之间关系紧密,IR可通过多种途径促进高雄激素血症,而高雄激素血症又能通过正反馈作用,增加血清T水平含量,提高双氢睾酮释放量,提高LH/FSH比值,加重激素代谢紊乱[15-16]。CYP19A1基因参与雄激素代谢,其多态性与高雄激素血症间存在密切联系。本研究发现,PCOS患者血清CYP19A1水平显著高于健康对照组,且存在高雄激素血症的PCOS患者血清CYP19A1含量显著高于其对照亚组,提示CYP19A1参与了PCOS高雄激素血症;但未发现血清CYP19A1与肥胖、脂质代谢紊乱以及IR之间的关系。
此外,本研究进行Pearson相关性分析发现,PCOS患者血清CYP19A1与TGF-β1及Apelin均呈弱正相关,提示CYP19A1与TGF-β1及Apelin之间可能还存在相互作用机制,共同参与PCOS发生及进展。
综上所述,我们的研究发现,血清TGF-β1与PCOS患者肥胖、脂质代谢紊乱以及IR之间存在相关性,血清Apelin与PCOS患者肥胖以及IR之间存在相关性,血清CYP19A1与PCOS患者高雄激素血症间存在相关性。这些结果表明,血清TGF-β1、Apelin、CYP19A1与PCOS内分泌紊乱间存在密切联系。限于研究条件,本研究并未对各指标在引起PCOS内分泌紊乱中的具体机制进行研究,但可作为下一步研究的方向。

