以肺动脉高压为首发症状的先天性肝内门体分流Ⅴ型静脉导管未闭诊疗经验
尹强 彭宇明 季春宜 王野峰 陈文娟
1 湖南省儿童医院普外科,长沙 410007;2 湖南省儿童医院心血管内科,长沙 410007;3 湖南省儿童医院超声科,长沙 410007
先天性肝内门体分流(congenital intrahepatic portosystemic venous shunts,CIPSVS)是指肝内门静脉分支与肝静脉分支或下腔静脉间直接连通,门静脉血流经低阻力导管通过肝脏或绕过肝脏直接进入下腔静脉[1]。 近年研究表明,正常肝实质存在肝内门体分流( intrahepatic portosystemic venous shunts,IPSVS),但生理情况下肝窦阻力极低,IPSVS处于关闭状态[2]。 影像学检查肉眼可见的先天性IPSVS 少见,通常无症状,大部分病例无解剖记录[3]。 因 CIPSVS 相对少见,而以肺动脉高压为首发症状者更少。 本研究将结合文献探讨儿童先天性肝内门体分流的临床表现及治疗策略。
材料与方法
一、研究对象
回顾性分析湖南省儿童医院收治的1 例以肺动脉高压为首发症状的先天性肝内门体分流V 型静脉导管未闭(patent ductus venosus,PDV)患儿的临床资料及术后随访资料,并对相关文献进行整理分析。 本研究经湖南省儿童医院伦理委员会审核同意。
患儿男,5 岁,以“反复呼吸道感染5 年,乏力1年”于2019 年2 月25 日为主诉入院。 患儿出生后反复出现呼吸道感染,对症治疗后症状缓解。 1 年前开始出现活动耐力下降,活动后稍有气促。 随病程进展,患儿病情反复且出现发热、全血细胞减少,原因不明。 心脏彩超提示肺动脉高压,收入心血管内科。 入院查体:颜面部无水肿,双肺呼吸音粗,未及湿啰音及喘鸣音,心音有力。 腹壁静脉无显露,腹平软,腹部无包块,肝脏触及肋下3 cm,质软,脾脏未触及,移动性浊音阴性,双下肢无水肿。
血白细胞3.32×109/L,中性粒细胞1.51×109/L,红细胞4.65×1012/L,血红蛋白127 g/L,血小板102 ×109/L;总胆红素20.6 μmol/L,谷丙转氨酶18.4 U/L,谷草转氨酶45.8 U/L,白蛋白41.2 g/L;尿素3.0 mmol/L,肌酐 31.2 μmol/L;血氨 43.2 μmol/L。 B超检查提示门静脉左支与下腔静脉之间可见蓝色血流,宽约 6 mm,流速约 40 cm/s,横截面积0.3 cm2,流量720 cm3/min,门静脉呈向肝血流,门静脉内径约7 mm,流速18.9 cm/s。 肝后段下腔静脉内径约9.4 mm,内血彩充盈好。 右房、右室增大,右室壁肥厚。 肺动脉内径增宽,肺动脉26 mm,主动脉内径正常,主动脉位于右后方,肺动脉位于左前方,二者呈环抱关系,未见交通支。 主动脉瓣呈三叶式,开放与关闭正常。 肺动脉瓣可见返流束限于瓣膜口,测得最大流速32 cm/s,压差44 mmHg。 根据肺动脉瓣返流估测肺动脉平均压力约52 mmHg。CT 提示静脉导管未闭,肺动脉高压,右心室扩大及右心室壁增厚,右心房扩大。
二、文献检索方法
计算机检索 PubMed、the Cochrane library、中国知网、万方、维普数据库,最后检索时间为2021 年3月;中文文献检索词为“先天性肝内门体分流V 型静脉导管未闭”, 英文文献采用主题词检索,检索词为“patent ductus venosus”。
结 果
一、本例诊疗经过及结果
结合患儿病史及检查结果,最终诊断为先天性肝内门体分流Ⅴ型(静脉导管未闭),肺动脉高压(图1)。 给予强心、利尿、降肺动脉高压等对症治疗,肺动脉高压降低不理想;且既往病程中反复出现呼吸道感染,于2019 年3 月11 日行剖腹探查、术中肺动脉及门静脉测压、静脉导管结扎术(图2)。术前于食道超声引导下穿刺右侧颈内静脉置入肺动脉测压管,测得肺动脉压力为50 mmHg(1 mmHg=0.133 kPa);打开肝胃韧带,尾状叶上缘与下腔静脉左外侧和Ⅱ肝段上缘之间隐约可见一粗大静脉血管,直径约10 mm,确定为先天性肝内门体分流畸形V 型(静脉导管未闭);术中取小肠系膜静脉终末支,置入测压管,外接传感器后测得门静脉压为23 mmHg。 预阻断静脉导管,每 5 min 监测 1 次,动态观察门静脉压力变化(结果分别为23 mmHg、30 mmHg、38 mmHg、22 mmHg)。 15 min 后监测门静脉维持在 21 mmHg 左右,肺动脉压维持在45 mmHg 左右。 综合评估门静脉系统血流动力学稳定,予以7#丝线双重结扎静脉导管。 术后生命体征平稳,予常规抗感染等治疗,术后第7 天顺利出院。随访6 个月,病情稳定,未发生呼吸道感染。 复查血常规,白细胞正常,谷丙转氨酶、谷草转氨酶正常,NH431.5 μmol/L。 超声检查提示门静脉呈向肝血流,门静脉内径增宽,约7.6 mm,流速25 cm/s;未探及静脉导管;肝静脉回流可。 心脏彩超示右房、右室稍增大、肺动脉增宽;根据三尖瓣返流压差,估测肺动脉收缩压约49 mmHg(图3)。
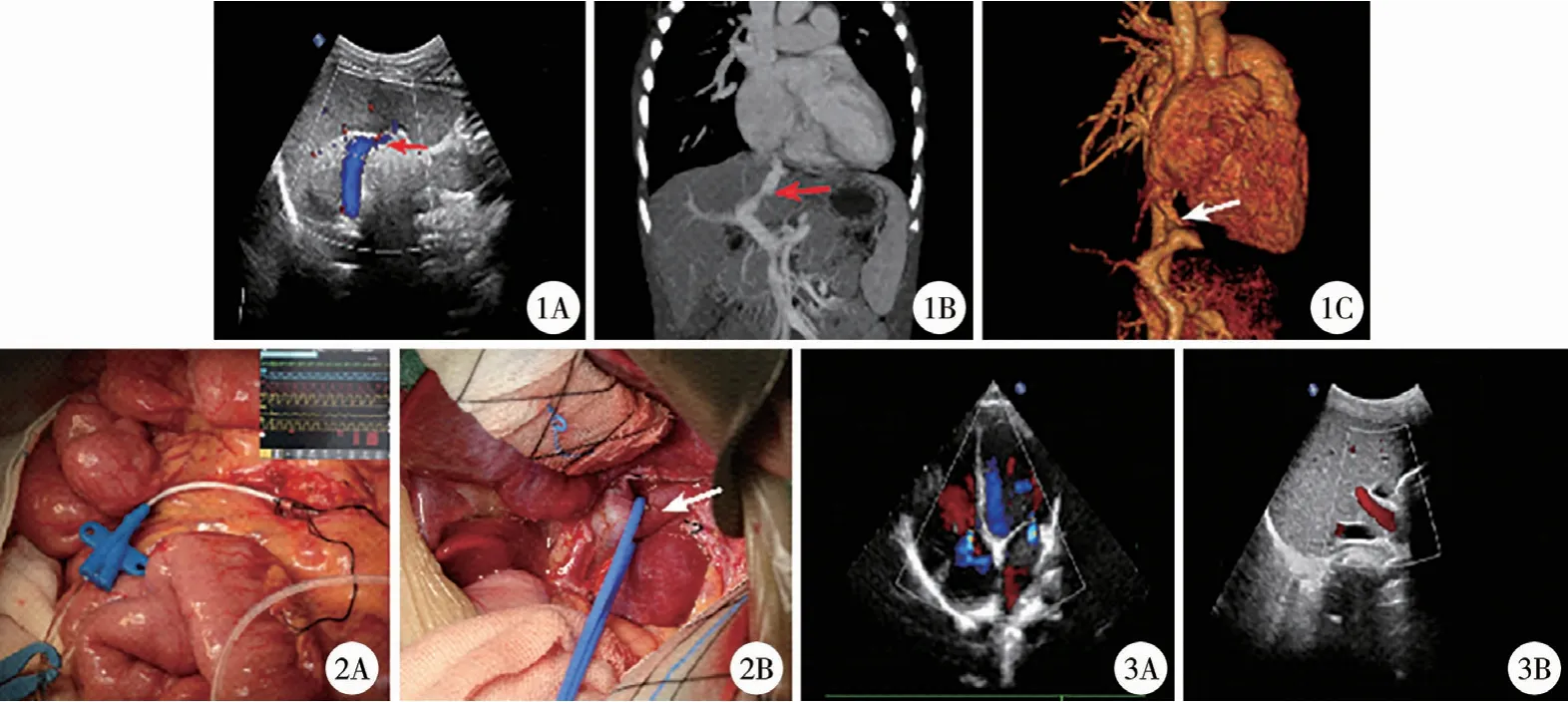
图1 术前影像学评估 注 1A、1B、1C 图中箭头所示为未闭的静脉导管位置 图2 术中情况 2A:图为小肠系膜静脉终末支置入测压管测压;2B: 图为裸化静脉导管门静脉端,套带标记 图3 术后影像学评估 3A:二三尖瓣轻度反流;3B:术后肝静脉血流Fig.1 Preoperative imaging assessment Fig.2 Intra-operative findings Fig.3 Postoperative imaging assessment
二、文献复习结果
文献报道的病例数共41 例,其中介入手术4例,开腹手术17 例,腔镜手术3 例,余17 例未报道治疗方案。 详见表1。

表1 近20 年PDV 文献报道结果Table 1 Literature reports of PDV cases in the past 20 years
讨 论
IPSVS 是一种少见的门静脉系统发育畸形,可分为4 型:Ⅰ型是指门静脉右支通过单一的大血管与下腔静脉沟通,是最常见的分型;Ⅱ型是指局限于一个肝段的门静脉分支向肝静脉分流;Ⅲ型是指通过瘤样扩张形成的门静脉分支向肝静脉分流;Ⅳ型是指多个肝段的门静脉分支向肝静脉分流[4-5]。PDV 是一种特殊类型的IPSVS,单独列为IPSVS 第Ⅴ型,本例患儿即属于此型。
本例患儿以肺动脉高压和由此并发的呼吸道感染为首发症状在多家医院就诊,考虑与先天性心脏病相关,未进行肝血管评估,导致较长时间未明确病因。 在临床工作中,儿童肝脏血管畸形常因缺乏明显的临床症状,且自然病程与分流类型、分流量及患儿年龄相关,而无法早期诊断。 CIPSVS 临床表现高度多样化,儿童期主要表现为肝门静脉灌注不足导致的肝功能受损和代谢异常,包括高半乳糖血症、高胆红素血症、高胆汁酸血症、高血氨、高胰岛素血症、低甲状腺素血症、性早熟等[6-8]。
长时间高流量的门体分流对全身其他系统也产生一定的影响。 ①神经系统:门体分流性肝性脑病和肝性脊髓病,可出现高血氨引起的恶心、呕吐、精神改变或下肢瘫痪等,且随着年龄的增加,发病率逐渐上升[9]。 ②心血管系统:门静脉性肺动脉高压(portopulmonary hypertension,PPHTN)和肝肺综合征(hepatopulmonary syndrome,HPS),为先天性门体分流的肺血管并发症[10]。 肺动脉高压(pulmonary arterial hypertension,PAH)发病率为13%~16%,病死率达50%,分流阻断后可以稳定PAH 病情。 HPS发病率约10%,以氧合障碍表现为主,分流阻断后可缓解。 同时,肝脏循环阻力下降、静脉回心血量增加可导致高排型心力衰竭。 本例患儿反复出现呼吸道感染并乏力的临床表现,考虑与此相关。 ③消化系统:胃肠道出血,更常见于肝外型门体分流。④泌尿系统:分流使得肝脏对来源于门静脉的免疫复合物清除率下降,引起肾小球肾炎。 ⑤肿瘤:分流使肝细胞门静脉供应不足,肝动脉血流代偿性增加,从而导致肝脏肿瘤发病率上升,如局灶性结节性增生(focal nodular hyperplasia,FNH)、再生结节性增生(regenerative nodular hyperplasia,RNH)和肝细胞腺瘤;良性以 FNH 最常见[11]。
CIPSVS 临床表现的多样性要求治疗个体化。资料表明,肝内门体分流可在生后2 年内闭合,对于这类无症状患儿可考虑定期随访[1]。 如发现分流量增大或出现临床症状,则应进行干预。 本例患儿5 岁,病程5 年,症状逐渐加重,保守治疗无效,且未闭静脉导管直径约1 cm;经手术结扎分流的静脉导管未再通,分流消失,肝功能、凝血指标、血氨、胆汁酸均逐渐恢复正常,效果良好。 传统开放手术效果确切,但目前已经有腹腔镜手术报道[12]。 随着微创介入技术及医用器材的不断进步,介入栓塞逐渐成为一种安全有效的替代外科手术的治疗手段,首选方式应该是介入治疗关闭分流;一期介入治疗有困难时,可行分期介入堵闭,支架中央部位的直径不超过分流通道直径的50%~60%,从而达到限制门-体分流量,促进门脉分支的发育,为后期门-体分流的完全堵闭创造条件;若患儿本身条件不宜介入治疗或介入治疗失败时,可选择外科手术治疗。
CIPSVS 的预后与患儿年龄和分流率有关,多数在1 岁内自然关闭[13]。 但也有报道自然关闭并不多见,仅有14%的肝内分流和1%的肝外分流患儿在出生后 18 ~ 24 个月内自然关闭。 Tivers 等[18]发现,CIPSVS 缓解后门脉血管发育程度和门脉血管化程度、肝血管内皮生长因子(hepatic vascular endothelial growth factor,VEGF)显著相关,而在部分减毒后,血清VEGF 浓度显着增加,因此有理由认为,CIPSVS 缓解后肝内血管生成有助于术后肝内血管的发育。 如前所述,儿童无论是否有严重的门脉高压和肝损伤,都有可能发展成肺动脉高压,因为PPHTN 病理组织学特征与特发性肺动脉高压基本一致,包括肺血管收缩、血管内皮细胞及平滑肌细胞增生、肺血管丛样病变以及原位血栓及纤维化等,但是远期存活率更低,因此在分流得到阻止后,肺动脉高压往往不可逆转。 本例患儿门体分流导管结扎后肺动脉压力降低,但能否恢复正常,还需要长期随访。
总之,CIPSVS 临床罕见,且临床表现高度多样化,出现肝门静脉灌注不足导致的肝功能受损、代谢异常以及心肺系统异常灌注时,应考虑此病的可能,治疗需要个体化。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明文献检索为尹强、季春宜,论文调查设计为尹强、彭宇明、季春宜,数据收集与分析尹强、彭宇明、季春宜、王野峰、陈文娟,论文结果撰写为尹强、季春宜,论文讨论分析为尹强、彭宇明、季春宜

