不同病理分级肝癌患者化学位移效应的MRI同反相位成像特征及病理诊断应用分析
王芳
杞县中医院影像科,河南省杞县 475000
肝癌是引起癌症相关死亡的主要原因之一,病理组织学分级对制定肝癌患者治疗方案和判断患者预后具有重要意义,低分化肝癌患者经手术治疗、放化疗后仍有较高的复发率,预后不如中分化、高分化肝癌患者[1-2]。当前,常规MRI检查是诊断肝癌的主要方式,但无法对肿瘤进行病理分级诊断[3];随着MRI技术的发展,具有化学位移效应的MRI同反相位成像检查则可对肿瘤进行定量分析,在肿瘤的病理分级诊断中具有一定的应用价值[4]。基于此,本研究就不同病理分级肝癌患者化学位移效应的MRI同反相位成像特征进行了分析,探讨了其对肝癌患者进行病理分级诊断的价值。
1 资料与方法
1.1 一般资料 选取2017年1月至2019年12月我院收治的肝癌患者为观察对象。纳入标准:肝癌诊断符合《原发性肝癌诊疗规范(2019年版)》[5]中相关的诊断标准;患者临床资料完整。排除指标:合并心、肾、肺等器质性疾病;免疫系统障碍;罹患传染性疾病及感染性疾病;合并其他恶性肿瘤。
1.2 方法
1.2.1 资料收集 根据纳入、排除标准确定研究对象,收集患者的脂肪分数(FF)值、T2WI同反相位图像上的信号强度值以及最小表观弥散系数(ADC)、病理检查等相关临床资料。
1.2.2 分组 根据《原发性肝癌诊疗规范(2019年版)》[5]中相关的诊断标准,将纳入研究的90例肝癌患者分为高分化组、中分化组、低分化组,每组30例。
1.2.3 MRI检查 纳入研究患者均接受具有化学位移效应的MRI同反相位成像检查:采用1.5T超导型磁共振扫描仪(XGY-BroadScan-1.5, 鑫高益公司,中国宁波),16通道体线圈;术前行T1WI、T2WI序列以及多期增强扫描。平扫横轴位T2WI 脂肪抑制序列设定位TR 6316 ms,TE 89.3 ms,层厚5.0 mm,层间距1 mm;横轴位Dixon成像设定层厚5 mm,层间距1 mm,TR 5.6 ms,其中同相位TE 2.7 ms,反相位TE 1.3 ms。动态增强扫描采用肝脏三维容积内插快速扰相梯度回波(Liver Acquisition with Volume Acceleration,LAVA)序列,设定TR 2.6 ms,TE 1.3 ms,层厚5 mm。对比剂采用钆喷酸葡胺(Gadopentetate dimeglumine,Gd-DTPA,拜耳公司,德国),注射流率2 mL/s,剂量 0.1 mmol/kg;行动脉早期、动脉晚期、门脉期和延迟期扫描。采用盲法,由两名具有5年及以上工作经验的影像医师(对患者的病理结果均不知情)在XGY-BroadScan-1.5工作站上完成相关值的测量,于同相位、反相位图像相同层面相对应位置手动画出圆形兴趣区(ROI),根据肿瘤体积大小决定ROI数量,记录信号强度(SI),设定ROI大小为40~70 mm2。ROI设置原则:(1)设置在病灶实性部分,即T1WI为等信号,T2WI为等或稍高信号,不管肿瘤是否存在增强;(2)尽量避开坏死、出血、囊变区及瘤内脉管;(3)离肿瘤边缘至少5 mm。脂肪分数计算公式:脂肪分数(FF)=(SIip-SIop)/2×SIip。SIip、SIop分别为同、反相位图像上兴趣区平均信号强度。测定最小表观弥散系数(ADC)值,获得肿瘤ADC图。以T1WI、T2WI与增强图像作为对照,于ADC图上肿瘤病灶各个层面均放置多个兴趣区,统计全部兴趣区,获取最小ADC值。
1.3 统计学处理 采用SPSS 20.0统计学软件分析数据。计数资料用%表示,比较采用χ2检验;计量资料以x±s表示,三组间均数的比较采取单因素方差分析方法,均数的两两间比较进行SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同病理分级肝癌患者的FF值比较 低分化组、中分化组、高分化组的FF值分别为(10.49±0.14)%、(8.37±0.21)%、(4.32±0.33)%,三组比较差异有统计学意义(F=5124.490,P=0.000)。
2.2 不同病理分级患者T2WI同反相位图像上的信号强度及ADC值比较 低分化组、中分化组、高分化组患者检查的信号强度比较表现为高分化组<中分化组<低分化组,差异有统计学意义(P<0.05);三组患者检查的ADC值比较表现为低分化组<中分化组<高分化组,差异有统计学意义(P<0.05)。见表1。
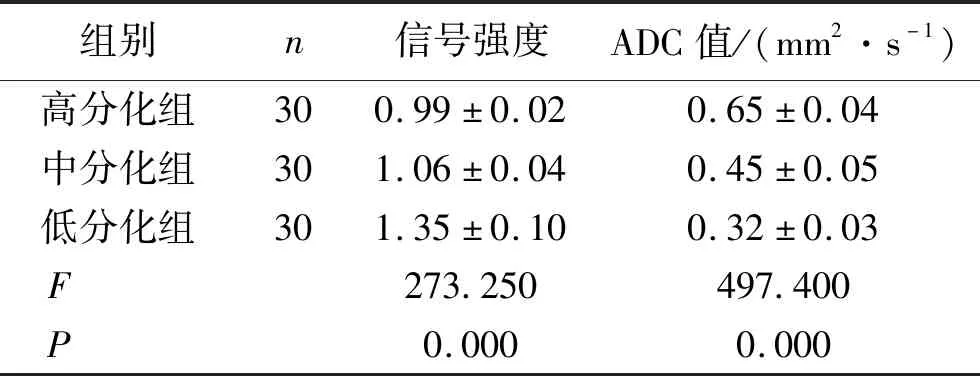
表1 不同病理分级患者T2WI同反相位图像上的信号强度及ADC值比较 (n,x±s)
3 讨 论
分化程度可直接反映出肿瘤的病理分级情况,肿瘤细胞的分化程度高,说明肿瘤细胞非常接近于正常细胞;相反,肿瘤细胞的分化程度低,说明肿瘤细胞与正常细胞的差距非常大[6]。因此,分化程度高的肿瘤细胞其恶性程度比较低,而分化程度低的肿瘤细胞其恶性程度就比较高。由于肝癌组织的病理分级决定着患者治疗方案的制订,对患者的预后产生重大的影响,因此对患者进行病理分级诊断具有十分重要的意义。目前,临床上均以病理组织检查结果作为肝癌病理分级诊断的金标准,但因其属于一种侵入性操作,临床应用具有一定的局限性,因此寻找一种高效、无创的方法来对肝癌患者进行病理分级诊断临床意义重大。利用MRI检查虽能对肝癌患者进行临床诊断,但无法对肝癌组织进行病理分级。为探讨肝癌患者MRI检查的特征表现与肝癌组织病理分级的关系,探讨根据MRI检查结果对肝癌患者进行病理学分级诊断的可行性,本研究就不同病理分级肝癌患者化学位移效应的MRI同反相位成像特征进行了比较分析。结果显示,低分化组肝癌患者的FF值高于中分化组患者,中分化组患者的FF值高于高分化组患者;肝癌组织病理分级越高,患者MRI检查显示出的FF水平越高,提示肝癌患者化学位移效应的MRI同反相位成像特征与其肝癌组织的病理分级之间存在着比较密切的关系。
研究[7]发现,高分化肝癌组织最初由门静脉进行供血,但伴随肿瘤组织的不断增殖、患者病情的不断进展,门脉供血会不断减少,最后肝动脉便成为主要的供血来源。伴随着肝癌的供血来源从门静脉转变为肝动脉,肿瘤内部会发生明显的缺氧以及缺糖代谢应激反应即肿瘤细胞的“Warburg效应”,在此效应下肿瘤组织会增加葡萄糖的摄取量,不断强化糖酵解途径以满足肿瘤快速生长的物质及能量需要。肝癌恶性程度越重,肿瘤细胞增殖越明显,组织缺氧、缺糖越严重。“Warburg效应”也是脂质合成丰富肿瘤底物的重要机制,最后将产生的甘油三酯存储在胞内脂滴中,“Warburg效应”越剧烈,肿瘤细胞脂质水平升高越明显[8]。随着MRI技术的不断发展,利用化学位移效应的MRI同反相位成像能有效检出细胞脂肪变性情况,直观反映出积聚于中性脂滴中的脂质信号,即FF;FF水平越高,肝癌恶性程度越重,肝癌病理分级越高。本研究结果显示,低分化组肝癌患者的ADC值低于中分化组,中分化组ADC值低于高分化组;肝癌组织病理分级越高,患者的ADC值越低,其同反相位信号强度越强。弥散加权可有效反映细胞分子内的水分子运动情况,可对组织结构及成分予以定量分析,可有效弥补单纯 MRI检查仅可以获取形态学及血流动力学情况的不足。而ADC是反映水分子弥散功能的一个指标,反映出水分子出入细胞、血管的运动能力,细胞分子内的水分子弥散功能越强其ADC值越高[9]。MRI检查的信号强度可反映出肝癌病灶内脂肪成分与水含量的相对变化情况,肝癌组织病理分级高者的癌细胞(即低分化者)较病理分级低者的有丝分裂更为强烈、核质比更高;癌细胞内空间缩小,水分子扩散受限则ADC值变低[10]。高病理分级肝癌患者病灶内常同时含有较多的脂肪,其脂成分和水含量分布情况会发生改变,当其比例达到一定程度时,其同、反相位图像的信号差异明显,同反相位信号变强;低病理分级肝癌患者病灶内的脂肪成分含量较低,其同、反相位图像上的信号差异不明显,同反相位信号变弱[11]。因此,利用化学位移效应的MRI同反相位成像检测肝癌患者的FF、ADC值以及同反相位信号强度,可对患者做出初步的病理分级诊断。

