肺腺癌患者血清长链非编码RNA miR155HG表达及意义
李博文,张心宇,刘 洋,刘 禹
(哈尔滨医科大学附属第四医院检验科,黑龙江 哈尔滨 150001)
非小细胞肺癌(Non-small-cell lung carcinoma,NSCLC)是严重威胁人类健康的肿瘤之一,据估计,全世界近四分之一的癌症相关死亡病例由肺癌引起[1],而NSCLC又占肺癌的近85%。肺腺癌(Adenocarcinoma of lung,LUAD)是NSCLC最常见的组织学亚型。LUAD诊断时多为晚期或已发生转移,往往错过了最佳治疗时间,尽管目前对肿瘤的治疗取得了长足的进展,LUAD的5年生存率仍只有15%左右[2-4]。因此,找到一种能够早期诊断LUAD的生物标志物十分必要。
长链非编码RNA(Long non-coding RNA,LncRNA)是非编码RNA(non-coding RNA)家族中的重要一员。LncRNA是一种长度超过200个核苷酸的RNA分子,不能翻译成蛋白质。LncRNA miR155 Host Gene(LncRNA miR155HG),又称B细胞整合簇,位于染色体21q21上。有文献报道,LncRNA miR155HG在弥漫性大B细胞瘤和原发性纵膈淋巴瘤中高表达[5]。LncRNA miR155HG促进胶质瘤和GBM肿瘤的生长,并与大肠癌、胰腺癌、喉鳞癌相关[6-8]。这些结果表明LncRNA miR155HG在肿瘤的发展、侵袭和转移中起重要作用。血清和血浆中的循环RNA是目前分子标记物研究领域的热点,在对疾病的临床筛查和监测中有重要应用。LncRNA在血液、尿液等体液样本中的表达稳定且具有组织特异性,因此我们认为血清中LncRNA miR155HG可能成为具有早期监测肿瘤发生价值的分子标志物。
LncRNA miR155HG在LUAD的发生过程中的表达水平与LUAD临床特征的相关性尚不明确。本研究利用LUAD患者的血清标本及健康对照组血清标本,LncRNA miR155HG的表达水平利用实时荧光定量PCR(Quantitative realtime PCR,RT-qPCR)方法检测,旨在明确LncRNA miR155HG在LUAD患者的血清中的表达差异性,探讨其表达水平与LUAD临床特征的相关性,评价其作为LUAD生物标志物的可能性。
1 资料与方法
1.1 一般资料 选择2015年1月至2016年1月在哈尔滨医科大学附属第四医院呼吸科住院的NSCLC患者为研究对象。本实验共纳入LUAD患者38例,男24例,女14例,年龄54~70岁,平均(62.7±8.2)岁。健康对照组25例,男16例,女9例,年龄52~68岁,平均(60.3±7.9)岁。入选患者的临床诊断通过CT引导下经皮穿刺活检或手术切除获得组织标本进行的。病理学检查完成。组织学分类根据WHO 2010版标准。入选病例排除其他肿瘤、变态反应性疾病、感染性疾病等影响。两组一般资料比较无统计学差异(P>0.05),具有可比性。本研究经医学伦理委员会审核后进行。
1.2 研究方法
1.2.1 仪器与试剂:Tizol试剂购自天根生化科技公司,引物购自上海生工生物公司,Premix Ex TaqTM试剂、逆转录试剂购自大连宝生生物工程公司,罗氏实时荧光定量 PCR仪Lightcycler 480R(Software 1.5)。
1.2.2 血清样本采集:清晨空腹状态下,采集受试对象静脉血4 ml,放于无抗凝剂的标本采集管中。在室温(20~25 ℃)放置60 min后,3000 r/min离心10 min后,分离血清1 ml至EP管中,12000 r/min离心10 min后,留取上清800 μl于-80 ℃冰箱冻存备用。
1.2.3 RT-qPCR法测定血清中LncRNA表达:利用Trizol试剂快速提取法提取血清中总RNA,并用核酸测定仪测定RNA含量。取2 μg经DNA酶处理后,反转录为cDNA,合成的cDNA存于-20 ℃冰箱备用。反应体系共20 μl包括:cDNA 2μl,Taq酶10 μl,上下游引物各0.5 μl,EvaGreen 1 μl ,ddH20 6 μl,将上述混合物涡旋振荡,充分混匀。RT-qPCR反应条件:95 ℃ 30 s预变性,95 ℃ 5 s,63 ℃ 30 s,95 ℃ 10 s重复40个循环。96孔板进行样本筛选,每个样本进行3次重复实验。在罗氏实时荧光定量 PCR仪Lightcycler480R上进行反应。反应结束后利用 Software 1.5对结果进行CT值分析,以GAPDH作为内参按照2-ΔΔCT算法进行基因相对表达量分析。所有实验引物均由Primer Blast 网站设计。LncRNA miR155HG的正义链引物序列为5’-TGGAACAAATTGCTGCCGTG-3’,反义链引物序列为5’-AGGTTGAACATC
C-CAGTGACC-3’。 GAPDH的正义链引物序列为5’-ATTTGGCTACAGCAACAGGGTG-3’,反义链引物序列为5’-TGGTTGAGCACAGGGTACTTTATTG-3’。RT-qPCR反应特异性由熔解曲线判断,若呈单峰则特异。
1.2.4 随访:所有患者自在医院接受手术治疗出院后开始进行随访,随访采用电话以及复查方式进行,随访截至2018年12月。本研究将整体生存期(OS) 定义为接受手术时间到死亡时间。
2 结 果
2.1 LUAD患者血清LncRNA miR155HG的表达水平 我们通过RT-qPCR方法检测LncRNA miR155HG在LUAD患者血清和健康对照组血清中的表达水平,以GAPDH作为内参按照2-ΔΔCT算法进行基因相对表达量分析。比较发现,LncRNA miR155HG在LUAD患者血清中表达水平升高,差异有统计学意义(P<0.0001),见图1。
2.2 LncRNA miR155HG表达水平与LUAD临床特征相关性 LncRNA miR155HG表达水平与LUAD临床特征,如性别、年龄、肿瘤直径,淋巴结转移,远端转移等均无相关性,差异无统计学意义(均P>0.05),见表1。

表1 LncRNA miR155HG表达水平与LUAD临床特征相关性(例)
2.3 LncRNA miR155HG作为LUAD诊断的分子标志物 用ROC曲线对LncRNA miR155HG用于LUAD诊断的效能进行评价,见图2 。ROC 曲线下面积(AUC) 为0.8105(P<0.0001) 。LncRNA miR155HG诊断LUAD的敏感度及特异度分别为91.56%、70.55%。LncRNA miR155HG可以作为LUAD诊断的分子标志物。
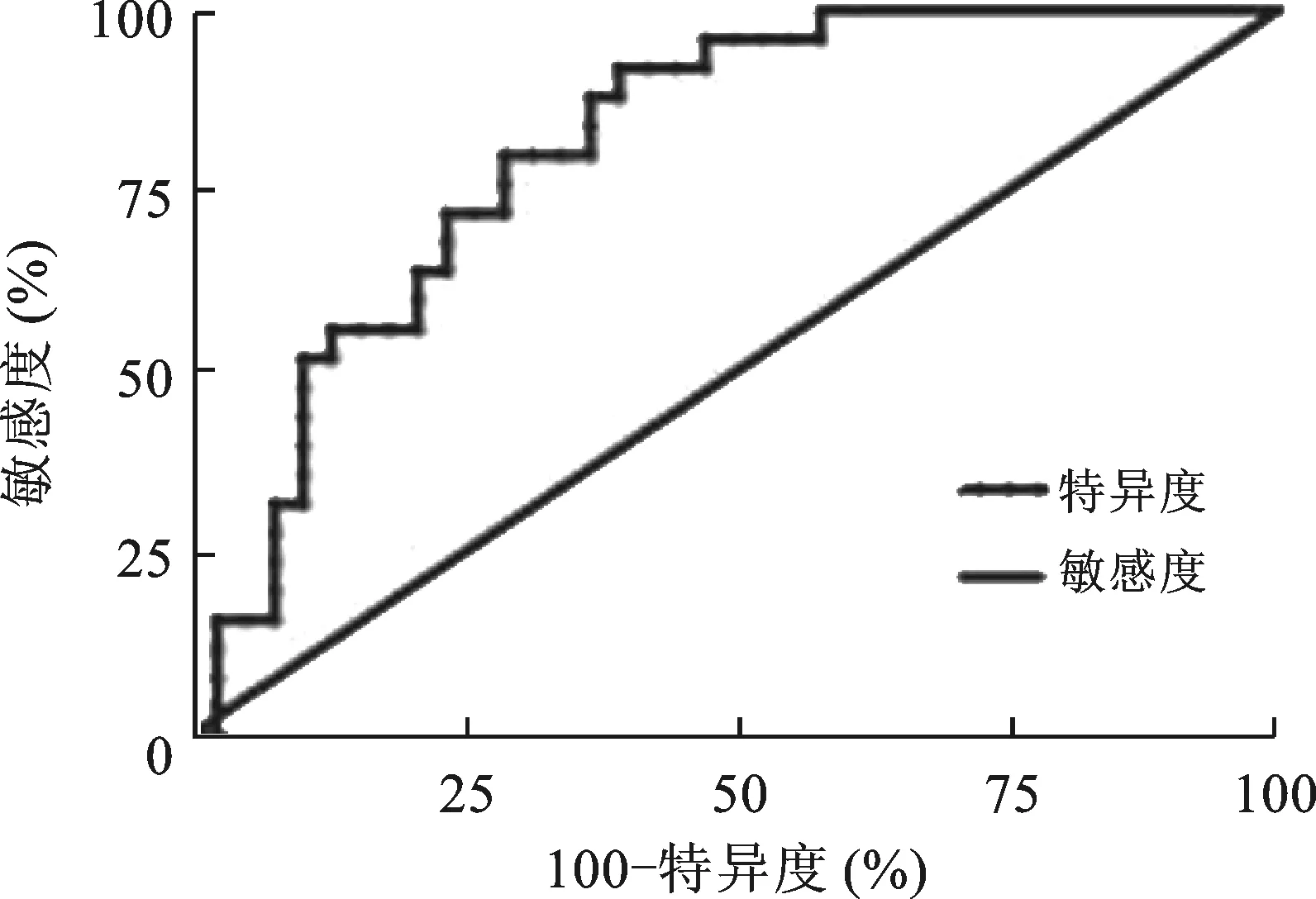
图2 LncRNA miR155HG诊断LUAD的ROC 曲线
2.4 LncRNA miR155HG不能作为预测LUAD预后的分子标志物 在完成随访的38例LUAD患者中,以LncRNA miR155HG表达水平(2-ΔΔCT) 的均数(mean) 为截断值,高于6.85者为低表达组(21例),低于6.85者为高表达组(21例)。LncRNA miR155HG高表达者预后优于低表达组,但差异无统计学意义(P=0.12)。LncRNA miR155HG不能作为预测LUAD预后的分子标志物。见图3。
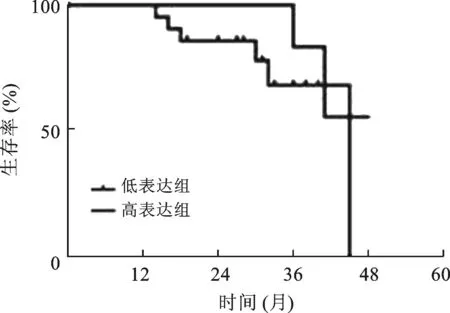
图3 LncRNA miR155HG表达水平与LUAD预后的相关性
3 讨 论
本研究利用人血清标本,探讨了LncRNA miR155HG在LUAD患者血清和健康对照组血清中的差异表达情况,分析其表达水平与LUAD患者临床特征的相关性,并评价其作为LUAD诊断生物标志物的可能性。本研究对于了解LncRNA miR155HG在LUAD发生中的作用及为LUAD的早期诊断提供了新的线索和依据。
LncRNA最初被认为是RNA聚合酶 Ⅱ 转录的副产物,没有生物功能。然而,越来越多的证据表明LncRNA具有多种生物功能。比如已知的LncRNA具有异质性,可以介导表观遗传变化,招募染色质重塑复合物到特定的基因组位点,从而改变启动子在基因组的染色质状态,影响基因表达。LncRNA的另一重要机制是调控转录,转录因子或其他蛋白成分的相互作用调控转录。LncRNA可能隔离在细胞质中的转录因子,防止其移位到细胞核。另外,LncRNA还具备调控转录后的功能,对RNA的诱导作用,对microRNA的涂抹作用,组成RNP,抑制mRNA翻译,调控剪接和降解mRNA的功能[9-10]。
尽管LncRNA的生物功能还未完全已知,LncRNA在肿瘤的发生发展、预后甚至转移过程中起到关键作用越来越被人们重视。比如LncRNA HOTAIR,一个位于12q13上HOXC位点上的LncRNA,起初认为在人类乳腺癌中具有基本作用。它通过与PRC2结合,使HOXC部分位点沉默,从而诱导H3-赖氨酸27-三甲化,进而像胚胎成纤维细胞那样重塑乳腺上皮细胞的基因表达模式[11]。然而有研究指出LncRNA HOTAIR在非小细胞肺癌中高水平异常表达,能够提高非小细胞肺癌细胞迁移与侵袭水平,可能和患者的不良预后有联系[12]。这表明LncRNA 具有非特异性。LncRNA XIST通过调控miR-186-5p促进非小细胞肺癌的增殖[13]。LncRNA HULC最初在肝癌组织中发现表达失调。近来有文献表明LncRNA HULC在NSCLC组织中有明显的高表达,这与LncRNA HULC在蛋白酪氨酸磷酸酶受体O(PTPRO)中具有负向作用有关[14]。另有文献表明,抑制LncRNA HULC的表达促进肿瘤细胞的凋亡并抑制肿瘤细胞的增殖[15]。在细胞代谢过程中,LncRNA ANRIL可以与CBX7蛋白相互作用,形成PRC1多克隆蛋白复合物的一部分,从而参与前列腺癌的发生[16]。LncRNA MALAT1首先在肺癌中发现,后有研究显示其调控ULK1 依赖性自噬的发生是由miR-558参与介导,从而保护心肌细胞并改善心脏功能[17]。
LncRNA miR155HG在转基因小鼠模型中具有致癌基因活性[18]。在慢性淋巴细胞白血病中,转录因子MYB激活LncRNA miR155HG的活性,导致LncRNA miR155HG的表观遗传性状改变从而引起其异常升高[19]。LncRNA miR155HG在免疫应答机制中发挥重要作用,参与多种免疫特异性转录物的表达。文献报道,LncRNA miR155HG在多种肿瘤,如UAD、胆管癌、皮肤黑色素瘤、乳腺癌、肾细胞瘤等中的表达水平和肿瘤纯度、免疫细胞如B淋巴细胞、CD8+T细胞、CD4+T细胞有关[20]。在慢性阻塞性肺疾病的发展中,LncRNA miR155HG调节M1/M2巨噬细胞极化[21]。LncRNA miR155HG在甲型流感病毒感染期间参与调节宿主先天免疫功能[22]。
在本组研究中,LncRNA miR155HG在LUAD患者血清中的表达高于健康对照组血清表达情况。有文献报道LncRNA miR155HG在LUAD组织和癌旁组织的对比中有高表达,间接支持了我们的结果[23]。分析LncRNA miR155HG与LUAD临床特征相关性时,结果显示LncRNA miR155HG表达水平与LUAD患者的临床特征无关,如性别、年龄、肿瘤直径、淋巴结转移情况、远端转移情况等。
我们分析ROC曲线的结果表明,LncRNA miR155HG作为生物标志物诊断LUAD时,其曲线下面积、灵敏度及特异度分别为0.8105,91.56%、70.55%。研究结果提示LncRNA miR155HG可能与LUAD的发生过程有关,且具有作为LUAD诊断生物标志物的可能性,这将为LUAD的早期诊断带来新的方向。
LncRNA miR155HG与LUAD患者生存状态相关性方面,据Peng等[22]的研究表明在LUAD中高表达组的患者OS长于低表达组,且差异具有统计学意义,说明LncRNA miR155HG与LUAD预后相关。然而在本组研究中LncRNA miR155HG高表达组OS虽然长于低表达组,但差异无统计学意义,即LncRNA miR155HG与LUAD预后无关。产生两种结果不一致的原因,一方面可能由于两组研究的样本类型不同。另一方面也可能由于随访时间及样本例数的限制。随着未来随访时间的延长及研究相关病例数的扩大,LncRNA miR155HG表达水平与LUAD患者OS之间可能会出现相关性,但目前的研究结果仍然提示LncRNA miR155HG与LUAD的预后无关。
最近几年,有报道称血浆和血清中LncRNA可作为肿瘤特异性生物标记物用于肿瘤检测。LncRNA常形成高度稳定的二级结构,使定量检测体内游离RNA成为可能。更重要的是,一些循环LncRNA已经被证明是肿瘤诊断有价值的生物标志物,如胃癌血浆中的H19,前列腺癌中的尿MALAT-1,这些循环 LncRNA在人体体液中大量富集,可实时检测。目前对于LUAD的常规诊断方法主要为病理检查和血清肿瘤标志物监测,前者只局限于肿瘤体形成时才能检测到,并且为有创检查,对患者造成身心痛苦。而后者对肿瘤监测的特异性和敏感性均不强。血清中LncRNA miR155HG不仅可以为LUAD的早期诊断和治疗提供新线索,还具有无创便捷的优势。
综上所述,本研究首次在LUAD患者血清中检测LncRNA miR155HG,并对其作为LUAD生物标志物的价值进行评价。研究显示,血清中LncRNA miR155HG具有作为LUAD分子标志物的可能性,对其相关机制尚需要后续深入研究。

