生酮饮食对裸鼠人结肠癌皮下瘤生长的影响
王楷,黄思辉,吴腾飞,肖敏,邱振雄(通信作者)
深圳市宝安区中心医院普外科 (广东深圳 518000)

1 材料与方法
1.1 实验动物
10只雄性5周龄SPF裸鼠,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2016-0002。
1.2 主要试剂及仪器
生酮饲料(江苏美迪森生物医药有限公司),HCT116结肠癌细胞(纳生物技术有限公司),TUNEL检测试剂盒(南通碧云天生物技术有限公司),RNA提取试剂盒(北京康为世纪生物技术有限公司),逆转录试剂盒(诺唯赞生物技术有限公司);CFX ConnectTM实时荧光PCR仪[伯乐生命医学产品(上海)有限公司],MF53倒置荧光显微镜(广州市明美光电有限公司),BQ-318D切片机(伯纳生物技术有限公司)。
1.3 裸鼠成瘤及药物处理
对10只雄性SPF裸鼠予以皮下接种HCT116结肠癌细胞(浓度为5×106个/ml,0.2 ml/只),在瘤体为5 mm后,根据瘤体大小将裸鼠随机分为正常饮食组(对照组)及KD饮食组(KD组),每组5只,成瘤前两组均自由进食,成瘤5 mm开始对照组自由进食标准饲料,KD组进食相等能量的生酮饲料,期间隔天记录1次两组的体质量变化,于饮食30 d后,处死两组并测量瘤体组织的大小。
1.4 TUNEL染色
将瘤体组织切片放入65 °C烤箱中烤2 h,然后放置在二甲苯中进行脱蜡,随后将切片依次放入100%乙醇、100%乙醇、95%乙醇、80%乙醇和纯化水中各5 min,再将切片移入湿盒中,在每个样本上滴加50 μg/ml Proteinase K工作液,于37 ℃下反应30 min进行修复,然后用磷酸盐缓冲液(phosphate buffer solution,PBS)充分洗涤3次,5 min/次,用吸水纸吸掉组织周围的PBS;在每张玻片上滴加足够量的脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TdT-mediated dUTP Nick-End Labeling,TUNEL)检测液,于37 °C下避光孵育1 h,然后再用PBS洗涤3次,5 min/次,用吸水纸吸干玻片上的液体,用抗荧光淬灭封片后于荧光显微镜下观察。
1.5 实时荧光PCR
按照RNA提取试剂盒说明书进行RNA提取操作,所有实验用具均经0.1%焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水浸泡并经高压灭活,然后进行RNA含量测定,即取RNA样品并加入99 μl DEPC处理水,用紫外分光光度计测260、280 nm光密度(optical density,OD)值,计算OD260/OD280比值,若此值在1.8~2.0之间,则认为制备的RNA较纯,随后使用逆转录试剂盒将mRNA逆转录为cDNA反应;设计基因特异性引物,釆用20 μl反应体系,尽量在避光条件下加入所需成分,充分混匀,并使所有试剂沉积于管底,随后应用CFX ConnectTM实时荧光PCR仪进行聚合酶链式反应(polymerase chain reaction,PCR)扩增及检测。引物由通用生物系统(安徽)有限公司合成,序列见表1。

表1 引物名称及序列
1.6 Western Blot免疫印迹法检测
将瘤体组织研磨成浆后,加入含有蛋白酶抑制剂的裂解液于冰上裂解30 min,期间每隔5 min剧烈震荡30 s,共震荡150 s,然后经高速离心机以12 000 r/min离心10 min,收集上清液到EP管中,于-80 ℃冰箱内保存备用;采用BCA检测试剂盒(Bicinchoninic acid Protein Assay Kit)测定蛋白浓度并定量,随后将蛋白与上样缓冲液以1︰3的比例混匀,并煮沸变性;配制好5%浓缩胶、10%分离胶,加入电泳缓冲液,拔出梳子,从左至右依次加入各组别的30 μg蛋白样品,以60 V、300 mA电泳至样品到分离胶,后改为以120 V、200 mA电泳至溴芬兰到分离胶最下沿;取出分离胶,并按照海绵垫—三层滤纸—胶—聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF膜)—三层滤纸—海绵垫的顺序夹好湿法转膜1 h;以5%脱脂奶粉室温封闭1 h后,分别加入B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-2相关X(Bcl-2-associated X,Bax)蛋白抗体(1︰1 000)和GAPDH抗体(1︰1 000),在4 ℃冰箱内孵育过夜后,经三羟甲基氨基甲烷盐酸盐+吐温(Tris-HCl+Tween,TBST)缓冲液漂洗3次,分别加入山羊抗兔或鼠IgG二抗(1︰5 000),室温孵育1 h,再次经TBST缓冲液漂洗3次,于暗室中,在膜上滴加增强化学发光液(enhanced chemiluminescence,ECL)显影。
1.7 统计学处理
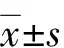
2 结果
2.1 KD对裸鼠结肠癌皮下成瘤的影响
KD组的瘤体重量稍高于对照组,差异无统计学意义(P>0.05),见图1。

注:*表示与对照组比较,P>0.05图1 KD对裸鼠结肠癌皮下成瘤的影响
2.2 KD对裸鼠结肠癌皮下成瘤细胞凋亡的影响
TUNEL染色结果显示,KD组细胞凋亡率高于对照组,差异有统计学意义(P<0.05),见图2。
2.3 KD对裸鼠结肠癌皮下瘤组织中Caspase3和Caspase9 mRNA及Bax和Bcl-2蛋白表达的影响
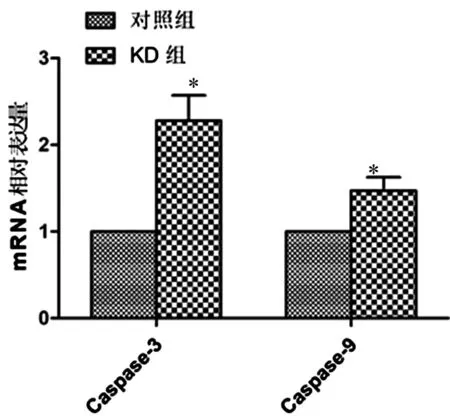
实时荧光PCR结果显示,KD组Caspase3和Caspase9 mRNA表达水平高于对照组,差异均有统计学意义(P<0.05),见图3。Western Blot结果显示,KD组Bax蛋白表达水平高于对照组,Bcl-2蛋白表达水平低于对照组,差异均有统计学意义(P<0.05),见图4。

注:*表示与对照组比较,P<0.05;DAPI为4',6-二脒基-2-苯基吲哚,Apoptosis为细胞凋亡,Merge为融合图2 TUNEL染色检测KD对裸鼠结肠癌皮下成瘤细胞凋亡的影响
注:*表示与对照组比较,P<0.05;Caspase为半胱氨酸天冬氨酸蛋白酶图3 两组瘤体组织中Caspase3和Caspase9 mRNA表达水平的测定
注:*表示与对照组比较,P<0.05;GAPDH为甘油醛-3-磷酸脱氢酶,Bcl-2为B淋巴细胞瘤-2,Bax为Bcl-2相关X图4 两组瘤体组织中Bax和Bcl-2蛋白表达水平的测定
3 讨论
本研究将人结肠癌HCT116细胞接种到雄性裸鼠皮下,制备裸鼠结肠癌移植瘤模型,并对裸鼠予以KD干预,结果显示,干预后,KD组的瘤体重量虽高于对照组,但差异无统计学意义(P>0.05),表明KD干预可延缓结肠癌瘤体的生长,与Hao等[9]的研究结果相似。进一步的TUNEL染色结果表明,KD可促进瘤体凋亡,且有研究发现,KD过程中的中间代谢产物β-羟丁酸可抑制HT29、Caco-2结肠癌细胞及C57BL-6小鼠的mTOR信号通路,并上调肠细胞中肠特异性转录因子表达,继而维持小鼠的肠道稳态[16-17],由此表明,KD干预可延缓结肠癌细胞皮下移植瘤瘤体生长并诱导瘤体凋亡,改善瘤体病理变化。Bcl-2、Bax为Bcl-2细胞凋亡家族的成员,两者相互作用,将信号传代给Caspase家族并诱导级联放大,使细胞凋亡,因此,通过调控上述蛋白的表达,可影响肿瘤细胞的存活。本研究结果亦证实了KD可通过调控Caspase3和Caspase9 mRNA及Bax和Bcl-2蛋白表达,继而促进结肠癌瘤体凋亡。
综上所述,KD可抑制裸鼠结肠癌移植瘤生长,其是通过提高Caspase3和Caspase9 mRNA及Bax蛋白表达水平、降低Bcl-2蛋白表达水平实现的。

