河南临颍某鹅场水源中大肠菌群指标测定
黄志宏,丁 勇,厉 桓,陈 信,詹 妍,张冬萱,乔宏兴
(1.河南牧业经济学院 动物医药学院,河南 郑州 450046; 2.河南农业大学 动物医学院, 河南 郑州 450001)
大肠菌群是指在37 ℃培养24 h后可以发酵乳糖,并产酸产气的一大类需氧及兼性厌氧的革兰氏阴性无芽孢杆菌的总称,大肠杆菌是肠道中普遍存在、数量较多的一类有益菌[1]。大肠杆菌普遍存在于人和动物肠道,作为有益菌可保护肠道的正常生理机能。作为致病性大肠杆菌,当动物转群、免疫、应激等原因引起动物机体抵抗力下降时,会引起大肠杆菌病的发生[2]。致病性大肠杆菌不仅对养鹅业的发展造成严重影响,还引发公共卫生安全和食品安全问题。河南临颍某林下鹅场鹅群时常出现零星死亡病例,剖检病变主要表现为腹膜炎。排除饲料、环境等其他因素,怀疑其鹅场水源大肠杆菌超标。从鹅场内部8口水井进行水样采集,进行水中大肠菌群和pH的测定,分析该场水源中大肠杆菌是否存在超标和水源污染情况,旨在为鹅场大肠杆菌的防控提供参考依据。
1 材料
1.1 水样采集
从河南临颍某鹅场的8口水井采集8份水样,其中1号水井为该鹅场附近城镇的自来水,采集水样深度为100米;2、3、4、5、6号水井位于某羊圈的左下方,均为压力罐井,采集水样深度除5号井约80米、其余4口井的深度均约20多米;7号水井为老办公室压力罐井,采集水样深度约20米;8号水井为孵化场压力罐井,采集水样深度约20多米。采集的水样放置20 mL的玻璃试管中,置于4 ℃冰箱中保存。
1.2 主要试剂
试剂:乳糖蛋白胨培养液(北京陆桥技术股份有限公司),伊红美蓝琼脂(杭州微生物试剂有限公司),革兰氏染液(郑州博赛生物技术股份有限公司),禽流感抗原(河南博士动物药业有限公司)。
2 方法
2.1 多管发酵法
首先确定8口井中水源的污染情况及程度,按照污染程度确认接种量,接种量分别为10 mL、1 mL、0.1 mL,每个接种量做5个重复,用无菌注射器抽取10 mL和1 mL水样分别接种到10 mL的双料乳糖蛋白胨培养管和10 mL的单料乳糖蛋白胨培养管中,再抽取1 mL水样于9 mL的无菌生理盐水中混匀后,抽取1 mL接种到10 mL的单料乳糖蛋白胨培养管中。将所有接种后的发酵管置于37 ℃恒温培养箱中培养24 h,若所有发酵管均无产酸产气则说明该水样中的总大肠杆菌群数为阴性,若有产酸产气的发酵管,则继续进行分离培养试验。将产酸产气的发酵管用平板划线法接种于伊红美蓝琼脂平板上,静置30 min,在37 ℃恒温培养箱内培养24 h后观察菌落形态,挑取具有金属光泽的深紫黑色菌落、不带或略带金属光泽的紫黑色菌落和中心较深的淡紫红色菌落做革兰氏染色、镜检和证实试验。若染色镜检发现该菌落为革兰氏阴性无芽孢杆菌的菌落,则可用接种环挑取该菌落再次接种到乳糖蛋白胨培养液中,于37 ℃恒温培养箱内发酵培养24 h,若发酵管有产酸产气者,这说明该水样中有大肠菌群存在。可根据产酸产气的培养管数量查表确定每100 mL水样中总大肠菌群的最可能数。
2.2 发病场鹅蛋卵黄处理
先于2 mL EP管内加入0.4 mL的16 %氯化钠溶液,然后用移液器取等体积的鹅蛋蛋黄加入EP管内混匀,放置4 ℃冰箱备用。
2.3 血凝抑制试验
严格按照《高致病性禽流感诊断技术》GB/T18936-2003中1%鸡红细胞悬液制备,HA试验和HI试验(微量法)的操作步骤进行[3]。为了验证试验结果的准确性,根据所测效价配置4单位抗原,分别作回归试验检测。
3 结果
3.1 大肠菌群检测结果
根据多管发酵法检测的总大肠菌群阳性的管数,通过查MPN检索表,得出每100 mL所测水样中的总大肠菌群MPN值,结果如表1。试验结果表明检测的八口水井的pH均符合国家畜禽饮用水标准;水井1、2、3、4、6符合国家畜禽饮用水大肠菌群含量标准,而水井5、7、8大肠菌群含量超标。
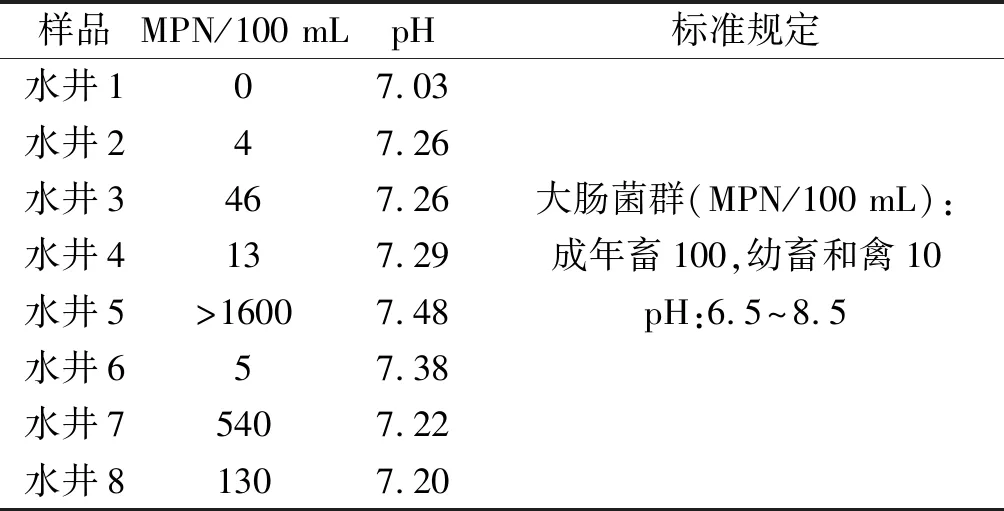
表1 多管发酵发测定水质中大肠菌群的结果
3.2 禽流感抗体水平测定结果
抗体水平测定结果如表2。试验结果表明检测的4份鹅蛋禽流感抗体水平中1、2、3变异系数均比较大,说明其抗体水平较低,特别是同一个鹅舍内鹅群针对禽流感H7的抗体水平差距较大。同时也说明当鹅场水源中大肠菌群超标可使鹅群的免疫力下降,从而导致某些疾病的发生。
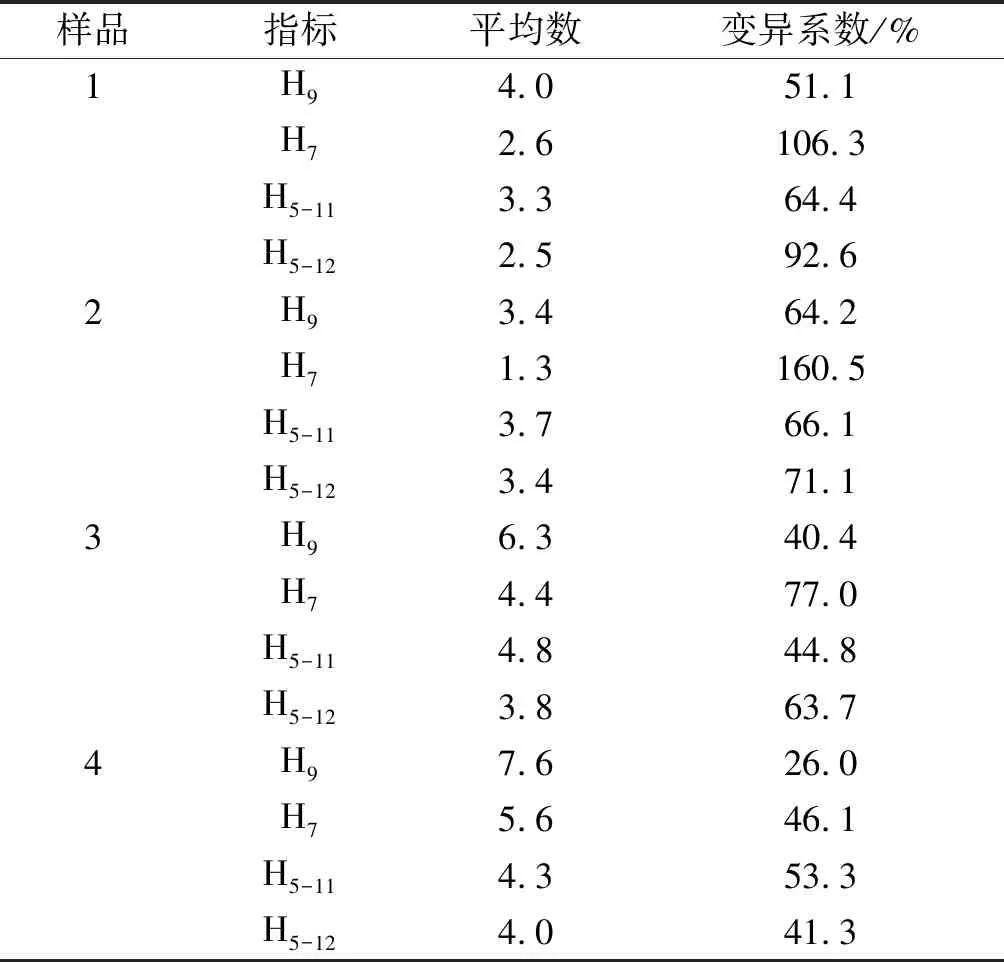
表2 抗体水平检测结果
4 讨论
由于大多数鹅场都是在厂区内打井取水供鹅群饮用,所以水井中大肠菌的含量对鹅群的生产影响重大。因此可通过对水样中大肠菌群的含量进行检测来判断水井的污染情况,从而制定相应的防控措施。同时中华人民共和国农业部颁布的《NY 5027无公害食品畜禽饮用水水质标准》[4],明确规定家禽饮用水的总大肠菌含量≤10个/100 mL,pH的范围在6.4~8.0。
本试验对河南临颍某鹅场内8口水井的水样采用多管发酵法[5,6]检测其大肠菌总含量,结果发现该8口水井中的pH均符合国家畜禽饮用水标准,其中采样深度为100米的1号自来水井和采样深度约20多米的2、3、4、6号压力罐井均符合国家畜禽饮用水大肠菌含量标准,因此可发现远离鹅场的自来水井和消毒效果较好的2、3、4、6号压力罐井污染较少,水质达标。而采样深度约80米的5号压力罐、采样深度约20多米的7号老办公室压力罐井和8号孵化场压力罐井的水样中大肠菌群含量均超过国家畜禽饮用水标准。由此可见,老办公室压力罐井和孵化场压力罐井对于大肠杆菌的消毒效果欠佳,5号压力罐的大肠菌群含量超标可能是由于鹅场内的粪便污染了水井,或者是由于靠近羊圈,粪便渗透土壤污染水源,因此可判定该鹅场发生的零星死亡是由于鹅场内的水井遭受到大肠菌的污染所致,可按照大肠杆菌病的防控措施进行防控。这说明鹅场的选址非常重要,应选择地势高,附近无养殖场,水源不易被污染的环境。
多管发酵法是一种实用范围极广的方法,该方法试验成本相对较低,所需设备价廉简便,同时浊度较大的水样也可用该法进行检测,阳性结果易于辨认[7]。王宣等[8]调查研究发现所测水样的水位在9~13 m深的地下水中,检测的水样总大肠菌群超标率高达75 %~100 %,细菌总数超标率约达25 %~100 %,总大肠菌群数和细菌总数的超标现象异常严重,接触新鲜粪便的土壤中大肠菌群总数可高达105个/g以上。
通过检测该鹅场四个棚舍的鹅蛋禽流感卵黄抗体,发现1、2、3禽流感变异系数较大,说明其抗体水平较低,特别是同一个鹅舍内鹅群对禽流感H7的抗体水平差距较大,感染禽流感的风险较大。同时也说明当鹅场水源中大肠菌群超标时可使鹅群的免疫力下降,从而导致一些疾病的发生。通过研究发现各畜禽场随季节夏、秋、春、冬季而环境污染程度依次降低,但地下水的卫生指标菌数量无明显的季节性变化。只有在疫病流行时,卫生指标菌增多。同时环境污染程度低的畜禽场,种鸭的发病率低,产蛋率高;种蛋受精率高,出雏率高,即环境污染程度与生产性能成负相关[9]。
饮水质量是影响鹅群生产业绩和产品质量的主要因素之一,大多数鹅场的水井都在鹅场内,所以鹅粪有可能导致水井中大肠菌含量超标。因此预防大肠杆菌病首先要将水井打在水塔内,并对水井内的水源做定期消毒和检测水源中的大肠菌群含量是否符合国家标准。尤其在夏天,往水井内添加的营养剂常常会导致水井内的有害微生物的大量繁殖,因此要缩短对水井消毒的时间间隔,有条件的鹅场可使用符合国家畜禽饮用水标准的自来水作为蛋鹅的饮用水[10]。
本试验也存在许多局限性,多管发酵法操作复杂,时间周期长,受干扰因素多,易对试验结果产生影响[11]。同时部分大肠杆菌会出现延迟发酵的情况,需要更长的时间才能得出结果。克服这些局限首先要提高操作者的技能和无菌操作意识,其次要加强对试验设备的控制,同时要严格控制培养条件。
要防制该鹅场的大肠杆菌病,首先可进行生物防控,增强对饲养环境条件的消毒,保持鹅舍的清洁和干燥,加强对鹅舍的通风,保持适当的饲养密度,在传播途径上切断疾病流行的可能。在引进鹅群时,要做到全进全出,在传染源上避免疾病的发生[12]。其次可采用抗生素和中草药进行防控,因为临床上对于抗生素的长期以及不合理使用,导致大肠杆菌对抗生素的耐药性增加,因此在使用药物治疗时要选用一些药物敏感性高的抗生素,在上市前期采用轮换用药和联合用药[13]。而中草药对大肠杆菌的防制则有其独特的效果,中草药防制大肠杆菌最显著的优势是无公害,毒副作用小,不会对人畜健康造成危害,适宜无公害绿色养禽场推广使用。中草药不仅来源广泛,价格便宜,而且使用方便,未来可广泛应用于畜禽疾病的治疗[14]。同时也可从该鹅场分离其致病菌株,制成适用于该场的灭活苗。也可将当地流行的血清型菌株与该鹅场分离出的致病菌株结合制成的多价灭活苗用来防制当地流行的大肠杆菌病[13]。

