营养基质对植物乳杆菌转化纳米硒的影响
王丽红,杨 辉,耿涌喆,苏 文,孔 阳
(陕西科技大学食品与生物工程学院 西安 710021)
纳米硒(SeNPs)具有抗氧化,调节免疫,促进生长,抗癌、抗菌等药理作用,是一种新型的补硒形态[1-4]。微生物可通过同化还原、异化还原和生物群落甲基化等作用,将水体、底泥、土壤等环境中无机硒还原成SeNPs,积累在细胞内或分泌在胞外[5]。微生物对纳米硒的转化具有普遍性,细菌、真菌、放线菌、原生动物均能转化合成SeNPs[6],而且微生物合成的纳米硒颗粒较物理、化学法合成的稳定、分散性好[7-8],具有成本低、毒性小、生物利用度高等独特优势。乳酸菌是一类可以调节生物体肠道内菌群生态平衡,对宿主消化、抗病、抗衰老等有促进作用的微生物菌群,目前报道的可以转化合成SeNPs 的有动物双歧杆菌[9]、保加利亚乳杆菌[10]、乳酸乳球菌[11]、干酪乳杆菌[12]、嗜酸乳杆菌[13]等。课题组前期研究分离到一株植物乳杆菌,对亚硒酸钠耐受能力强、SeNPs 转化率高,具有重要的应用价值。
植物乳杆菌在生长过程中需要的营养基质较复杂,一般采用的配方有MRS、M17、MC 等,在不同营养基质中植物乳杆菌生长良好,并能将亚硒酸钠还原成SeNPs。试验研究发现,常用的植物乳杆菌营养基质对纳米硒具有一定的还原性,在无植物乳杆菌生长繁殖的情况下也可将亚硒酸钠转化合成SeNPs,对微生物还原合成纳米硒有较大的干扰作用。目前有关常用营养基质对微生物合成纳米硒的干扰情况还未见研究报道。本文通过研究合成培养基不同组分对亚硒酸钠的还原情况,确定影响植物乳杆菌合成纳米硒的主要成分,并进一步采用改良培养基质及菌体洗涤处理的方式,避免营养基质对植物乳杆菌合成纳米硒的影响。本研究结果将为微生物合成纳米硒及富硒菌的筛选及应用提供参考。
1 材料和方法
1.1 菌种
植物乳杆菌(Lactobacillus plantarum)由陕西科技大学1C415 实验室分离保藏并鉴定。
1.2 培养基和试剂
MRS 肉汤:葡萄糖20.0 g、牛肉膏5.0 g、硫酸锰0.05 g、蛋白胨10.0 g、乙酸钠5.0 g、硫酸镁0.2 g、磷酸氢二钾2.0 g、吐温80 1 mL、柠檬酸三铵2.0 g、酵母菌粉4.0 g、蒸馏水1 000 mL,分装后121 ℃高压灭菌20 min。
M17:酵母抽提液5.0 g、乳糖20.0 g、牛肉膏10.0 g、葡萄糖2.0 g、磷酸氢二钾2.0 g、吐温80 1 mL、乙酸钠5.0 g、蒸馏水1 000 mL,pH 7.3,分装后121 ℃高压灭菌20 min。
MC:葡萄糖20.0 g、大豆蛋白胨5.0 g、乳糖20.0 g、酵母粉3.0 g、碳酸钙10.0 g、中性红0.05 g、牛肉浸粉3.0 g、pH 值6.0,分装后121 ℃高压灭菌20 min。
亚硒酸钠,山东西亚试剂有限公司;乳糖,成都金山化工试剂有限公司;蔗糖,天津市科密欧化学试剂有限公司。其它试剂均为分析纯级。
1.3 仪器与设备
电子分析天平,赛多利斯科技有限公司;生物显微镜,麦克奥迪实业集团有限公司;紫外-分光光度计,上海光谱仪器有限公司;高分辨场发射扫描电镜(EFI Verios460),美国;透射电子显微镜(H-7650),日本日立公司;高速冷冻离心机,湖南湘仪离心机仪器有限公司;恒温培养箱,重庆试验仪器设备厂;压力蒸汽灭菌器,上海申安医疗器械有限公司;冷冻干燥机(LGJ-15D),北京四环科学仪器厂。
1.4 研究方法
1.4.1 基础培养基对植物乳杆菌转化纳米硒的影响 将活化3 次的植物乳杆菌分别以2%接种量接种于含亚硒酸钠质量浓度1 g/L 的MRS、M17、MC 液体培养基中,其中亚硒酸钠需单独灭菌后加入培养基中,35 ℃厌氧管培养,以相同条件未接种植物乳杆菌的培养基为对照,48 h 后观察发酵醪液中形成的纳米硒的浑浊度及沉淀量,并测定亚硒酸钠的还原率。
1.4.2 基础培养基中不同成分对纳米硒的还原作用 将基础培养基中不同组分即:葡萄糖20.0 g/L、牛肉膏5.0 g/L、磷酸氢二钾2.0 g/L、硫酸锰0.05 g/L、蛋白胨10.0 g/L、乙酸钠5.0 g/L、硫酸镁0.2 g/L、吐温80 1 mL/L、柠檬酸三铵2.0 g/L、酵母菌粉4.0 g/L、乳糖20.0 g/L、酵母抽提液5.0 g/L、牛肉浸粉3.0 g/L、碳酸钙10.0 g/L 单独配制灭菌,然后添加终质量浓度为1 g/L 的亚硒酸钠,48 h 后观察红色纳米硒的形成情况。
将蔗糖20 g/L、磷酸缓冲液(pH 6.4)、0.9%生理盐水、Tris-HCl 缓冲液(pH 6.8)单独配制灭菌,然后添加终质量浓度为1 g/L 的亚硒酸钠,48 h 后观察红色纳米硒的形成情况。
1.4.3 改良培养基对菌体生长的影响 将MRS培养基中葡萄糖换成蔗糖20 g/L,接种2%的植物乳杆菌35 ℃厌氧管培养24 h,以相同条件MRS培养基为对照,采用比浊法,每隔2 h 取出1 mL菌液2 倍稀释后600 nm 波长处测定吸光度,绘制生长曲线,观察菌体生长情况。
1.4.4 改良培养基对植物乳杆菌转化纳米硒的影响 将植物乳杆菌分别以2%接种量接种于含亚硒酸钠1,2,3,4,5,6 g/L 的改良蔗糖MRS 培养基中,35 ℃厌氧瓶培养,以相同条件MRS 培养基为对照,48 h 后观察发酵醪液中形成的纳米硒的红色深浅度及亚硒酸钠的还原率、富硒率。
1.4.5 改良培养方式对植物乳杆菌转化纳米硒的影响 将植物乳杆菌以2%接种量接种于MRS 厌氧瓶中,35 ℃培养11 h,取菌悬液各100 mL,4 000 r/min 离心10 min,分别采用Tris-HCl 缓冲液(pH 6.8)、0.9%生理盐水、磷酸缓冲液(pH 6.4)洗涤3次并重悬于其中,然后添加终质量浓度为1 g/L 的亚硒酸钠,35 ℃厌氧瓶培养,48 h 后观察发酵醪液中形成的纳米硒的红色深浅度及亚硒酸钠的还原率。
1.4.6 纳米硒转化乳酸菌的表征
1)扫描电镜(SEM)+能量分析光谱仪(EDX)观察 将不同处理发酵醪液,高速冷冻离心机离心10 min (10 000 r/min,4 ℃),弃上清液收取沉淀,无菌水洗涤3 次离心得湿菌粉,在-20 ℃下预冻后冻干24 h,进行SEM+EDX 分析。
2)透射电镜观察 (TEM) 将不同处理发酵醪液菌体离心洗涤后,用2.5%戊二醛-多聚甲酸固定液于4 ℃固定2 h,0.1 mol/L 磷酸盐缓冲液浸洗30 min;1%四氧化锇固定液于4 ℃固定2 h,0.1 mol/L 磷酸盐缓冲液浸洗10 min;依次用30%,50%,70%,90%乙醇,无水乙醇脱水;用包埋剂(Epon812-丙酮1∶1)于37 ℃浸泡2 h,再用包埋剂60℃浸泡0.5~1 h;37 ℃聚合12 h,超薄切片50~70 nm;用醋酸铀、柠檬酸铅染色各10 min 后进行。
1.4.7 数据测定与处理
1)亚硒酸钠还原率及富硒率 亚硒酸钠浓度测定采用比色法[14]

富硒率=亚硒酸钠还原率×加硒量
2)数据处理 采用Origin Pro8.5 处理试验数据,结果用平均值±标准差表示。
2 结果与讨论
2.1 基础培养基对植物乳杆菌转化纳米硒的影响
MRS、M17、MC 为常见乳酸菌的培养基,研究接种植物乳杆菌的不同培养基对纳米硒合成影响,并以未接菌的含等量亚硒酸纳的培养基为对照,72 h 后观察发酵醪液浑浊度及沉淀物的量,并测定亚硒酸钠的还原率,结果如表1。
微生物在生长繁殖过程中会还原亚硒酸盐,产生典型的红色悬浮状纳米硒颗粒,使发酵液浑浊,并且随着发酵时间延长,菌体下沉,部分红色颗粒会沉淀于管底。从表1中可以看出,不同培养基在不加菌的情况下对亚硒酸钠均有还原性,引起发酵液的浑浊,形成红色纳米硒沉淀。其中MRS 培养基中形成的红色沉淀较多,其次为MC,M17 培养中产生沉淀最少,同时观察MC 培养基中出现了较多的絮状沉淀,可能是蛋白质产生了絮凝现象,因此,推测3 种培养基中均有能将亚硒酸钠还原的物质,对比不同培养基中菌体生长情况及亚硒酸钠的还原率,相同条件下接种植物乳杆菌的发酵液中亚硒酸钠的转化率较高,说明菌体本身也能转化合成纳米硒,但培养基转化能力也较强,因此对研究植物乳杆菌转化合成的纳米硒有较大干扰作用。在有机硒、纳米硒的微生物转化合成研究中,有关培养基对亚硒酸钠的还原作用一直被忽视[11-13,15],杨靖鹏等[16]采用MRS 的培养基筛选富硒乳酸菌,在富硒后的菌体表面观察到了纳米硒颗粒,但不能排除培养基本身的干扰。

表1 不同培养基发酵液颜色及亚硒酸钠的还原率Table 1 Color of fermentation broth and reduction rate of sodium selenite in different media
3 种基础培养基中MRS 是植物乳杆菌生长的最适营养,相比转化率最高,显微镜1 000 倍观察MRS 无菌和有菌情况下结果如图1,从图中可知未接菌的MRS 培养中大量游离的颗粒,有菌的培养基中菌体周围也有较多的颗粒,两种情况下培养基均呈现红色浑浊状态,因此难以区别纳米硒是由菌体合成的还是由基质还原形成的。

图1 MRS 培养液中纳米硒显微镜观察(1 000×)Fig.1 Microscopic observation of nano-selenium in MRS culture medium (1 000×)
2.2 基础培养基中不同成分对纳米硒的还原作用
通过对比基础培养基中不同组分对亚硒酸钠的还原,结果发现葡萄糖、乳糖组分中出现红色浑浊,葡萄糖的红色物质较乳糖多,其它组分未发现形成红色物质,说明葡萄糖、乳糖是干扰菌体转化合成纳米硒的主要因素。葡萄糖、乳糖属于还原性糖,葡萄糖的结构式中含有5 个羟基和1 个醛基,乳糖是由葡萄糖和半乳糖缩合而成的二糖,分子都含有醛基,醛基具有还原性,乳糖结构中只有葡萄糖保留还原性,因而相同浓度下还原性稍弱,但都可将亚硒酸钠还原为单质硒,醛基自身则被氧化为羧基。进一步研究发现乳糖在高温灭菌前对亚硒酸钠还原性较弱,需要放置96 h 后才能有少量纳米硒形成,但高温灭菌后乳糖水溶液颜色变黄,对纳米硒还原性增强,可能是高温加热使乳糖水溶液发生了部分水解,产生了少量的葡萄糖和半乳糖,二者均具有还原性,因而对亚硒酸钠还原能力增强。
张波等[17]采用水热合成法合成了纳米硒,认为是木质素将二氧化硒还原成纳米硒,但反应过程中添加了大量葡萄糖,很难说明不是葡萄糖的还原作用。而且葡萄糖、乳糖是很多微生物培养基常添加的碳源物质,因此在研究富硒微生物或纳米硒转化菌筛选中,如果基础培养基含有葡萄糖、乳糖,就不能排除培养基质对菌体富硒能力的影响。目前,在微生物还原形成有机硒、纳米硒的报道中[9,18-19],排除培养基中葡萄糖、乳糖还原作用的相关文献还未见报道,因此研究改良培养基对微生物富硒的研究具有重要意义。
将蔗糖20 g/L、蔗糖改良MRS、磷酸缓冲液、0.9%生理盐水、Tris-HCL 缓冲液单独灭菌后添加亚硒酸钠,发现均不能将亚硒酸钠还原,因此可用于后续植物乳杆菌转化合成纳米硒的研究。
2.3 改良培养基对菌体生长的影响
蔗糖是由一分子葡萄糖和一分子果糖组成,不含有游离醛基,因而没有还原性,而且蔗糖易于被微生物分解利用,属于速效碳源。试验通过将MRS 中葡萄糖替换成等量蔗糖,对比其对植物乳杆菌生长曲线的影响,试验结果如图2。
从图2中可以看出,MRS 培养基和改良的蔗糖培养基均能满足菌体的快速增长,在2 h 后进入快速增长期,12 h 后基本达到稳定期,菌体生长快速。但MRS 相比可以有效缩短延滞期,在前8 h生长繁殖较旺盛,而改良培养基在8 h 后也达到了相同的浊度,说明改良培养基对菌体生长没有明显影响,可代替MRS 用于植物乳杆菌的培养。
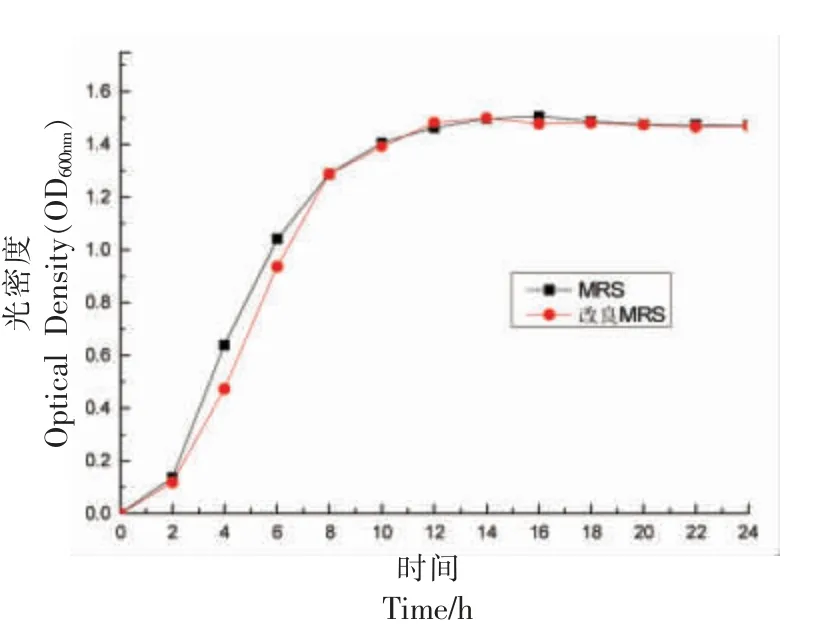
图2 不同培养基中植物乳杆菌生长曲线Fig.2 Growth curve of Lactobacillus plantarum in different media
2.4 亚硒酸钠浓度及改良培养基对植物乳杆菌转化纳米硒的影响
微生物对基质中亚硒酸盐的还原,被认为是菌体的脱毒作用,菌体内谷胱甘肽首先提供电子转化亚硒酸盐形成硒代谷胱甘肽(GS-Se-SG),然后经谷胱甘肽还原酶或硫氧还蛋白还原酶进一步还原,形成不稳定谷胱甘肽硒硫化物(GS-Se-),后经水解形成还原型谷胱甘肽GSH 和单质硒[20],再通过硒因子A(Sef A)分泌到胞外[21]。研究表明植物乳杆菌对亚硒酸钠的耐受能力较强,并在生长繁殖过程中可通过解毒作用转化合成的纳米硒,采用改良MRS 培养基研究不同亚硒酸钠浓度下纳米硒的转化,观察试验现象发现:不同浓度下发酵液均出现红色纳米硒,亚硒酸钠为1~4 g/L 时发酵液呈红色乳浊液,并且底部较多沉淀,但随着亚硒酸钠浓度增大,发酵液开始变澄清,沉淀物减少,说明菌体生长受到一定程度的抑制。亚硒酸钠的还原率及植物乳杆菌的富硒率测定如图3。
从图3可知亚硒酸钠浓度较低时,植物乳杆菌转化率最大,随着亚硒酸钠浓度的增加还原率下降,说明亚硒酸钠对菌体转化产生了一定抑制,但从植物乳杆菌的富硒总收率来考虑,亚硒酸钠质量浓度为4 g/L,收率达到1.3 g/L,因此如果优先考虑菌体活力可采用较低浓度的亚硒酸钠,但高浓度亚硒酸钠可增加植物乳杆菌的富硒率,合成较多的纳米硒。
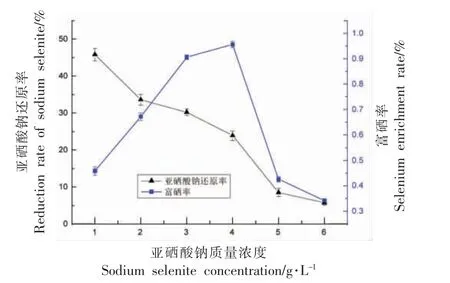
图3 不同亚硒酸钠浓度对植物乳杆菌富硒影响Fig.3 The effect of sodium selenite concentrations on selenium enrichment of Lactobacillus plantarum
显微镜下观察发酵液,MRS 培养液中大量纳米硒颗粒悬浮,而改良MRS 中悬浮颗粒较少,大部分颗粒黏附于细胞表面,由胞内逐渐分泌到胞外。进一步观察扫描电镜如图4,从图中可知MRS培养基合成的纳米颗粒较多,聚集排列,一些颗粒黏附在一起,颗粒大小不一。而改良MRS 形成的纳米硒颗粒分布在菌体的周围,分散性较好,颗粒均匀,由此可见植物乳杆菌转化合成的纳米颗粒更稳定,Butler 等[21]研究表明在纳米硒的表面包覆着蛋白质,为纳米硒合成提供反应位点,同时对纳米硒的稳定起重要作用,防止其聚集长大。植物乳杆菌转化合成的纳米硒分散性好,可能也是因为菌体在繁殖过程中合成的蛋白质的作用,而化学合成一般需要加入模板维持纳米颗粒的稳定[22],因此在MRS 培养基没有加入稳定分散剂,故纳米硒容易聚合形成不稳定的颗粒。

图4 不同培养基植物乳杆菌合成纳米硒电镜图Fig.4 Electron microscope image of nano-selenium by Lactobacillus plantarum in different media
对改良MRS 培养植物乳杆菌转化纳米硒进行能谱分析,结果如图5所示,表明在选定区域主要成分为菌体自身的C、N、O 和硒,因此说明球形颗粒为纳米硒,有些颗粒还黏附在菌体的表面,纳米硒表面可能被蛋白质等物质包覆,同时可见分泌纳米硒的细胞表面凹凸不平,细胞形态发生一些变化,说明细胞在解毒合成纳米硒的过程中对菌体自身产生了一定的毒性。
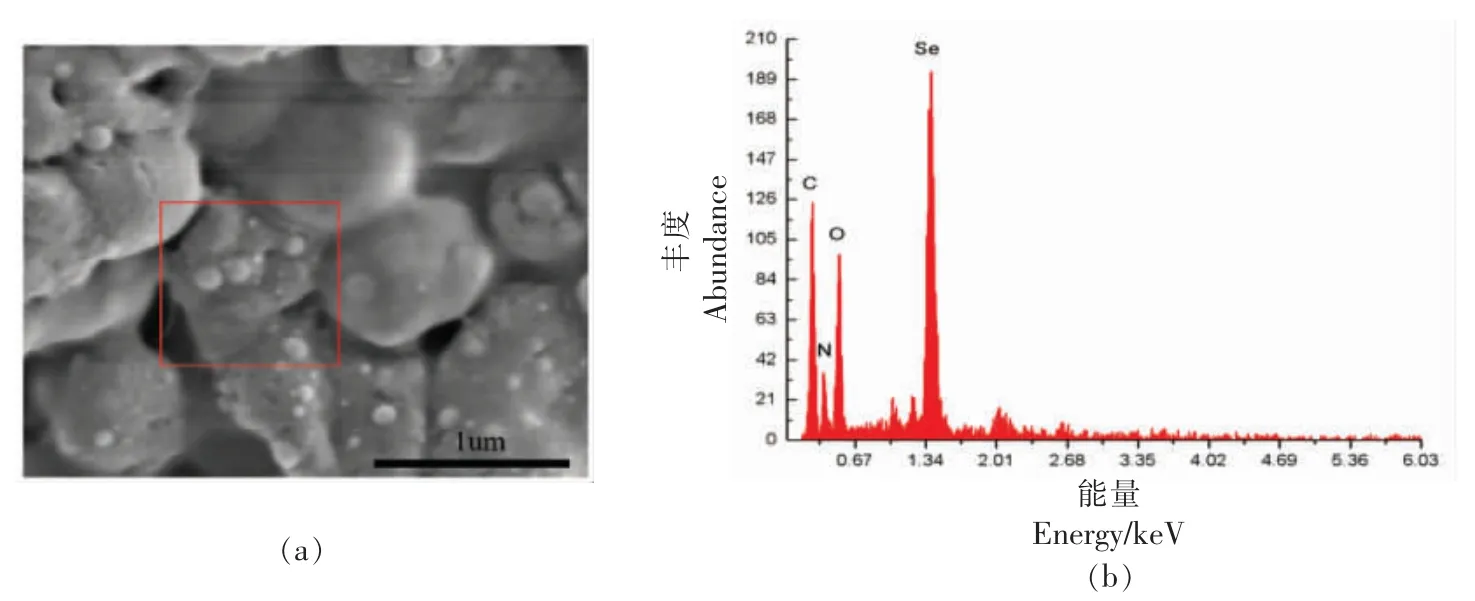
图5 改良MRS 培养植物乳杆菌合成纳米硒能谱图Fig.5 Energy spectrum of selenium nanoparticles synthesized by Lactobacillus plantarum cultured by modified MRS
2.5 改良培养方式对植物乳杆菌转化纳米硒的影响
目前,利用微生物转化合成纳米硒主要都是在菌体生长过程中形成,但培养基中成分较复杂,而且随着细胞的代谢利用,培养基的组分还处于不断变化中,因此对于研究微生物转化合成纳米硒的机理有较大干扰,因此试验通过改良培养方式,采用对数期的植物乳杆菌接种到Tris-HCl 缓冲液、生理盐水、磷酸缓冲液中,研究无营养状态下植物乳杆菌转化纳米硒,为后续合成机理的研究奠定基础,同时也可避免亚硒酸钠对菌体生长的抑制作用。
首先采用基础培养基将菌体培养到对数增长后期11 h,然后离心洗涤后重悬于含有亚硒酸钠的Tris-HCl 缓冲液、生理盐水、磷酸缓冲液,观察结果如图6所示,磷酸缓冲液中植物乳杆菌将亚硒酸钠还原,形成红色纳米硒,亚硒酸钠的转化率7.1%。Tris-HCl 缓冲液、生理盐水中没有纳米硒颗粒形成。Tugarova 等[23]发现生理盐水可促进巴西偶氮螺菌转化合成纳米硒,徐颖等[24]报道盐胁迫可以促进鼠李糖乳杆菌的富硒作用,但生理盐水对植物乳杆菌转化纳米硒没有作用。磷酸缓冲液可以明显促进植物乳杆菌对亚硒酸钠的还原,可能与亚硒酸盐在菌体内的还原机理有关,目前发现不同的酶系统参与了亚硒酸盐在细菌中的还原和SeNPs 的产生,NADH 或NADPH 为电子供体[25],磷酸缓冲液能够促进电子供体的形成,因此有利于用植物乳杆菌转化合成纳米硒。

图6 不同溶液合成纳米硒颜色比较Fig.6 Color comparison of nano selenium synthesized by different solutions
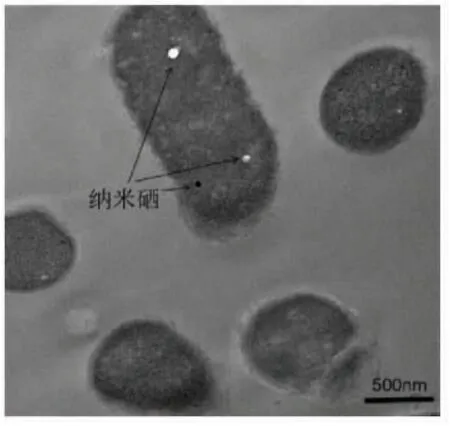
图7 植物乳杆菌合成纳米硒透射电镜图Fig.7 TEM of selenium nanoparticles synthesized by Lactobacillus plantarum
由透射电镜图可以看出,在菌体内散布着微小的纳米硒颗粒,说明纳米硒在菌体内被合成,部分被分泌在胞外,个别颗粒还留在胞内,因而菌体和培养液呈现纳米硒的红色,后续可在此基础上进一步探究植物乳杆菌转化纳米硒的机理。
3 结论
1)在纳米硒微生物合成和富硒菌的研究中,培养基中葡萄糖、乳糖及一些还原性糖可将亚硒酸钠还原成单质硒,影响菌体自身纳米硒的转化。
2)采用蔗糖改良MRS 培养基可避免营养基质中还原性糖的干扰,适合植物乳杆菌生长繁殖,合成的纳米颗粒分散性好、均匀、稳定,并且亚硒酸钠质量浓度为4 g/L 时富硒率较高。
3)将植物乳杆菌洗涤后接种于磷酸缓冲液中,可促进亚硒酸钠转化合成纳米硒,说明磷酸根离子参与了纳米硒的合成,有关植物乳杆菌合成纳米硒的机理还需要进一步探究。

