不同胁迫条件对食品源MRSA菌株生长、毒力和抗性基因表达的影响
屈 云,贺苏皖,朱成林,赵燕英,陈 娟,刘 骥,刀筱芳,唐俊妮*
(1 西南民族大学食品科学与技术学院 成都 610041 2 青藏高原动物遗传资源保护与利用教育部重点实验室 成都 610041)
细菌的应激反应是指细菌对外界环境胁迫表现出的各种特定的、高度调节的适应性反应[1]。这些反应常可以保护细菌不受环境胁迫影响,还可能改变细菌,特别是致病菌对抗生素的耐受性[2]。从食品安全的角度来看,传统食品保鲜和灭菌方法主要依赖于对微生物施加物理或化学压力来限制其生长和存活,常通过加热和冷冻,调节酸、碱值,盐浓度胁迫,清洁剂和消毒剂等的使用对食物携带的微生物施加压力。通常这一系列压力胁迫不一定起到对微生物完全的致死作用,亚致死条件可能会诱导细菌发生应激反应,导致其抵抗力或抗性增加[3]。不断暴发的由致病菌引起的食品安全事件,引起人们对这些环境胁迫下微生物的亚致死、失活以及相关胁迫耐受的重视[4]。
作为食品污染的主要致病菌之一的金黄色葡萄球菌(StapHylococcus aureus,缩写S.aureus),特别是被称为“超级细菌”的耐甲氧西林金黄色葡萄球菌 (Methicillin-resistant StapHylococcus aureus,MRSA),可引起人和动物各种急、慢性感染[5]。2017年世界卫生组织将其列为对人类健康最具威胁的12 种细菌之一[6]。金黄色葡萄球菌的毒力与抗性均促进其在全球范围内的流行与感染。MRSA 对甲氧西林耐药性取决于获得性遗传决定因子mecA,其编码青霉素结合蛋白PBP2a,导致MRSA 几乎对所有β-内酰胺抗生素耐受。即使在高浓度抗生素的存在下,这些外来PBP 的表达也能发挥作用,使得细胞能够继续完成细胞壁的生物合成[7]。值得关注的是,这些获得性因子具有在细菌中诱导应激反应的能力,在应激反应下,MRSA 菌株mecA 的转录和PBP2a 的产生增加[8-9]。本文研究两株不同基因背景MRSA 菌株,在不同胁迫条件下生长及其对菌株抗性和毒力基因表达的影响,以期为食品加工过程不同环境中菌株生长及毒力和耐药性变化提供参考。
1 材料与方法
1.1 材料与试剂
胰蛋白胨大豆琼脂(TSA)培养基、7.5%氯化钠肉汤、Baird-Parker 琼脂培养基、胰酪胨大豆肉汤(TSB)培养基,青岛高科园海博生物技术有限公司;1%亚碲酸钾卵黄增菌液,青岛日水生物技术有限公司;过氧乙酸(15%),成都科龙化工试剂厂;次氯酸钠(有效氯5.5%),成都科隆化学品有限公司;新洁尔灭(有效氯5%),南昌白云药业有限公司;氢氧化钠、浓盐酸、氯化钠,成都市科龙化工试剂厂;Spin Column Bacteria Total RNA Purification Kit 试剂盒、2X SG Fast qPCR Master Mix 试剂盒、M-MuLV First Strand cDNA Synthesis Kit 试剂盒,生工生物工程股份有限公司。
1.2 仪器与设备
CFX96 荧光定量PCR、BioSpec-nano230V 核酸测定,美国Bio-Rad;5840R 型冷冻离心机,德国Eppendorf 公司;MOF-4086S 低温冰箱,日本三洋公司;HZQ-F160 全温振荡培养箱,江苏太仓市实验设备厂;隔水式恒温培养箱 GHP-908,上海齐欣科学仪器有限公司;洁净通风工作台,苏州安泰空气技术有限公司。
1.3 菌株来源
以本实验室在2017年9月-2018年6月分离于成都市猪肉样本中的MRSA6 与MRSA18 菌株作为研究对象,MRSA6 携带的背景基因为:耐药 基 因(tetM、ermB、mecA、norA、aac6’/apH2’’),耐消毒剂基因(qacG),肠毒素基因(sei、seo、seu、sen、sem);MRSA18 携带的背景基因为:耐药基因(ermB、mecA、norA、aac6’/apH2’’),不携带耐消毒剂基因和肠毒素基因。所有试验参考菌株均由本实验室保存。
1.4 方法
1.4.1 最小抑菌浓度(MIC)的测定 将纯化的菌株接种到TSB 培养基中,37 ℃振荡培养18~24 h,采用文献报道方法提取菌株DNA[10],对菌株携带的背景基因情况进一步进行PCR 扩增确认。两株MRSA 菌株对3 种不同消毒剂的最小抑菌浓度(minimum inhibitory concentration,MIC)测定参考美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)[11]指南,采用营养肉汤稀释法配制菌悬液。具体操作为:取过夜培养后浓度为1×108CFU/mL 的菌液50 μL 分别加入到4.5 mL 的TSB 的试管中,另加入450 μL 稀释后消毒剂。设置阳性对照组为50 μL 菌液+4.5 mL TSB+450 μL 去离子水;阴性对照组为:去离子水50 μL+4.5 mL TSB+450 μL 过氧乙酸。37 ℃恒温振荡培养18~24 h。根据消毒剂推荐使用浓度用去离子水配置消毒剂浓度梯度分别为过氧乙酸:0.0038%,0.0075%,0.015%,0.03%;次氯酸钠(按有效氯计算):0.0425%,0.085%,0.17%,0.34%;新洁尔灭(按有效氯计算):0.0000625%,0.000125%,0.00025%,0.0005%,0.001%的受试液。结果判定:阳性对照组由清澈透明变浑浊,阴性对照依旧清澈,试验组中无菌生长对应的最低消毒剂浓度即为受试MRSA 菌株对该种消毒剂的MIC。
挑取单菌落于Baird-Parker 琼脂平板上纯化培养后接入TSB 培养液中37 ℃,150 r/min 过夜培养后再次以1%比例接种到新的TSB 培养液中,37 ℃恒温培养留作原始菌液备用。
1.4.2 不同胁迫条件对菌株生长的影响 模拟食品加工过程中常遇到的胁迫环境,观察MRSA 的生长变化趋势。
高低温胁迫:取30 支试管设置5 个试验组,每组设置3 个平行,分别加入MRSA6 与MRSA18菌液各2 mL,一组置于4 ℃冰箱中,低温胁迫24 h。另4 组分别放入45,50,55,60 ℃水浴处理30 min,同时取原始菌液2 mL 作为对照,平板稀释涂布,测定活菌数。
酸碱胁迫:同样设置5 个试验组,每组设置3个平行,分别加入MRSA6 与MRSA18 菌液各2 mL,6 000 r/min 离心5 min,去上清液,每组分别加入使用HCl 或NaOH 将pH 值调为2,4,6,8,10的TSB 培养基,混匀,室温静置培养1 h,同时取原始菌液(pH 7.2)2 mL 作为对照,平板稀释涂布,测定活菌数。
高渗透压胁迫:取24 支试管设置4 个试验组,每组设置3 个平行,分别加入MRSA6 与MRSA18 菌液各2 mL,同上条件离心,去上清,分别向TSB 培养基加入体积分数为0.75%,25%,30%,35%的氯化钠模拟高渗透压环境,0.75%盐浓度为对照组,室温静置培养1 h。平板稀释涂布,测定活菌数。
1.4.3 胁迫处理对MRSA 抗性基因及毒力基因表达影响
1.4.3.1 胁迫处理 消毒剂胁迫处理:取18 支无菌试管设置3 个试验组,每组设置3 个平行,分别加入MRSA6 与MRSA18 菌液各4.5 mL。再向每组分别加入过氧乙酸、次氯酸钠或新洁尔溶液,使其终浓度为1/2 MIC,37 ℃恒温振荡培养24 h。培养结束后,收集菌体。对照组3 个平行为4.5 mL TSB 菌液+500 μL 去离子水。
低温胁迫处理:取MRSA6 与MRSA18 菌液各5 mL,低温胁迫24 h,收集菌体。
酸胁迫处理:取MRSA6 与MRSA18 菌液各5 mL,6 000 r/min、离心5 min,吸去上清液后加入等体积用1 mol/L 的HCl 溶液调节成pH 4 的TSB培养基,37 ℃培养24 h,收集菌体。
碱胁迫处理:取MRSA6 与MRSA18 菌液各5 mL,6 000 r/min、离心5 min,吸去上清液后加入等量1 mol/L 的NaOH 溶液调节至pH 10 的TSB 培养基,37 ℃培养24 h,收集菌体。
MRSA 的高渗透压胁迫:取MRSA6 与MRSA18 菌液各5 mL,6 000 r/min、离心5 min,吸去上清液后加入等体积NaCl 体积分数为20%的TSB 培养基,模拟MRSA 在食品加工过程中可能遇到的高渗透压环境,37 ℃培养24 h,收集菌体。
1.4.3.2 提取细菌总RNA 按照试剂盒说明书,使用细菌总RNA 抽提试剂盒提取胁迫前后细菌的总RNA,收集所得的RNA 溶液于-80 ℃保存,防止其降解。
1.4.3.3 反转录第一条链的合成 采用核酸浓度测定仪测定核酸浓度,A260/A280比值评估核酸纯度,再按照试剂盒提供的M-MuLV 第一条cDNA链合成试剂盒操作方法配制对应的体系,反转录得到cDNA,-80 ℃保存。
1.4.3.4 相关基因的表达量检测 按照2X SG Fast qPCR Master Mix(SYBR Green)试剂盒操作说明,测定MRSA 菌株胁迫前后相关的表达量。反应程序为:95 ℃,3 min;95 ℃,5 s;60 ℃,30 s;72℃,30 s,40 个循环。相关引物序列见表1。

表1 引物序列Table 1 Primmer sequences

(续表1)
1.4.4 数据处理与统计分析 胁迫处理前后菌株生长计数结果换算成菌株生长对数值加以分析,数据采用SPSS19.0 统计软件处理,采用Microsoft Excel 绘制图表。相关基因表达量检测通过胁迫前后对应的Ct 值,以金黄色葡萄球菌16S rRNA 为内参基因进行归一化,并通过2-△△Ct法计算目的基因的相对表达量。
2 结果与分析
2.1 3 种消毒剂对MRSA 的最小抑菌浓度
选取食品加工环节及工厂环境中3 种常见的消毒剂:过氧乙酸、次氯酸钠和新洁尔灭测定其对菌株的最小抑菌浓度,3 种消毒剂对MRSA6 和MRSA18 的MIC 值无差异,并且测定结果均远小于消毒剂推荐使用浓度,结果详见表2。
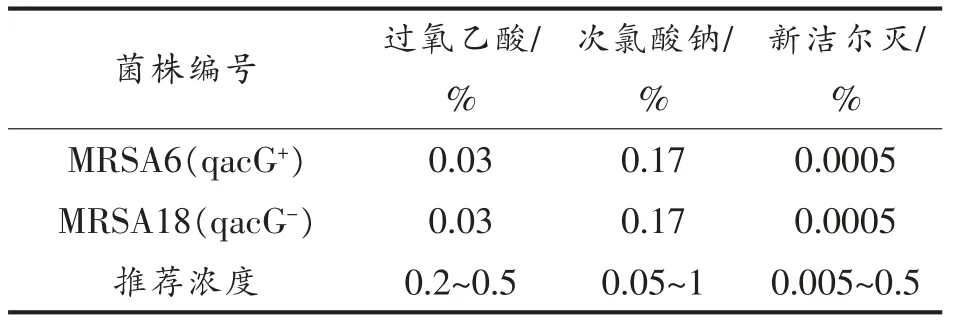
表2 消毒剂对MRSA 的最小抑菌浓度Table 2 The minimum inhibitory concentration (MIC)value of disinfectant
2.2 不同胁迫环境对菌株生长影响
2.2.1 温度对MRSA 生存状况的影响 分别在4℃低温环境以及45,50,55,60 ℃高温水浴环境对MRSA 进行胁迫,并与常温(37 ℃)培养下MRSA菌株的生长情况作对照。结果如图1所示,在经过5 h 的4 ℃低温胁迫后,MRSA6 菌株生长对数值为9.1,与之前(9.127)相比无明显差异(P>0.05);MRSA18 在胁迫后出现增殖现象,生长对数值从8次方(8.727)达到了9.014,差异明显(P<0.05)。在45 ℃的胁迫环境下,MRSA6 的生长对数值为8.991,MRSA18 的生长对数值为8.952,差异不明显(P>0.05);在50 ℃时,MRSA6 的生长对数值为8.885,MRSA18 生长对数值为8.881,差异不明显(P>0.05);在55 ℃时,两菌株生长均受到抑制,出现显著变化(P<0.05);60 ℃胁迫30 min 后,菌株存活率均为0,达到了杀菌效果。
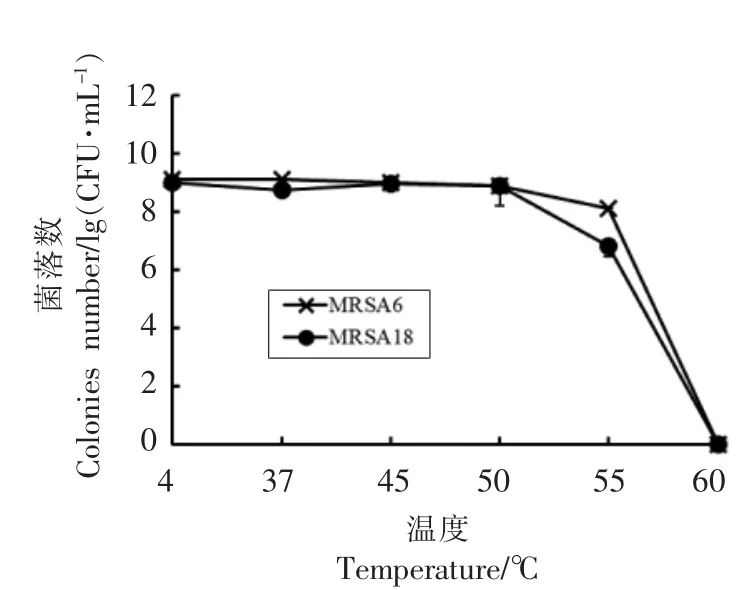
图1 低温及高温胁迫对MRSA 菌株生长的影响Fig.1 Effects of low temperature and high temperature stress on the growth of MRSA strains
2.2.2 酸碱胁迫对MRSA 菌株的影响 以pH 2,4,6,8,10 模拟MRSA 在食品加工过程中可能遇到的酸碱环境,与在普通培养基环境(pH 7.2)下生长的菌株作比较。结果如图2所示。在pH 值为2 的低酸环境,菌株均不能生长,在pH 值为4 时,菌株生长对数值无明显变化(P>0.05),但在pH 6的胁迫环境下,MRSA 6 的生长出现了降低,但仍在9 次方以上。在pH 值为8 时,菌株生长趋势无明显变化(P>0.05)。在pH 10 的环境下胁迫1 h后,MRSA18 出现增长,生长对数值为9.008(P<0.05),而MRSA6 生长趋势保持不变。除pH 2 外,弱酸和弱碱对MRSA 的生长影响不大。
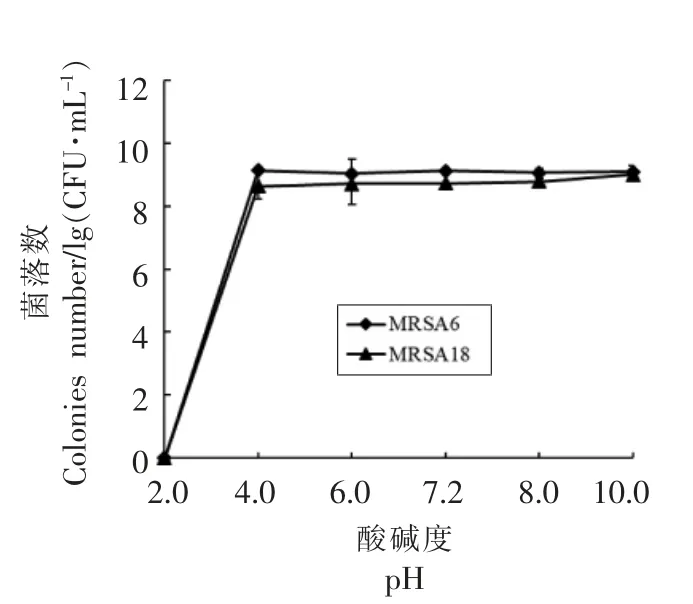
图2 酸碱胁迫对MRSA 菌株生长的影响Fig.2 The effect of acid-base stress on the growth of MRSA strains
2.2.3 高盐浓度环境对MRSA 生长的影响 本研究以盐体积分数分别为25%,30%,35%的培养环境模拟NRSA 在食品加工过程中可能碰到的高渗透压环境,观察高压胁迫可能对其生长造成的影响。并以普通培养环境 (盐体积分数0.75%下MRSA 的生长对数值为参考。在盐体积分数为25%和30%的环境下胁迫1 h 观察到MRSA 生长对数值下降,维持在109与108存活,胁迫后与胁迫前的存活率不存在显著差异(P>0.05)。但在盐体积分数为35%的环境作用下,MRSA6 的生长对数值从109下降为108.758,MRSA18 为108.591,两株菌的生长对数值均有所下降,且差异显著(P<0.05)。结果表明MRSA 对氯化钠的耐受度较高。
2.3 胁迫处理对MRSA 抗性基因表达影响
荧光定量PCR 检测不同胁迫条件前后MRSA6 与MRSA18 携带抗性基因的表达差异,结果如图4所示。经过新洁尔灭胁迫后MRSA6 和MRSA18 的mecA 基因表达水平增加(P<0.05),且经过低浓度酸(pH 4)胁迫的MRSA6 菌株mecA基因的表达也出现上调。经过氧乙酸以及新洁尔灭胁迫后,MRSA6 的qacG 基因表达上升(P<0.05)。但低温胁迫及过氧乙酸胁迫后MRSA6 菌株的抗性基因表达无明显变化,除新洁尔灭刺激作用外的所有胁迫方式均对MRSA18 的mecA 基因表达产生抑制作用。
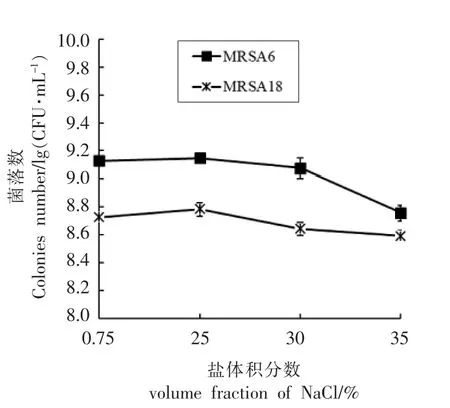
图3 高盐胁迫对MRSA 菌株生长的影响Fig.3 The effect of high salt stress on the growth of MRSA strain

图4 不同胁迫条件下两株MRSA 菌株抗性基因相对表达量Fig.4 Relative expression of resistance genes of two MRSA strains under different stress conditions
经过氧乙酸胁迫作用后,MRSA6 菌株的norA、ermB 和tetM 基因分子表达水平明显上调(P<0.05),次氯酸钠胁迫后,MRSA6 的各耐药基因表达量均明显减小(P<0.05),新洁尔灭刺激下,MRSA6 的norA 及aac6’/apH2’’基因表达水平上调,但tetM 和ermB 影响不大。冷胁迫和高渗透压对耐药基因的表达起抑制作用,MRSA6 的ermB 基因在碱环境下表达有所上升。MRSA18 在新洁尔灭胁迫刺激下,norA 和ermB 基因表达上升,其它基因表达均受胁迫环境抑制。
2.4 不同胁迫环境对菌株肠毒素基因表达影响
胁迫对MRSA6 携带的5 种肠毒素基因表达的影响结果见图5,结果表明:除sen 在胁迫环境下表达水平无明显变化外,其它肠毒素基因在新洁尔灭胁迫环境下均出现表达水平上调(P<0.05),低温胁迫对5 种肠毒素基因的表达影响不大,在高渗透压影响下,所有的肠毒素基因表达均被抑制,显著下降(P<0.05),其它环境胁迫对MRSA 的肠毒素基因分子表达水平均有不同程度抑制作用。

图5 不同胁迫下MRSA6 菌株肠毒素基因相对表达量Fig.5 Relative expression of enterotoxin gene in MRSA6 strain under different stress
3 讨论
食品加工环境中亚损伤细菌仍然具有生物活性,在一定的条件下能够修复并增殖,为食品安全保障带来隐患[19-20]。本研究以MRSA 菌株作为研究对象,通过模拟不同胁迫条件对金黄色葡萄球菌的生长及毒力和抗性基因表达影响,为食品加工过程病原菌的控制提供参考。
首先,采用食品加工过程常使用的3 种消毒剂过氧乙酸、次氯酸钠和新洁尔灭,测定MRSA 菌株对消毒剂的MIC 值,检测结果均小于消毒剂推荐使用浓度,说明正确规范使用消毒剂可有效杀灭MRSA 菌株。在本研究中,0.03%的过氧乙酸可以充分抑制MRSA 菌株生长。张友平等[21]采用0.2%的过氧乙酸浓度擦拭MRSA 1 min 后,其存活率为0。说明过氧乙酸能够有效杀灭MRSA 菌株,并且其使用浓度和作用时间成反比,结合本研究结果也可适当延长作用时间降低过氧乙酸使用浓度达到有效杀菌抑菌效果。季铵盐类消毒剂较小浓度可起到较好杀菌作用,两株MRSA 菌株(qac+和qac-) 对季铵盐类消毒剂新洁尔灭的MIC 值测定结果均为5 μg/mL。Seier-Petersen 等[22]检测出苯扎溴安对MRSA 的MIC 为1~8 μg/mL,与本研究检测结果相符。由于细菌携带qac 基因家族可表达多种外排泵,使细菌对季铵化合物的敏感性降低[23]。但本研究中,两株MRSA 菌株(qac+和qac-)对新洁尔灭的MIC 值一致,推测编码季铵盐类抗性的耐消毒剂基因对表型影响依赖于多种因素,其抗性机制还需深入探讨。
金黄色葡萄球菌对低温具有良好的适应性[2]。本研究中,低温胁迫后,两株菌株生长均不受影响。随着温度的升高,MRSA18 在45 ℃及50 ℃出现短暂增殖,但在55 ℃和60 ℃时明显被抑制。有研究表明,金黄色葡萄球菌在45 ℃处理一段时间后,对极端环境的耐受能力会增长[24]。猜测MRSA18 也可能对苛刻环境表现出一定的应激反应。受试菌株对氯化钠的耐受性较高,在盐体积分数35%情况下依旧可存活。该浓度下,MRSA 的生长对数值虽明显下降但其生长被抑制程度不高。pH 2 的酸环境中MRSA 基本不生长。但碱性环境有可能促进MRSA 的生长,pH 4、pH 6 和pH 8时,菌株生长趋势差异不大,当pH 值到达10 时,MRSA18 出现了明显的增殖。目前关于金黄色葡萄球菌对于碱的耐受性的报道较少,有研究表明,金黄色葡萄球菌对盐和碱性pH 值环境具有高耐受性主要是由于在质膜中发现反向转运蛋白的活性,可从细胞质中除去有毒阳离子,并使金黄色葡萄球菌在不同的胁迫条件下存活[25]。关于在碱性环境下细菌的增殖机制尚未明确,仍需进一步的研究和探讨。
MRSA 具有特有的mecA 基因,存在于移动遗传元件葡萄球菌染色体盒mec(SCCmec)上。mecA基因的表达主要由调控因子MecI (DNA 结合阻遏蛋白)和MecR1(信号转导子)调控[26]。新洁尔灭作为一种阳离子季铵盐类消毒剂,其主要作用机制是通过改变菌体菌膜的通透性,使菌体破裂,蛋白质变性从而起到杀菌效果[27],这种与β-内酰胺类抗生素杀菌模式相似的消毒剂胁迫可能是本研究中mecA 基因表达上升的主要原因。也可能是阳离子对mecR1 蛋白的表达产生影响,介导了mecA 的表达与转录。同时,MRSA6 菌株的qacG抗性基因表达也显示出明显的升高,猜测这两种外排机制相似的转运系统可能会发生相互作用。过氧乙酸作为一种广谱、高效的灭菌剂,在过氧化氢的协助下可顺利通过细菌通透性屏障,进而使细菌的RNA、DNA 和蛋白质等物质破坏漏出,致细菌死亡。Chang 等[28]的研究发现,金黄色葡萄球菌暴露在过氧乙酸亚致死剂量后,诱导许多毒力基因的表达,提示金黄色葡萄球菌的毒力可能会发生变化以响应过氧乙酸的刺激。本研究发现,在过氧乙酸1/2MIC 的胁迫下,MRSA6 的norA、ermB及tetM 基因表达水平均显著上调,说明过氧乙酸可能对MRSA 外排因子调控存在影响,但菌株MRSA18 并没有表现出上述现象,具体机制尚不明确,仍需进一步追踪研究。编码抵抗喹诺酮外排蛋白质的norA 基因,编码抗四环素跨膜蛋白tetM基因等与qac 基因互为功能合作伙伴[29],推测MRSA6 在新洁尔灭及碱性环境刺激下,耐药基因的表达水平上升的原因可能是各种外排蛋白泵共同参与结果。
在肠毒素基因分子表达检测中,除sen 外,大部分的肠毒素基因在新洁尔灭刺激下表现出表达量相对上升的现象。结合之前报道中金黄色葡萄球菌在抗生素作用下毒力水平会发生改变[30],推测肠毒素基因与耐药基因外排蛋白等机制之间可能也存在相互联系。本研究表明不同的消毒剂亚抑制胁迫对菌株的毒力及抗性基因的表达有促进也有抑制。新洁尔灭对MRSA 菌株的毒力及抗性基因几乎都有促进作用。综上,本研究揭示了食品加工过程中常规胁迫处理方式对MRSA 的生长及相关基因表达的影响,为食品行业病原菌的控制提供理论依据。

