EGCG修饰对乳清蛋白乳液冷凝胶特性的影响
曹艳芸,林金瓯,韩剑众
(浙江工商大学食品与生物工程学院 杭州 310018)
蛋白质的乳化和凝胶特性对于维持食品的感官和质构具有重要的意义。比如:在冰淇淋、舒芙蕾、泡沫饮料这些乳液和泡沫形态的食品中,往往通过添加蛋白质作为表面活性剂,帮助形成和稳定食品体系[1]。蛋白质乳液凝胶可作为营养活性物质的传递载体。冷凝胶技术是一种较新的食品凝胶制备技术,在室温下便可以形成凝胶,更适用于构建热敏感性营养成分的载体,其在功能性食品和医药等领域应用也愈加广泛。目前有研究表明利用乳清蛋白冷凝胶对维生素E、益生菌等生物活性物质进行包埋,其运输传递效果良好[2]。使用蛋白凝胶珠对核黄素进行包埋时,其包埋率能达到80%以上[3-5]。
然而,通常蛋白质冷凝胶在成胶时所需要的蛋白质浓度比较高,凝胶强度比较低,并且包裹在内部的脂质容易被氧化[6]。许多研究者通过向体系中添加天然植物多酚以提高乳液凝胶的氧化稳定性,并取得良好的效果。Zhou 等[7]通过在鱼糜中添加茶多酚来改善鱼糜凝胶强度、持水性和蛋白交联度。Chen 等[8]研究发现丁香提取物可以促进肌原纤维蛋白的交联,从而增强其凝胶的流变性质。同时,植物多酚的添加能够有效提高食品体系的附加营养价值。据报道[9],多酚与蛋白质反应在一定程度上降低食品中的营养价值,降低蛋白质在体内、体外的消化率。多酚化合物对蛋白质功能特性的影响亦不可忽视。
乳清蛋白是加工生产奶酪或者酪蛋白过程中产生的副产物[10],它具有良好的加工特性和生物活性[11-14]。乳清蛋白中含量高的β-乳球蛋白在天然状态下很难被胃蛋白酶水解,并且它与多酚发生相互作用后其消化性也会发生变化[15]。乳清蛋白是构建乳液凝胶传递系统良好的蛋白质壁材[16-18]。
茶多酚是广泛应用于食品加工的天然抗氧化剂之一[19],具有良好的水溶性,其中表没儿茶素没食子酸酯(EGCG)是茶多酚中含量最高、抗氧化活性最强的多酚类单体。Cao 等[20]发现,没食子酸和表没食子儿茶素没食子酸酯在一定浓度范围均有利于乳清蛋白在两相界面的吸附,并加强冷凝胶形成过程中蛋白聚集体的交联。
目前关于植物多酚对蛋白质乳液凝胶特性影响的研究很多,根据反应条件、蛋白质以及多酚种类不同等试验条件不同,研究结果有所出入[21-23];对乳液凝胶特性影响的研究不够充分,有待深入探究。本文以乳清分离蛋白(Whey Protein Isolate,WPI)为蛋白质模型,探究EGCG 对乳清蛋白乳液冷凝胶特性的影响规律,为利用植物多酚提高蛋白质乳液凝胶特性,开发新型食品功能因子载体提供科学依据。
1 材料与方法
1.1 材料与试剂
金龙鱼玉米油,丰益贸易(中国)私人有限公司;乳清蛋白BiPRO,美国Davisco 有限公司;表没食子儿茶素没食子酸酯(EGCG),南京春秋生物工程有限公司;磷酸二氢钠、十二烷基硫酸钠(SDS)、尼罗红(19123)、Na2EDTA、快绿(Fast Green),美国Sigma 公司;磷酸氢二钠、无水氯化钙(CaCl2)、三羟甲基氨基甲烷(Tris),Aladdin 公司;β-巯基乙醇,Acmec 公司。
1.2 设备与仪器
T-18-D-S25 高速剪切机,德国IKA 公司;JY92-IIDN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;UV-2600 紫外分光光度计,日本岛津公司;MS3000 激光粒度仪,马尔文仪器有限公司(英国);KND-816 自动凯氏定氮仪,上海纤检仪器有限公司;SP-8 激光共聚焦显微镜,Leica公司;TA-XT2i 质构仪,STABLE MICRO SYSTEM公司;SU-8010 扫描电镜,Hitachi 公司。
1.3 试验方法
1.3.1 乳清蛋白乳液凝胶的制备
1.3.1.1 多酚对蛋白质修饰 乳清蛋白粉末(NWPI)均匀地溶解于去离子水中得到10%(质量分数)的NWPI 溶液。在室温下,用磁力搅拌器在转速为300 r/min 下搅拌1 h。为了让蛋白质充分水化,将室温下完全溶解的NWPI 溶液置于4 ℃冰箱中保存过夜。用1 mol/L 的NaOH 或HCl 调节蛋白溶液pH 值至7.0 后将其置于85 ℃的水浴锅中加热20 min 得到热变性乳清蛋白 (HWPI)溶液。乳清蛋白经热处理后,内部疏水基团暴露,有利于蛋白质胶凝,是制备蛋白质冷凝胶的重要步骤。HWPI 溶液冷却至室温后与多酚溶液进行下一步反应。
EGCG 贮液(10 mmol/L)为新鲜配置并冷藏,使用前稀释至适当浓度。
在中性(pH 7.0)条件下,HWPI 溶液与EGCG溶液均匀混合,使溶液中EGCG 终浓度分别为0.2,1,2 mmol/L,溶液中蛋白质量浓度为75 mg/mL(及2.7,13.3,26.6 μmol 多酚/g 蛋白),轻微振荡后在室温反应2 h。
1.3.1.2 乳液制备 HWPI-EGCG 溶液(乳清蛋白质量浓度为75 mg/mL)和金龙鱼玉米油按体积比3∶1 加至50 mL 离心管中,终体积为20 mL。用装有低起泡性探头的高速剪切分散机在转速13 600 r/min 下预乳化2 min 得到粗乳液(乳清蛋白质量浓度为56.25 mg/mL)。为了防止超声过程中温度过高对乳液造成影响,将装有粗乳液的离心管置于装满碎冰的玻璃杯中,用超声细胞破碎仪进行进一步分散得到HWPI-GA 乳液。超声条件设定如下:6 号探头;超声开启5 s,关闭5 s;超声功率40%(240 W),超声时间共10 min。
1.3.1.3 乳液凝胶制备 取一定量的HWPI-GA/EGCG 乳液于定制的玻璃小管中,用移液枪缓慢地注入凝胶剂CaCl2(终浓度为7.5 mmol/L),然后顺时针轻搅30 s,逆时针轻搅30 s,以免在搅拌混匀的过程中带入气泡从而对凝胶产生影响。最后将玻璃小管小心地放在固定的盒中,置于4 ℃冰箱中成胶48 h。每组凝胶制作3 个平行。
1.3.2 乳液结构和特性表征
1.3.2.1 界面蛋白吸附量测定 利用凯氏定氮法测定原乳液和上清中的蛋白质含量。用KDN-816自动定氮仪对新鲜制备的乳液进行凯氏定氮,测定其蛋白含量。界面吸附蛋白含量测定公式如下:

式中:V总——滴定新鲜乳液所用盐酸体积,mL;V清——滴定乳液离心后的下清溶液所用盐酸体积,mL;下清溶液通过乳液采用3 次高速离心进行相分离后得到,具体方式如下:于4 ℃下采用离心力14 000 g 离心25 min,用注射器吸取初次离心得到的下清溶液;用相同的方法和相同的离心条件,再离心2 次得到3 次离心后的下清液。
1.3.2.2 乳液平均粒径和ζ 电位测定 用马尔文3 000 粒度仪测定乳液的粒径和ζ 电位。参考Wang 等[24]的方法,进行少许改进。在测试前,取30 μL 乳液于5 mL 离心管中,加入3 mL 磷酸钠缓冲液(0.1 mol/L,pH 7.0)进行稀释,以免乳液浓度过高而产生多重散射效应。取1.5 mL 稀释后的样品加入样品池,关闭仪器盖子后开始对样品的粒径和ζ 电位进行分析测定。测定的参数如下:设定磷酸钠缓冲液折射率为1.34,乳液折射率1.450,测试温度为22.5 ℃,激光衍射角为173°广角,扫描前平衡时间为60 s,扫描时间为10 s,每两次扫描间隔时间为10 s,每个样品扫描3 次。
1.3.2.3 激光共聚焦显微镜分析乳液微观结构采用激光扫描共聚焦显微镜(Confocal laser scanning microscope,CLSM) 来表征HWPI-EGCG 乳液。用50 μL 快绿(1 mg/mL 溶解于去离子水)对乳液中蛋白质进行染色,用50 μL 尼罗红(1 mg/mL溶解于丙酮)对乳液中脂肪染色。染色在避光条件下进行。取20 μL 染色后的样品滴于载玻片上,盖上盖玻片静置10 min 后用激光共聚焦显微镜成像系统进行拍照。扫描条件设置如下:20 或40 倍物镜,用633 nm 处的CY5 通道来激发快绿染色的蛋白质,用488 nm 处的FITC 通道来激发尼罗红染色的脂肪。
1.3.3 乳液凝胶特性分析
1.3.3.1 凝胶强度测定 用TA-XT Plus 质构仪测定凝胶强度。质构仪的参数设置如下:探头型号选择P/0.5,触发力为2 g,下压速度为0.8 mm/s,下压距离为1 cm,测试前速度2 mm/s,测试后速度5 mm/s。将凝胶发生破裂时所测量到的感应力作为凝胶强度。
1.3.3.2 凝胶持水性测定 将HWPI-EGCG 乳液凝胶置于4 ℃冰箱中放置24 h 后测定凝胶的持水性。具体方法如下:称取一整块完整的凝胶置于10 mL 离心管中,质量控制在1 g 左右,准确记录凝胶质量为Ma。在4 ℃,8 000 g 离心力条件下离心30 min 后,小心地从离心管中取出凝胶置于吸水纸上,并用吸水纸小心地擦干其表面残留水分,以免弄碎或黏留在吸水纸上,然后称重并准确记录其质量为Mb。凝胶的持水性用离心后的凝胶质量占原凝胶质量的百分比来表示,公式如下:

1.3.3.3 凝胶作用力分析 凝胶中的相互作用力分析参考Tang 等[25]的方法,略微加以修改。将HWPI-EGCG 乳液凝胶分别溶解在4 种溶液中,通过比较凝胶在4 种溶液中溶解度的不同来反映其作用力类型。4 种溶液分别为:A 液:蒸馏水;B液:pH 值为8.0 的缓冲液,其中含有0.086 mol/L Tris,0.09 mol/L 甘氨酸和4 mmol/L Na2EDTA;C液:B 液+2.0 g/100 mL 十二烷基硫酸钠(SDS);D液:C 液+1 g/100 mL β-巯基乙醇(β-ME)。用小刀将乳液凝胶切成0.5 cm×0.5 cm×0.5 cm 的凝胶小块。在玻璃瓶中称取1 g 凝胶小块,然后加入15 mL 对应的A、B、C、D 溶液,在4 ℃条件下用磁力搅拌器慢速搅拌1 h。然后将溶液转移至离心管,以300 g,4 ℃条件下离心20 min。离心后溶液形成两层:上层为凝胶层,下层为乳液层。用针筒吸取下层乳液,并用去离子水将下层乳液稀释至一定浓度,然后在波长500 nm 处用紫外分光光度计测定溶液的吸光度。浊度(T)计算如下:

式中:A——在500 nm 处的吸光度(×稀释倍数);L——光程长度,cm。
1.3.3.4 扫描电子显微镜观察凝胶微观结构 用Hitachi SU-8010 型扫描电镜来观察HWPIEGCG 乳液凝胶。在扫描之前,需要对凝胶样品进行预处理:1)双固定:首先将样品先后在2.5%的戊二醛溶液和1%的锇酸溶液中固定,最后用pH 7.0 的磷酸缓冲液漂洗样品;2)脱水:用梯度浓度(包括30%,50%,70%,80%,90%,95%和100%)的乙醇溶液对双固定后的样品进行脱水处理;3)干燥:将脱水后的凝胶在Hitachi HCP-2 型临界点干燥仪中进行干燥。
1.3.4 数据分析 试验均设置3 组平行对照,且重复3 次。试验数据采用Statistix9.0 进行方差分析,用LSD 程序检验是否存在显著性差异(P <0.05)。结果表示为平均值±标准偏差。
2 结果与讨论
2.1 EGCG 对乳液性质的影响
2.1.1 乳液平均粒径和ζ 电位 图1a 为不同浓度EGCG 修饰对蛋白质乳液粒径的影响,由图中可以得到,与对照组相比,低浓度的EGCG 加入使乳状液粒径略微增大,而中、高浓度的EGCG 使乳状液粒径变小。平均粒径小的乳液中,多酚和蛋白质可以更有效地吸附在油水界面上,使乳液体系更稳定。
图1b 为不同浓度EGCG 修饰对蛋白质乳液Zeta 电位的影响,由图中可以得出,与对照组相比,EGCG 的加入使蛋白质乳液的Zeta 电位绝对值变大,且随着EGCG 浓度的增加,乳液Zeta 电位的绝对值逐渐增加。乳液的Zeta 电位可以反映乳液中吸附在油-水界面的蛋白质分子之间的排斥力[26]。乳液的Zeta 电位绝对值越大,乳液液滴间的斥力越大,从而阻止了乳液液滴的聚集,防止出现蛋白质絮凝。
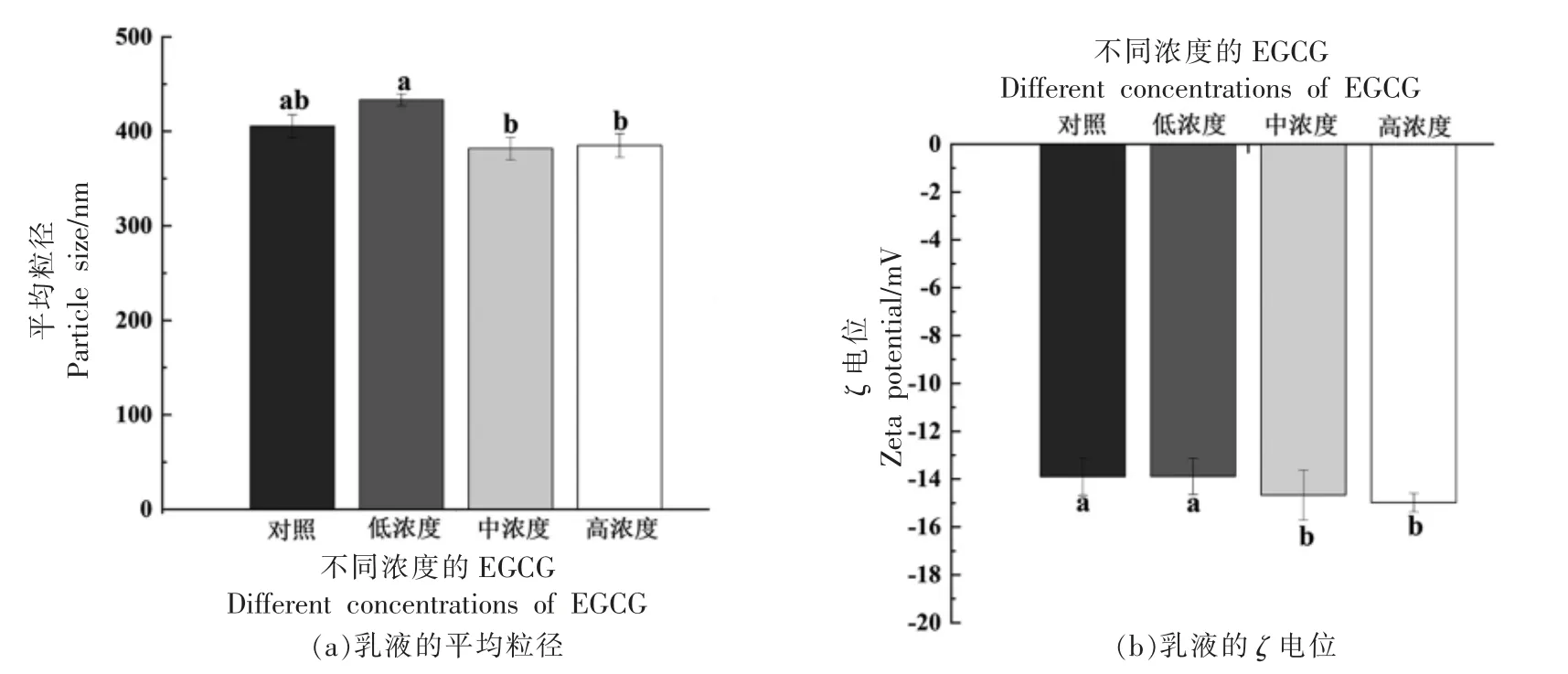
图1 与不同浓度EGCG 反应后,蛋白质乳液的粒径和Zeta 电位Fig.1 Particle size distribution and zeta potential of emulsion treated by different concentrations of EGCG
所以综合乳液粒径和Zeta 电位的结果来看,中、高浓度EGCG 对蛋白质修饰使其形成的乳液更加稳定。
2.1.2 蛋白质界面吸附量 图2为不同浓度EGCG 修饰对蛋白质乳液中界面蛋白吸附的影响。从图中可以看出,与对照组相比,EGCG 的加入增加了蛋白质乳液中界面蛋白吸附量,且随着EGCG 浓度的增加,乳液的界面蛋白吸附量增大。其中,在高浓度条件下,EGCG 的加入使乳液的界面蛋白吸附量增加了9%,增加最显著。这是由于EGCG 的化学结构中的多个疏水性苯环和亲水性羟基基团有利于界面吸附膜的表面性质,所以EGCG 与HWPI 反应后增加了蛋白质的界面吸附量。

图2 与不同浓度EGCG 反应后乳液中界面蛋白的含量Fig.2 The content of interfacial protein in emulsion treated by different concentrations of EGCG
2.1.3 乳液微观结构的观察 图3为乳液的CLSM 微观结构图。从图中可以看出,与对照组相比,EGCG 的添加使HWPI 乳液油滴分布更均匀,且随着EGCG 浓度的升高,乳液液滴粒径变小,该趋势与乳液平均粒径结果相一致。Sabouri 等[27]研究发现,与未加入EGCG 的乳液相比,加入了EGCG 的乳液的界面弹性模量显著提高,更有利于乳液界面的稳定性。多酚改变了HWPI 的微观结构,使其形成的乳液液滴平均粒径减小,液滴表面带电量增大,体系趋于稳定。另外,在高浓度条件下,EGCG 的加入使乳液中的蛋白质基质呈现一种聚集状态。

图3 与不同浓度EGCG 反应后HWPI 乳液的CLSM 图Fig.3 CLSM images of HWPI emulsion treated by different concentrations of EGCG
2.2 EGCG 对乳清蛋白乳液冷凝胶特性的影响
2.2.1 凝胶强度和凝胶持水性 由图4a 可以看出,与对照组凝胶相比,低浓度EGCG 的添加使乳液凝胶的凝胶强度减弱,中、高浓度EGCG 增强了乳液凝胶的凝胶强度。Jongberg 等[28]发现,低浓度的绿茶提取物增加了肉乳液凝胶在蒸煮过程中的损失并且降低了其凝胶强度,该结论与低浓度EGCG 组凝胶强度趋势一致。Feng 等[29]研究发现,高浓度的EGCG 能够增强肌原纤维蛋白凝胶的凝胶强度,说明高浓度的EGCG 有利于蛋白质的胶凝。
从图4b 中可以看出,EGCG 的加入对HWPI形成的乳液凝胶持水性影响较小,各组之间不存在显著性差异。

图4 与不同浓度EGCG 反应后HWPI 形成的乳液凝胶的凝胶强度和持水性Fig.4 Gel strength and water holding capacity of emulsion gel formed by HWPI treated by different concentrations of EGCG
2.2.2 凝胶中相互作用力分析 由图5a 可以看出,对照组凝胶中几乎不含静电作用力,EGCG 的加入明显增加了HWPI 形成的乳液凝胶中的静电作用力,且随着多酚浓度的升高,凝胶中静电作用力逐渐增强。由于EGCG 的结构中具有多个羟基,EGCG 与HWPI 反应后体系中的带电基团增多,从而使其形成的凝胶中静电作用力增强。该结果与Zeta 电位的趋势一致。
由图5b 可知,与对照组相比,低浓度EGCG的加入减弱了凝胶中的疏水作用力,而中、高浓度EGCG 明显增强了凝胶中的疏水作用力,其中高浓度EGCG 组凝胶中的疏水作用力最大。由乳液微观的CLSM 结果可知,高浓度EGCG 组乳液中蛋白质基质聚集现象最明显,从而使其形成的凝胶中疏水作用力最大。凝胶中疏水作用力是决定凝胶性质的重要作用力,其结果与凝胶强度的趋势一致。
从图5c 中可以看出,与对照组相比,EGCG的加入使HWPI 乳液凝胶中二硫键的作用减弱。蛋白质中的自由氨基侧链组(赖氨酸)、巯基组(半胱氨酸),羰基化合物和其它氨基酸残基(色氨酸、脯氨酸、蛋氨酸、组氨酸、酪氨酸等)都会因为蛋白质与多酚相互结合而减少[30],而巯基的损失不利于蛋白质胶凝过程中形成二硫键。但是在中、高浓度条件下,EGCG 对乳液凝胶中二硫键的影响较小。这可能是由于中、高浓度的EGCG 增强了凝胶体系内的疏水作用力,从而使蛋白质分子之间相互作用增强,增加了巯基与二硫键之间的转化。另外,由Ali 等[31]的结果推测,中、高浓度的EGCG 可能诱导HWPI 的构象发生改变,使得多酚与蛋白质巯基之间接触几率增加。

图5 与不同浓度EGCG 反应后HWPI 形成的乳液凝胶中的作用力Fig.5 The force in the emulsion gel formed by HWPI treated by different concentrations of EGCG
2.2.3 扫描电镜对凝胶微观结构的观察 图6为乳液的三维网络结构SEM 图像。从图中可以看出对照组乳液凝胶的微观结构表面较粗糙,表面孔隙大小不一,孔隙分布不均匀。与对照组相比,高浓度EGEG 组乳液凝胶的微观结构表面孔隙数量明显增多,且孔隙减小,分布更加均一,凝胶表面变得平整。Line 等[32]发现凝胶的持水性与其结构中的孔隙大小有关,具有较大孔隙的凝胶对水的结合性较小,凝胶持水性较低。从图中可以看出多酚组凝胶的孔隙大小与对照组差别不大,该结果与凝胶持水性的结果一致。

图6 与高浓度EGCG 反应后HWPI 形成的乳液凝胶SEM 微观图像Fig.6 SEM microscopic images of emulsion gel treated by high concentration of EGCG
3 结论
本文围绕EGCG 与蛋白质相互作用对乳清蛋白乳液冷凝胶特性的影响规律展开研究工作。研究结果显示,EGCG 的添加使蛋白质乳液的粒径变小,乳液体系中液滴分布更均匀,这与乳液液滴间静电斥力增大有关;添加EGCG 可以使得乳清蛋白乳液冷凝胶的微观结构更为致密和均匀,支撑凝胶的疏水作用力、静电作用力均增强,从而显著增强了凝胶特性。总的来看,EGCG 浓度越高,影响程度越大。由此表明,高浓度的EGCG 有助于使蛋白质乳液更加趋于稳定,乳液冷凝胶的凝胶特性得到提升。

