胰蛋白酶水解羊血清蛋白工艺研究
张娅俐,洪 晶,张 棚,田晓静,曹 竑,丁功涛,罗 丽
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.西北民族大学 生物医学研究中心 中国-马来西亚国家联合实验室,甘肃 兰州 730030;3.甘南牦牛乳研究院,甘肃 合作 747000)
我国是羊肉生产和消费大国,2018年其产量为475万吨[1-2].随着人们生活水平的提高,羊肉消费量逐年增高[3].我国养殖业发展较快,畜产品加工产生大量血液等副产品,一般占畜禽活体重的4.0%~9.8%[4],活羊屠宰加工过程中产生的羊血副产物,约占羊总重的4%[5].甘肃省属全国五大牧区之一,拥有丰富的羊血液资源[6].但多数屠宰企业将其直接排放掉,羊血利用率极低,造成资源浪费和环境污染等问题,极大地限制了羊血资源的综合利用[7].
羊血蛋白主要以血红蛋白为主,含有人体必需的8种氨基酸、多种微量元素、少量葡萄糖、无机盐等,营养全面且具有良好的医疗保健作用[8].为满足消费者对蛋白质资源的需求,我国积极发展深加工的畜禽血液.羊血的利用从羊血肠、羊血豆腐、血粑等低附加值的传统产品[9-10]逐渐转化为功能性肽、血红素铁、超氧化物歧化酶、凝血酶[11]等高附加值产品.随着酶制剂生产的发展,通过酶解将其转化为蛋白质水解物成为了一种较为理想的方法[12].蛋白质水解可以获得大量的生物活性肽,这种肽主要以低肽吸收的形式存在,不仅为人体提供生长、发育所需的营养素,而且还可以预防和治疗疾病,调节人体功能[13-16].目前国内外有关利用植物蛋白[17-18]和动物蛋白[19-20]进行蛋白酶水解生产多肽的研究较多,但对藏羊血清水解肽的研究少有报道.为了保护环境,防止污染,提高血液资源的利用率,急需对屠宰废弃物进行无害化处理和利用.合理处理羊血不仅可以解决环境污染和资源利用等问题,还可以提高羊血的综合利用价值.
本试验以胰蛋白酶水解藏系绵羊血清蛋白为材料,以水解度(Degree of hydrolysis,DH)为指标,研究pH、温度、时间和加酶量四个因素对藏系绵羊血清水解度的影响.利用酶水解技术并通过响应面实验优化其酶解条件,提高血液资源转化利用率,以期为藏羊血资源和藏羊血清功能多肽的开发利用提供理论依据.
1 材料与方法
1.1 材料与试剂
真空冷冻干燥处理为粉状的藏系绵羊血清蛋白(购自青海省海西州天峻县);胰蛋白酶(250 U/mg,购自北京瑞达恒辉科技发展有限公司中生瑞泰);三氯乙酸(AR,天津市大茂化学试剂厂);茚三酮(AR,天津市大茂化学试剂厂);正丁醇(AR,无锡市亚盛化工有限公司);氢氧化钠(AR,天津市博迪化工有限公司);盐酸(AR,珠海市华成达化工有限公司).
1.2 仪器与设备
分光光度计(型号为722E,购于上海光谱仪器有限公司);恒温水浴锅(型号为HWS28,上海-恒科学仪器有限公司);磁力搅拌器(GL-3250B,江苏其林贝尔仪器制造有限公司);高速台式冷冻离心机(TGL-16M,湘仪离心机仪器有限公司);精密pH计(PB-10型,Sartorius公司);冻干机(LabconcoFreezoneil,上海比朗仪器有限公司).
1.3 试验方法
1.3.1 制备藏羊血清蛋白酶解液基本工艺
取5.0 g藏系绵羊血清蛋白于容量瓶,定容至100 mL,调节pH至10.0,并加入9 000 U/g胰蛋白酶.在温度为55 ℃的条件下进行水解5 h,并于95 ℃水浴灭酶15 min,于室温下冷却加入2 mL10%三氯乙酸后,8 000 r/min离心15 min,取上清液待用.
1.3.2 测定水解度方法
采用茚三酮比色法[18]测定样品中氨基酸含量,并以公式(1)计算水解度.为消除不同氨基酸因呈色不同而对测定造成的误差[19-20],本试验以甘氨酸为标品做标准曲线.公式中采用待水解原料的完全水解液作标准.水解度计算公式
DH(%)=(AS-A0)/(A1-A0)×100
(1)
式中:As为酶解液中的游离氨基总含量(mmol);A1为原料蛋白强酸水解后的游离氨基总含量(mmol);A0为原料蛋白中固有的游离氨基总含量(mmol).
以甘氨酸含量(mg)为x轴,吸光值为y轴绘制标准曲线,曲线的回归方程为y=0.008x+0.0435,R2=0.9928.由图1可见,在0~200 mg范围内呈良好的线性关系.

图1 甘氨酸标准曲线
1.3.3 胰蛋白酶活力测定
采用福林法[21]测定胰蛋白酶活力.
1.3.4 单因素试验设计
在藏羊血清蛋白水解工艺基础上,为优化其水解效果,以藏羊血清蛋白水解度(DH)为评价指标,在藏系绵羊血清蛋白溶液浓度5%,胰蛋白酶液浓度1%的条件下,分别研究加酶量(5 000 U/g、7 000 U/g、9 000 U/g、11 000 U/g、13 000 U/g)、pH(7.0、8.0、9.0、10.0、11.0)、水解时间(2 h、3 h、4 h、5 h、6 h)和温度(45 ℃、50 ℃、55 ℃、60 ℃、65 ℃)对水解度的影响.
1.3.5 响应面试验设计
在单因素试验基础上采用响应面设计,运用Box-Behnken中心组合实验设计原理[22].根据单因素试验结果,筛选出对水解度有显著影响的三个因素:温度(A)、pH值(B)、水解时间(C),并进行三因素三水平响应面试验,试验设计如表1所示.

表1 Box-Behnken试验设计
1.4 数据分析
采用Origin 2019软件绘图,实验数据利用SPSS Statistics 22.0 和DesignExpert7.1.6进行统计分析,结果以“平均值±标准误”表示.
2 结果与分析
2.1 单因素试验结果
2.1.1 加酶量对藏羊血清蛋白水解度的影响
由图2(a)可知,加酶量在5 000~13 000 U/g范围内,水解度随酶加入而升高.加酶量到达9 000 U/g后,随着加酶量的增加其曲线呈平缓上升趋势.底物充足时,随着加酶量增加,提高了酶与底物的接触率,使反应体系的水解度升高.当加酶量超出一定范围后,由于酶浓度逐渐接近饱和,使酶解速度增加趋于饱和[23],此时,进一步增加酶用量对反应速率影响不大.从耗能和生产成本考虑,选择最适加酶量为9 000 U/g.
2.1.2 pH对藏羊血清蛋白水解度的影响
每一种酶都有其适合的pH作用范围,过酸或者过碱都会改变酶空间构象使酶失活[23].由图2(b)可知,pH在7.0~11.0范围内,藏系绵羊血清蛋白的水解度曲线随着pH升高逐渐上升至最高点后下降.当pH=10.0时,水解度最大,酶活力也最大,与底物作用最充分,且蛋白水解率显著高于其他pH(P<0.05),因此选择最适pH为10.0.
2.1.3 水解时间对藏羊血清蛋白水解度的影响
由图2(c)可知,随着水解时间增加,酶与底物作用充分,水解度逐渐增加,水解5 h后水解度变化较为缓慢.随着水解时间继续延长,产物浓度增加,对酶的抑制作用增加,使得酶活力下降,从而使水解变慢[24].综合考虑经济效益和生产时间,选择水解时间5 h为最佳时间.
2.1.4 温度对藏羊血清蛋白水解度的影响
温度对胰蛋白酶的水解度影响较大,由图2(d)可知,温度在45~65 ℃范围内,水解度随温度升高逐渐上升至最高点后急剧下降,且当温度为55 ℃时,水解度达到17.87%为最大.当温度达到60 ℃后继续升温,胰蛋白酶逐渐酶变构失活,使水解度急剧下降.因此胰蛋白酶水解藏系绵羊血清蛋白反应温度55 ℃为最适温度.

(a)加酶量对水解度的影响;(b)pH对水解度的影响;(c)反应时间对水解度的影响;(d)温度对水解度的影响
2.2 响应面试验结果分析
2.2.1 建立回归模型及方差分析
选取藏系绵羊血清蛋白溶液浓度5%,由单因素试验结果可知,加酶量9 000 U为最适量.在实际生产过程中加酶量越多,生产成本就会增加,因此在响应面中不考虑加酶量因素.以藏系绵羊血清蛋白水解度(DH)为指标,选取温度(A)、pH值(B)、水解时间(C)进行三因素三水平的响应面试验.Box-Behnken试验设计及其试验结果见表2,回归方差分析结果见表3.采用Design-Expert进行数据分析,以水解度为响应值,得到胰蛋白酶水解藏系绵羊血清蛋白回归方程如下:
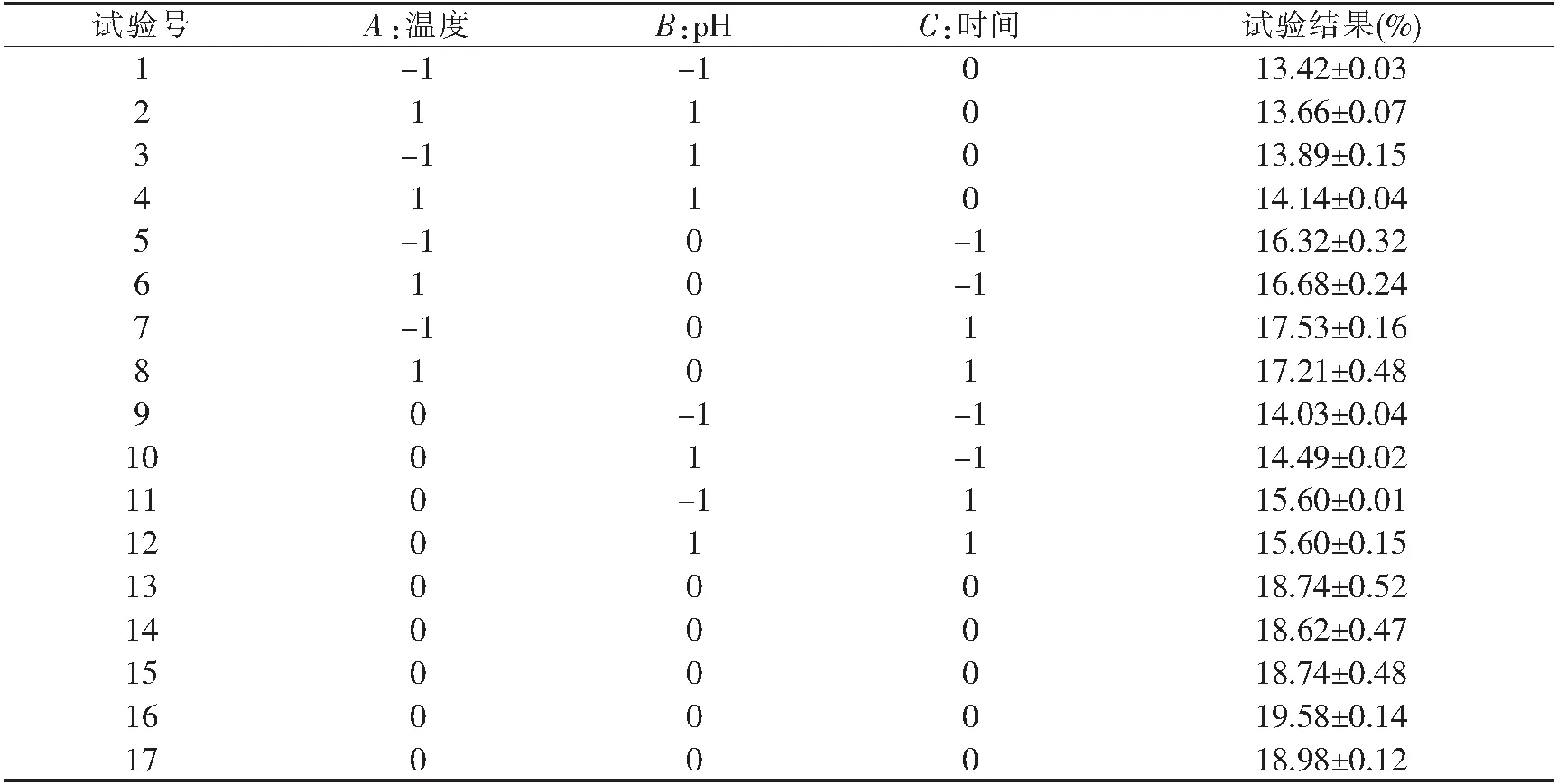
表2 Box-Bchnken试验设计与实验结果

表3 二次多项模型方差分析表
Y=18.93+0.067A+0.18B+0.55C+1.125E-0.03AB-0.17AC-0.12BC-1.57A2-3.58B2-0.42C2.


表4 回归方程系数显著性检验
2.2.2 响应面交互作用分析
为更直观地反映两两因素交互作用对胰蛋白酶水解效果影响,根据回归方程绘制出其响应面图和等高线图,结果如图3所示.
各因素交互作用对响应值影响程度的强弱与响应面坡度和等高线密集度有关.等高线图中椭圆排列密集说明因素变化对胰蛋白酶水解效果影响大,圆形时交互作用较弱[25].由图3可以看出,各图均开口向下,呈凸形曲面,都存在极值.由图3(a)可知,pH值对胰蛋白酶水解效果影响大于温度.由图3(b)可知,水解时间对胰蛋白酶水解效果影响大于温度.由图3(c)可知,水解时间对胰蛋白酶水解效果影响大于pH.由图3(a)、(b)、(c)可知,BC交互作用的响应曲面坡度最陡峭,且其等高线图椭圆率高,表明pH和时间的交互作用对胰蛋白酶水解效果影响最显著.温度和pH等高线图形状较圆,表明温度和pH的交互作用对胰蛋白酶水解效果影响不显著.等高线形状趋于椭圆形,说明两两因素交互作用明显.因此,各因素对水解度影响顺序依次为:C(水解时间)>B(pH)>A(温度).其结果与方差分析结果相同,证明该模型可靠性高.

图3 两因素交互作用对水解度的影响
2.2.3 最优条件预测及验证
根据上述试验结果和二次多项回归方程,利用Design-Expert软件获得了在加酶量为9 000 U/g,底物浓度为0.5%时,最优水解条件为温度54.95 ℃、pH 10.01、水解反应时间5.65 h.在此条件下得到的水解度平均值为19.22±0.28%,与模型的预测值接近.为了试验方便,将最佳的水解条件调整为反应时间5.6 h,温度55 ℃,pH10.0,在此条件下水解度可达到19.32±0.21%[36].
3 讨论与结论
血液作为优质蛋白资源,经酶解后可用于高价值产品生产,而通过酶处理技术可提高我国羊血资源的回收利用.曹效海等[26]为充分利用藏羊血液资源,采用抗凝、过滤、喷雾干燥等工艺制得血粉;祝霞等[6]利用碱性蛋白酶酶解1 L羊血可提取3.93 g血红素.由此可见,羊血水解产物的二次利用具有广阔的应用前景.潘红梅[27]研究了猪血浆蛋白的酶解条件,评价了酶解物的水解度,筛选出胰酶为最佳水解用酶,并采用正交试验设计优化了胰酶水解猪血浆蛋白的条件,本试验结果与其最佳条件相似.吴立国[28]对酶解羊血浆蛋白的制备工艺进行优化,验证后得到水解度为18.35±0.87%,本试验水解度结果相对高于已有结果.酶促反应体系中,pH值、温度、时间等对酶的催化活性都有较大影响.因此,探究胰蛋白酶对羊血清蛋白的最佳酶解条件,可避免酸碱水解羊血清蛋白生产的周期长、污染环境等缺陷,还能够变废为宝,具有较好的经济价值.
本研究通过单因素试验和响应面法优化了胰蛋白酶水解羊血清蛋白条件,得到最佳酶解条件为:反应时间5.6 h,温度55 ℃,pH 10.0.在此条件下水解度可达到19.32±0.21%,与模型的预测值接近.本研究可提高酶水解藏羊血清蛋白的利用率,通过利用酶水解技术来实现屠宰废弃血液资源综合利用,为藏羊血清的开发利用提供了思路.
通过优化胰蛋白酶水解羊血清蛋白条件,可合理利用畜禽血液资源,适合大规模生产,进而提高羊血液利用率.在解决环境污染问题上,将畜禽血液合理加工化,大力开发畜禽血液资源,变废为宝,使畜禽血液加工向多元化、系列化和高附加值方向发展,已成为血液加工的重要研究目标.但酶法水解畜禽动物蛋白制取抗氧化活性肽的研究仍处于初级阶段,还存在不少问题,有待于进一步研究.

