奶牛乳房炎源大肠埃希氏菌噬菌体的分离与生物学特性分析
常军帅,杨瑞钰,戴小智,屈勇刚*,梁 晏*,李 娜,赵 玉,王紫阳,张小玉
(1.石河子大学动物科技学院,新疆石河子 832003;2.动物疾病防控兵团重点实验室,新疆石河子 832003)
奶牛乳房炎(Cow mastitis)是指奶牛乳腺内的各种炎症反应,临床发病率为33.41%,是影响我国奶牛业发展的三大疾病之一[1]。目前世界上已确定的引发奶牛乳房炎的病原微生物达150多种。在我国,由致病性大肠埃希氏菌引发的奶牛乳房炎占10.60%~36.94%,主要诱发环境型乳腺炎,多发生于干乳早期及泌乳高峰期,可导致乳品质和产乳量下降[2-5]。目前缺少用于预防奶牛乳房炎的有效疫苗,治疗仍以抗生素为主,但在生产中长期大规模使用抗生素导致大肠埃希氏菌耐药性逐年增加。据国内外报道,奶牛乳房炎源大肠埃希氏菌对部分β-内酰胺类、四环素类、多肽类及磺胺类药物产生了严重的耐药性[6-10]。因此,天然抗菌剂的研究已成为当前的研究重点。
噬菌体(bacteriophage,简称phage)在防控细菌感染方面有巨大的潜力。J Porter等[11]用4种大肠埃希氏菌噬菌体制成鸡尾酒制剂,可抑制50%以上的大肠埃希氏菌乳腺炎分离株的生长;牛冬燕[12]将噬菌体鸡尾酒制剂用于降低牛的大肠埃希氏菌感染,取得了良好的效果。针对已获得的噬菌体,通常采用全基因测序、基因功能预测及进化树分析,从分子水平了解噬菌体特性。本研究以奶牛乳房炎源大肠埃希氏菌为宿主菌,从养殖场污水中分离纯化到一株裂解性肌尾噬菌体,并对其进行了基本的生物学特性的研究,以期为防治奶牛乳房炎积累材料。
1 材料和方法
1.1 材料
1.1.1 菌株和样品 20株奶牛乳房炎源大肠埃希氏菌(G1~G20)、4株金黄色葡萄球菌(J1~J4)、4株无乳链球菌(L1~L4),均由石河子大学动物科技学院传染病实验室分离保存;污水采自石河子大学试验站奶牛圈舍内。
1.1.2 主要试剂 LB肉汤培养基,生工生物工程(上海)股份有限公司产品;琼脂粉和20 g/L 磷钨酸负染液,北京索莱宝科技有限公司产品;进口铜网碳支持膜,北京中镜科仪有限公司产品;病毒基因DNA/RNA提取试剂盒,天根生化科技(北京)有限公司产品;DNase I、RNase A和Mung Bean Nuclease,康为世纪生物科技有限公司产品;DNA Marker DL 15 000,北京全式金生物技术有限公司产品。
1.1.3 主要仪器 台式冷冻离心机(MultifugeXLR)、全波长酶标仪(1530),美国赛默飞世尔科技有限公司产品;立式恒温振荡器(IS-RDV1),美国精骐有限公司产品;智能电热恒温水浴锅(HH-S3),常州市信科实验仪器厂产品;透射电子显微镜(HT7700),日立(中国)有限公司产品。
1.2 方法
1.2.1 培养基配置 SM缓冲液:NaCl 2.9 g,20 g/L 明胶2.5 mL,MgSO4·7H2O 1.0 g,1 mol/L Tris-HCl (pH7.5)25 mL,加蒸馏水定容至500 mL,120℃高压灭菌20 min,4℃保存。半固体LB肉汤培养基和固体LB肉汤培养基分别是在液体LB肉汤培养基基础上,加入7 g/L 和15 g/L的琼脂粉。
1.2.2 菌株准备 将试验所用菌株接种于液体LB内,在37℃恒温振荡器中180 r/min培养6 h~8 h至对数生长期,4℃保存备用。
1.2.3 噬菌体的分离与纯化 将采集的污水先后使用4层灭菌纱布和3层定性滤纸过滤,4℃静置5 h后用0.22 μm的一次性滤膜滤过除菌。取200 μL滤液和100 μL大肠埃希氏菌G17的菌悬液于3 mL的 2倍营养液体LB中,在37℃恒温振荡器中180 r/min 培养4 h后,12 000 r/min离心10 min,取上清液。上清液用液体LB连续6次10倍倍比稀释,各取100 μL稀释好的液体和大肠埃希氏菌G17菌悬液在无菌试管内混匀并孵育15 min,然后加入7 mL约45℃的半固体LB,摇匀后倒入平皿,待凝固后倒置放于37℃恒温培养箱培养10 h后观察结果。
1.2.4 噬菌体的纯化 用无菌枪头挑取生长良好的单个噬菌斑接种于100 μL大肠埃希氏菌G17菌悬液内,孵育15 min,加入5 mL液体LB肉汤培养基后置于37℃恒温振荡器培养4 h,离心后取上清用液体LB连续10倍倍比稀释,将稀释好的液体与大肠埃希氏菌G17菌悬液各取100 μL混匀吸附后采用双层琼脂法培养,此步骤反复4次以上,直到一个平板中的噬菌斑形态大小一致,即可得到纯化好的噬菌体,4℃保存备用。
1.2.5 噬菌体的浓缩及电镜观察 参考文献[13],采用超速离心法进行噬菌体颗粒的浓缩,浓缩液效价应不低于1.0×109PFU/mL 。将铜网(200目)置于噬菌体浓缩液内3 min后,用吸水纸吸干铜网上多余水分,再对铜网用20 g/L 磷钨酸负染液染色5 min,吸干水分后,红外灯照射30 min,送至石河子大学分析测试中心电镜实验室使用HT7700透射电镜(TEM)观察噬菌体形态。
1.2.6 噬菌体核酸类型的鉴定 使用病毒基因DNA/RNA提取试剂盒提取噬菌体核酸,分别用DNase I、RNase A和Mung Bean Nuclease和噬菌体基因组混匀后在37℃水浴条件下酶解2 h,采用琼脂(7 g/L )凝胶电泳法对消化产物进行检测。
1.2.7 噬菌体的生物学特性研究
1.2.7.1 噬菌体裂解谱的测定 将纯化好的噬菌体液100 μL以1∶1比例分别与20株奶牛乳房炎源大肠埃希氏菌、4株金黄色葡萄球菌、4株无乳链球菌菌悬液混匀孵育15 min后双层琼脂法培养10 h,观察有无噬菌斑。
1.2.7.2 噬菌体最佳感染复数(multiplicity of infection,MOI)的测定 将宿主菌和噬菌体分别培养至浓度约1.0×108CFU/mL和1.0×108PFU/mL,在菌液数量体积相同的情况下,按MOI分别为100、10、1、0.1、0.01、0.001、0.0001的比例加入相应数量体积的噬菌体液,混匀,吸附15 min,加入液体LB使每管的总量相同,在37℃恒温振荡器中180 r/min培养4 h,用双层琼脂法测定每个MOI的效价,单位为PFU/mL,滴度最高者为最佳MOI。重复3次,每次2个平行,取平均值绘制最佳感染复数的柱状图。
1.2.7.3 一步生长曲线的测定 将培养至对数期的菌液与噬菌体液按MOI=0.1混匀吸附15 min后加入适量的液体LB,在37℃恒温振荡器中180 r/min培养,分别在0、5 、10、15、20、25、30、40、50、60、70、80、90、110、130、150、170、190、210 min这19个时间点取样测噬菌体滴度。重复3次,每次2个平行,取平均值绘制噬菌体感染宿主菌G17的一步生长曲线。
1.2.7.4 热稳定性的测定 从50 mL噬菌体液中取100 μL测其滴度,剩余液体平均分装于31个灭菌EP管内,分别置于不同温度(40℃、50℃、60℃、70℃、80℃)的恒温水浴锅中,各温度内的噬菌体液每隔10 min取出1份测噬菌体滴度,直到第6次取样后方可结束。重复3次,每次2个平行,根据时间、温度与噬菌体滴度绘制热稳定曲线图。
1.2.7.5 pH稳定性的测试 分别取900 μL不同pH(pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0)的液体LB培养基,与100 μL噬菌体液混匀置于37℃的恒温水浴锅内孵育2 h后取出测定噬菌体滴度,重复3次,每次2个平行,根据pH与噬菌体滴度的不同,绘制曲线图。
2 结果
2.1 噬菌体的分离鉴定
以奶牛乳房炎源大肠埃希氏菌G17为宿主菌,从奶牛舍污水中分离出了一株噬菌体,采用双层琼脂平板法纯化4次以后,噬菌斑大小均匀一致,呈透亮的圆形,直径2.2 mm~2.4 mm,无晕圈且边缘整齐,将其命名为vB-EcoC-P17(简称P17)。对其浓缩液负染后进行透射电镜观察,显示噬菌体P17为有尾噬菌体,头部大小约63.4 nm×65.2 nm,尾部大小约114.4 nm×18.6 nm。
2.2 噬菌体P17的核酸类型鉴定
结果如图1所示,琼脂糖胶凝电泳后,噬菌体P17的核酸长度大于15 kb,酶(DNase I、RNase A和Mung Bean Nuclease)消化处理后电泳结果显示,其核酸能被DNase I降解,却不能被RNase A和Mung Bean Nuclease完全降解,表明噬菌体P17的核酸类型为双链DNA(double-stranded DNA,dsDNA)。
2.3 噬菌体P17的裂解谱鉴定
如表1所示,在20株奶牛乳房炎源大肠埃希氏菌(G1~G20)、4株金黄色葡萄球菌(J1~J4)、4株无乳链球菌(L1~L4)中,噬菌体P17可裂解6株大肠埃希氏菌,裂解率为30.00%(6/20);无裂解金黄色葡萄球菌及无乳链球菌的能力。
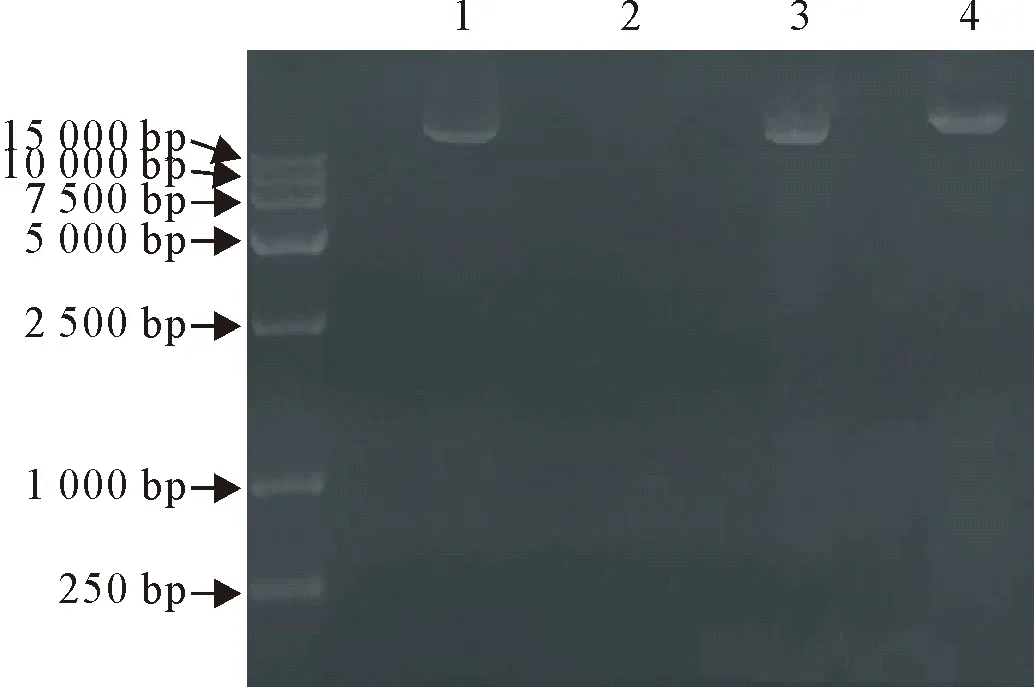
M.DNA标准DL 15 000;1.噬菌体核酸;2.DNase I;3.RNase A;4.Mung bean nucleaseM.DNA Marker DL 15 000;1.Nucleic acid of phage;2.DNase I;3.RNase A;4.Mung bean nuclease图1 噬菌体P17核酸类型的鉴定Fig.1 Identification of nucleic acid type phage

表1 噬菌体P17的宿主范围Table 1 Host range of phage P17
2.4 噬菌体P17最佳感染复数(MOI)的测定
如图2 所示,当感染复数为0.1时,噬菌体的效价最高,即0.1为噬菌体P17的最佳感染复数。
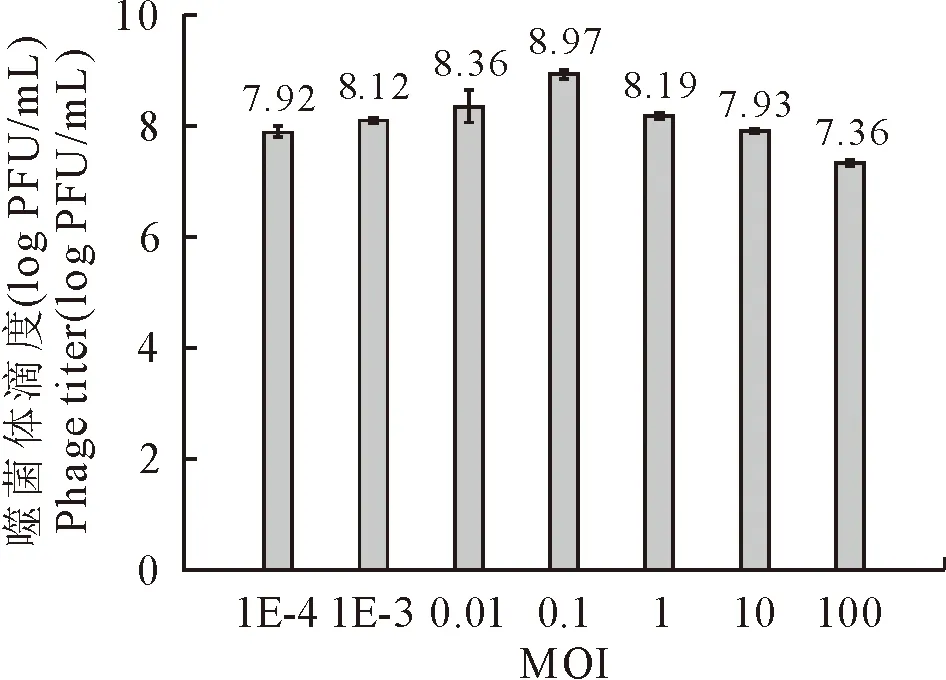
图2 噬菌体P17的MOI测定结果Fig.2 Determination of multiplicity of infection of phage 37
2.5 噬菌体P17一步生长曲线的测定
参考文献[14]中对噬菌体潜伏期、暴发期和平稳期的评定方法,确定噬菌体P17的潜伏期约20 min,在20 min~150 min时噬菌体的滴度持续上升,暴发期约130 min,裂解量约为17 PFU/cell(裂解量=裂解暴发末期噬菌体滴度/初期感染宿主菌浓度),之后噬菌体数量基本保持平衡,此时宿主菌基本全部被裂解,噬菌体滴度不再增长(图3)。
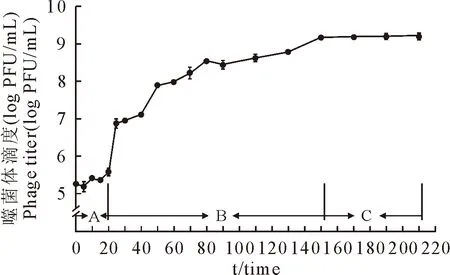
图3 噬菌体P17的一步生长曲线Fig.3 One-step growth curve of phage P17
2.6 噬菌体P17热稳定性的测定
噬菌体P17对温度的热稳定性测定结果显示,随着温度的升高和时间的延长,噬菌体的滴度在逐步下降。当温度升至70℃时,30 min就可使噬菌体P17全部失去活性(图4)。
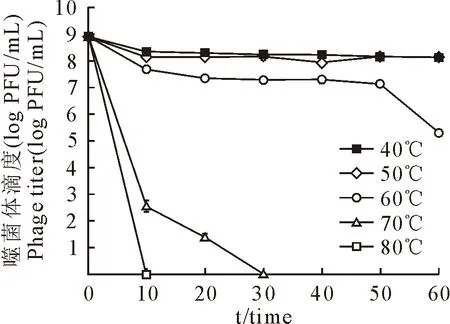
图4 噬菌体P17的耐热稳定性Fig.4 Stability of phage P17 to temperature
2.7 噬菌体P17酸碱耐受力的测定
由图5可知,在pH 5.0~11.0时,噬菌体P17的效价未发生大的改变。当酸碱度为pH 4.0和pH 12.0时,噬菌体P17效价仍大于1.0×106PFU/mL,当酸碱度pH ≤3.0或pH ≥13.0时,噬菌体P17完全失去活性。

图5 噬菌体P17的pH敏感性Fig.5 Sensitivity of phage P17 to pH
3 讨论
噬菌体是广泛存在于自然界细菌病毒中,凡是有细菌存在的地方就会有相应的噬菌体。噬菌体与其宿主菌进化关系密切,开展噬菌体的研究对了解致病菌的进化有一定意义。本研究采用双层琼脂平板法,从奶牛圈舍污水中分离到一株大肠埃希氏菌噬菌体,依据《病毒分类—国际病毒分类委员会第9次报告》中对噬菌体阶元的划分及噬菌体常规命名方法,将其命名为vB-EcoC-P17,其中vB代表viruses bacteriophage(病毒噬菌体);Eco代表Escherichiacoli(大肠埃希氏菌);C代表Caudovirales(尾噬菌体目)[14-15]。对噬菌体P17进行核酸类型鉴定,发现噬菌体P17的核酸类型为dsDNA,属于最常见的噬菌体核酸类型。
通过测试裂解谱发现,噬菌体P17只能裂解大肠埃希氏菌,对测试的大肠埃希氏菌裂解率为30.00%,与几株牛源、鸡源、驴源大肠埃希氏菌噬菌体相对比,裂解率差异不明显[16-19]。噬菌体由蛋白质与核苷酸构成,高温下蛋白易变性,P17在pH 5.0~11.0和60℃高温时均能保持较高活性,耐碱性明显高于王礼伟等[16]发现的5株牛源大肠埃希氏菌噬菌体,耐热性与之相似,说明噬菌体P17对外界不良环境有一定的适应性,在生产中利于保存及应用。与张倩等[17]发现的牛源大肠埃希氏菌噬菌体XJ2相比,噬菌体P17裂解暴发期更长,裂解量略强于XJ2,说明此噬菌体的杀菌效果较为理想。噬菌体P17的宿主菌在新疆患有奶牛乳房炎的样品中分布广泛,可考虑将其作为预防奶牛乳房炎噬菌体“鸡尾酒”制剂的一部分。
造成奶牛乳腺炎的原因复杂多样,由于目前缺少有效的疫苗,在生产实践中药物的不当使用已对食品安全和畜牧生产带来了严重的影响。在抗生素后时代的今天,解决菌株耐药性已成为人类必须攻破的壁垒,裂解性噬菌体是最有可能帮助人们对付细菌耐药性的手段之一。本分离株噬菌体为奶牛乳房炎的噬菌体防治研究与应用提供了材料。

