羟氯扎胺阿苯达唑复方混悬液中苯甲酸钠含量的HPLC测定
张东辉,陈玲玲,陈 晨,白玉彬1,董 朕,李 冰,周绪正
(中国农业科学院 兰州畜牧与兽药研究所 农村农业部兽用药物创制重点实验室 甘肃省新兽药工程重点实验室,甘肃兰州 730050)
羟氯扎胺阿苯达唑复方混悬液属于创新型复方制剂,主要用于治疗牛、羊吸虫病、线虫病,尤其是对肝片吸虫效果最佳,同时对绦虫也有一定效果[1-6]。羟氯扎胺阿苯达唑复方混悬液是多剂量包装口服混悬液,由于口服制剂的特殊性,在生产制备过程中很难完全避免微生物污染,为了保证制剂的安全性,防止药物变质而对患畜造成伤害,需要在处方中加入适量的抑菌剂,以达到防腐目的[7-9]。目前苯甲酸及其钠盐由于抑菌范围广,常常作为口服液体制剂的防腐剂[10],但是随着苯甲酸钠的广泛应用,其毒副作用也日渐突出,比如遗传毒性、生殖毒性、致癌性等[11-14]。国外已经开始禁止苯甲酸及其钠盐的使用,但在国内作为防腐剂仍然广泛用于食品和药物制剂中[15]。因此,抑菌剂的合理使用和质量控制成为保证药物安全的关键问题之一[16],故应对其含量进行严格控制。本文建立了高效液相色谱法(HPLC)对羟氯扎胺阿苯达唑复方混悬液中的苯甲酸钠进行含量测定,以便控制防腐剂苯甲酸钠的使用量,保证制剂的安全性,为制剂的质量标准提供参考。
1 材料与方法
1.1 材料
1.1.1 药品 羟氯扎胺阿苯达唑复方混悬液(批号:20210304、20210305、20210306),中国农业科学院兰州畜牧与兽药研究所研制。
1.1.2 主要试剂 苯甲酸钠标准品(批号:100433-201702),纯度99.7%,中国食品药品检定研究院提供;甲醇(色谱纯),赛默飞世尔科技(中国)有限公司产品;超纯水,广州屈臣氏食品饮料有限公司制备。
1.1.3 主要仪器 高效液相色谱仪(Agilent-LC 1290),安捷伦科技有限公司产品;电子天平(ME403),梅特勒-托利多仪器有限公司产品;数控超声波清洗器(KQ-600DE),昆山市超声仪器有限公司产品;优普超纯水制造系统(MPT-Ⅱ-40L),上海优普实业有限公司产品。
1.2 方法
1.2.1 色谱条件 色谱柱:Agilent ZORBAX C18(250 mm×4.6 mm,5 μm);柱温:35℃;进样量:10 μL;流速:1.0 mL/min;流动相:A相为0.02 mmol/L乙酸铵水溶液-B相为甲醇(85∶15);检测波长:224 nm。
1.2.2 溶液配制
(1)供试品溶液:精密量取羟氯扎胺阿苯达唑复方混悬液5 mL,置于100 mL量瓶中,加水溶解超声10 min并稀释至刻度,摇匀。离心,取上清液,即为供试品溶液。
(2)对照品溶液:精密称定苯甲酸钠对照品12.5 mg,置于25 mL量瓶中,用水超声溶解并稀释定容至刻度,充分摇匀,得对照品贮备液。准确移取对照品贮备液1.0 mL于10 mL量瓶中,用水稀释至刻度,制成50 μg/mL的苯甲酸钠对照品溶液。
(3)空白样品溶液:精密量取不含抑菌剂苯甲酸钠的羟氯扎胺阿苯达唑复方混悬液5 mL,置于100 mL量瓶中,加水溶解超声10 min并稀释至刻度,摇匀。离心,取上清液,即为空白样品溶液。
1.2.3 专属性试验 分别取“1.2.2”项下的对照品溶液、供试品溶液和空白样品溶液,按“1.2.1”项下的色谱条件进样分析,记录色谱图。
1.2.4 线性关系 分别精密量取50 μg/mL的苯甲酸钠对照品溶液0.5、1.0、2.0、3.0、4.0、5.0 mL于10 mL量瓶中,用水稀释定容至刻度,摇匀,制成浓度为2.5、5.0、10.0、15.0、20.0、25.0 μg/mL的系列对照品溶液。精密量取10 μL,按“1.2.1”项下的色谱条件进样分析,记录色谱图。以峰面积(y)为纵坐标,浓度(x,μg/mL)为横坐标,按最小二乘法进行线性回归。
1.2.5 精密度 进样精密度:精密量取“1.2.4”标准曲线下含15.0 μg/mL的苯甲酸钠对照品溶液10 μL,按“1.2.1”色谱条件进样分析,连续分析6次,记录色谱峰面积,计算峰面积RSD。
中间精密度:精密量取“1.2.2”供试品溶液6份,由甲、乙两人分别在不同时间段,使用两台不同仪器,按“1.2.1”色谱条件进样分析,记录色谱峰面积,计算峰面积RSD。
1.2.6 定量限与检测限 取“1.2.2”项下对照品贮备液逐级稀释,按“1.2.1”色谱条件进样分析,记录色谱图。以信噪比S/N为3时对应的浓度为检测限(LOD);以信噪比S/N为10时对应的浓度为定量限(LOQ)。
1.2.7 溶液稳定性试验 按“1.2.2”方法制备供试品溶液,在室温条件下放置,分别于0、2、4、6、8、12 h取样10 μL,按“1.2.1”色谱条件的进样分析,记录色谱图,计算峰面积的RSD值。
1.2.8 回收率试验 精密量取不含抑菌剂苯甲酸钠的供试品5 mL,置于100 mL量瓶中,共9份,分别加入 “1.2.2”对照品储备液1.6、2.0、2.4 mL,并用水稀释定容至刻度,摇匀,作为低、中、高(80%、100%、120%)3个浓度水平的供试品溶液,每个水平平行制备3份。按“1.2.1”条色谱条件进样分析,计算加样回收率。
1.2.9 样品含量测定 取羟氯扎胺阿苯达唑复方混悬液3批样品(批号:20210304、20210305、20210306),按“1.2.2”条方法制备供试品溶液,按“1.2.1”条色谱条件进样分并计算样品含量。
2 结果
2.1 专属性试验
由图1可知,在该色谱条件下,空白样品溶液对苯甲酸钠的测定无干扰;苯甲酸钠对照品的保留时间为5.440 min,供试品溶液的保留时间为5.206 min,表明在同一色谱条件下主峰保留时间基本一致,偏差在允许范围内。
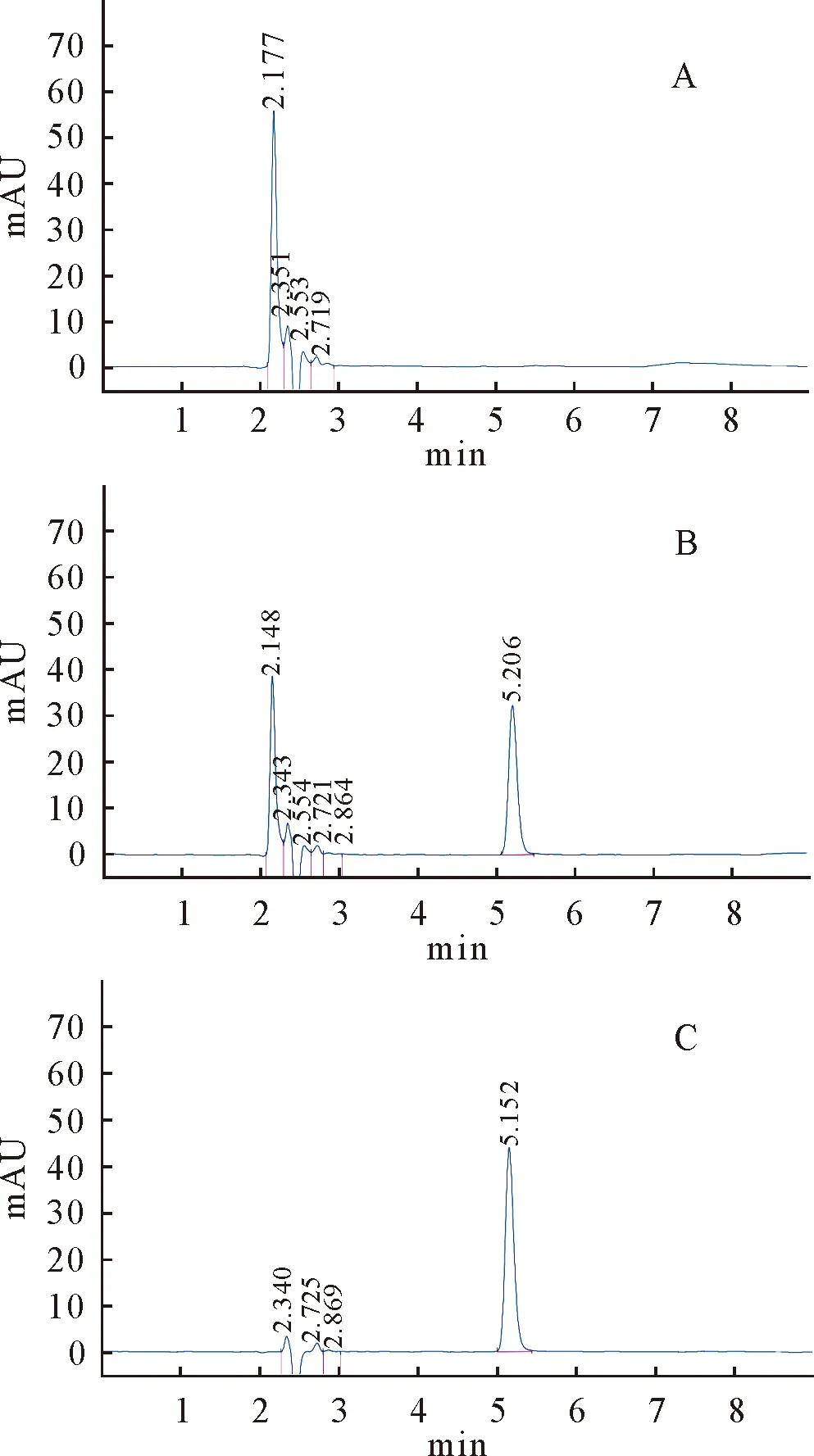
A.空白样品溶液;B.供试品溶液;C.对照品溶液A.Blank sample solution;B.Test solution;C.Control solution图1 专属性试验色谱图Fig.1 Chromatogram of the specificity test
2.2 线性关系
以浓度为横坐标,峰面积为纵坐标,采用最小二乘法做线性回归,得苯甲酸钠的回归方程为y=34.24x-5.1681,R2=1。表明苯甲酸钠在2.5 μg/mL~25.0 μg/mL浓度范围内呈良好的线性关系(图2)。
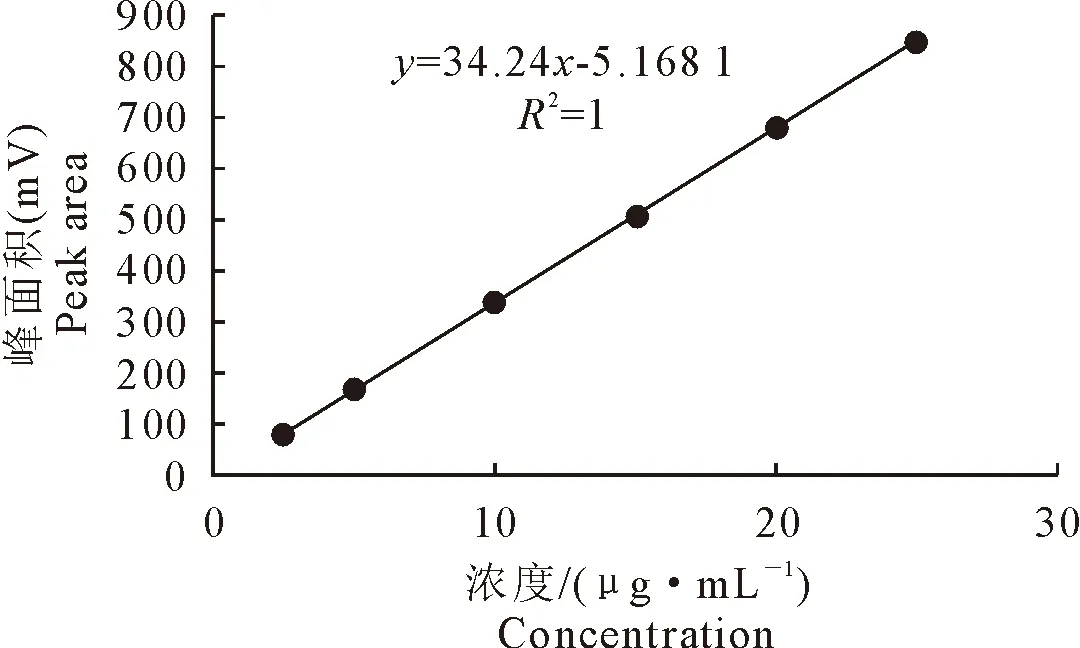
图2 标准曲线Fig.2 Standard curve

表2 精密度试验结果Table 2 Precision test results
2.3 精密度
2.3.1 进样精密度 连续进样6次,其峰面积的RSD小于2.0%,表明仪器精密度良好,仪器较稳定。
2.3.2 中间精密度 分别由甲、乙两个人在不同时间,使用不同仪器连续进样分析6次,其峰面积的RSD均小于2.0%,表明中间精密度良好。
2.4 定量限与检测线
试验结果表明,当S/N为10时,苯甲酸钠的定量限为0.75 μg/mL;当S/N为3时,苯甲酸钠的检测限为0.25 μg/mL。
2.5 溶液稳定性试验
在不同时间段对供试品溶液取样分析,苯甲酸钠峰面积的RSD值均小于2.0%,表明供试品溶液在12 h内稳定。
2.6 回收率试验
由表3结果可知,苯甲酸钠的平均回收率为95.90%,RSD<2.0%,证明该方法准确性好。

表3 加样回收率试验结果(n=9)
2.7 样品含量测定
按照上述含量测定方法,对3批羟氯扎胺阿苯达唑复方混悬液供试品进行测定,记录峰面积并计算样品含量。结果表明,3批样品中抑菌剂苯甲酸钠含量均在标示量的90%~110%之间,其结果见表4。
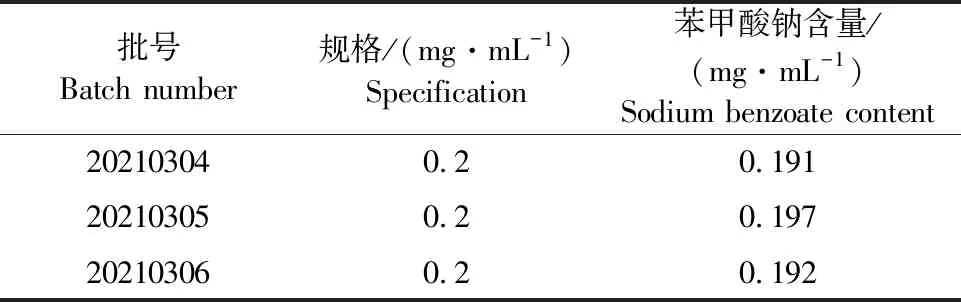
表4 样品含量测定结果Table 4 Results of sample content determination
3 讨论
参考相关文献资料[17],测定苯甲酸钠所选用的波长分别为220 nm、230 nm。为了进一步确定羟氯扎胺阿苯达唑复方混悬液中抑菌剂苯甲酸钠的最大吸收波长,采用DAD检测器对苯甲酸钠溶液进行全波长扫描,结果发现苯甲酸钠的最大吸收波长为224 nm,所以选用224 nm作为检测波长。
分别考察了不同体系的流动相对供试品中苯甲酸钠的分离情况,结果发现,在各峰分离度和峰形上,乙酸铵-甲醇体系明显优于水-甲醇体系、乙酸铵-乙腈体系;同时又考察了流动相中含不同浓度的乙酸铵对柱效的影响,最后选用0.02 mol/L乙酸铵水溶液-甲醇(85∶15)为流动相,结果各峰之间分离度良好,且峰形对称,基线平稳。
2015版《兽药典》四部通则1121抑菌效力检查法,用于指导生产企业在研发阶段制剂中抑菌剂浓度的确定[18]。通过测定混悬液的抑菌活性,来确定混悬液中防腐剂的最低有效剂量是否添加合理,但对于制剂中防腐剂使用的上限却无限制[19]。同时对于防腐剂苯甲酸钠的添加量没有明确规定,制剂中防腐剂的添加量主要由研发企业自主研发决定,致使不同厂家的同一制剂中苯甲酸钠含量差别较大,甚至同一厂家的不同批次中苯甲酸钠含量也有一定差别[9,10,20,21]。在通则0181项下规定:口服液体制剂的合剂使用苯甲酸钠时,用量(以苯甲酸计)不得超过0.3%[18]。为了临床用药安全,测定及控制制剂中防腐剂苯甲酸钠的含量具有重要意义。
目前,有关HPLC法测定制剂中抑菌剂苯甲酸钠含量的报道较多,但本方法灵敏度高,操作简捷,准确性、专属性强,适用于羟氯扎胺阿苯达唑复方混悬液中抑菌剂苯甲酸钠的含量测定,严格控制产品质量,进一步为质量标准提供参考。

